次黄嘌呤灌胃加冰敷法诱导大鼠急性痛风性关节炎模型
2014-11-30孙赛君袁卉蒋金鹏陶露钱锋
孙赛君,袁卉,蒋金鹏,陶露,钱锋
(长江大学医学院,湖北荆州434023)
痛风性关节炎是因嘌呤代谢紊乱导致高尿酸血症、尿酸盐在关节周围沉积而引起的炎症反应,临床表现主要为红肿热痛[1-2]。目前国内外针对痛风性关节炎治疗药物的研究以降低血尿酸水平、消炎、消肿和镇痛为主[3-5]。而研究所用动物模型仍以Coderre在1987年建立的关节腔注射微晶尿酸钠(MSU)大鼠痛风性关节炎模型为主[6]。但是该模型并未涉及痛风性关节炎的发病基础——高尿酸血症,在评价抗痛风药物的作用机制上有明显缺陷。相对而言,高尿酸血症的动物模型比较容易建立。目前有高嘌呤膳食、尿酸酶抑制剂和破坏尿酸酶表达基因等方法[7-9]。然而因多数哺乳动物体内都存在人体内没有的尿酸酶,所以将高尿酸血症模型转化为痛风模型极为困难[10]。国内出现了联合使用Coderre法和尿酸酶抑制剂或次黄嘌呤建立高尿酸痛风大鼠模型的尝试[10],但该方法只是分别诱发急性痛风性关节炎和高尿酸血症,因此未被广泛采用。现存急性痛风性关节炎模型都有很多不完善之处,给痛风性关节炎的研究带来了极大的不便,因此建立高尿酸血症诱发的痛风性关节炎动物模型迫在眉睫。
从人类痛风性关节炎的发病情况来看,高尿酸血症是其发病基础,而寒冷的外部环境是其重要诱发因素之一。本实验将以次黄嘌呤灌胃这种简单的方法诱导大鼠短时间内出现高嘌呤血症,同时对大鼠右下肢膝关节部位进行冰敷,观察是否可诱发急性痛风性关节炎。如果诱发成功,则为该疾病的基础和临床研究建立了更为适用的动物模型。另外,因次黄嘌呤灌胃和冰敷对大鼠创伤较小,可重复多次进行,所以本实验还将尝试通过重复诱导同一关节的痛风来观察是否可以建立慢性痛风性关节炎模型。
1 材料与方法
1.1 材料
SD大鼠,雄性,体质量(200±20)g,由武汉大学动物实验中心提供,实验动物饲养许可证号:SCXK(鄂)2008-0004。次黄嘌呤(Sig ma产品)。
1.2 方法
1.2.1 次黄嘌呤溶液配置 次黄嘌呤5g溶于100 ml蒸馏水中,配成5%溶液,灌胃剂量按10 ml/kg体质量来计算。
1.2.2 动物分组 健康雄性SD大鼠25只,适应性喂养1周后,随机分4组进行实验:正常组7只;冰敷组6只;次黄嘌呤灌胃组6只;次黄嘌呤灌胃加冰敷组6只。
1.2.3 冰敷方法 小气球灌水冷冻1~2h,形成冰水混合物。将需要冰敷的SD大鼠以仰卧位包裹固定于木板上,保持右下肢伸直微曲。将含冰水混合物的小气球用纱布包裹放置于右下肢膝关节正上方,接触面覆盖膝关节正面和左右两侧。每半小时更换一次,保持低温。每天持续冰敷3h。次黄嘌呤灌胃加冰敷组大鼠在灌胃完成半小时后开始冰敷,其它同冰敷组。
1.2.4 结果判定 ①关节肿胀程度:冰敷完成1h后,关节屈位,测量横向最大径。每只大鼠取右下肢最大径减左下肢最大径差值,组内求平均值,然后进行组间统计学分析。②步态评分标准:冰敷完成2h后,观察大鼠步态,正常行走记0分;轻微跛行,即右下肢略有弯曲,记1分;跛行,即右下肢可触及地面但明显弯曲,记2分;重度跛行,即右下肢不触及地面,仅三足行走,记3分。组内求平均值,然后进行组间统计学分析。
1.3 统计学分析
2 结果
2.1 各组大鼠右侧膝关节肿胀程度比较
实验过程持续10d,次黄嘌呤灌胃加冰敷组大鼠从第3天开始出现显著的关节肿胀及其它身体不适反应,第7天开始出现食欲不振和腹泻,实验第10天出现死亡,6只大鼠中死亡2只,于是决定停止实验。与正常组大鼠比较,冰敷组和次黄嘌呤灌胃加冰敷组大鼠右侧膝关节肿胀都有统计学差异(P<0.01),尤以第3~7天次黄嘌呤灌胃加冰敷组的改变最为明显。第2~7天,次黄嘌呤灌胃加冰敷组对比冰敷组也有统计学差异(P<0.01)。图1中显示了第1~10天各组大鼠左右膝关节横向最大径差值的组内平均值和标准差。
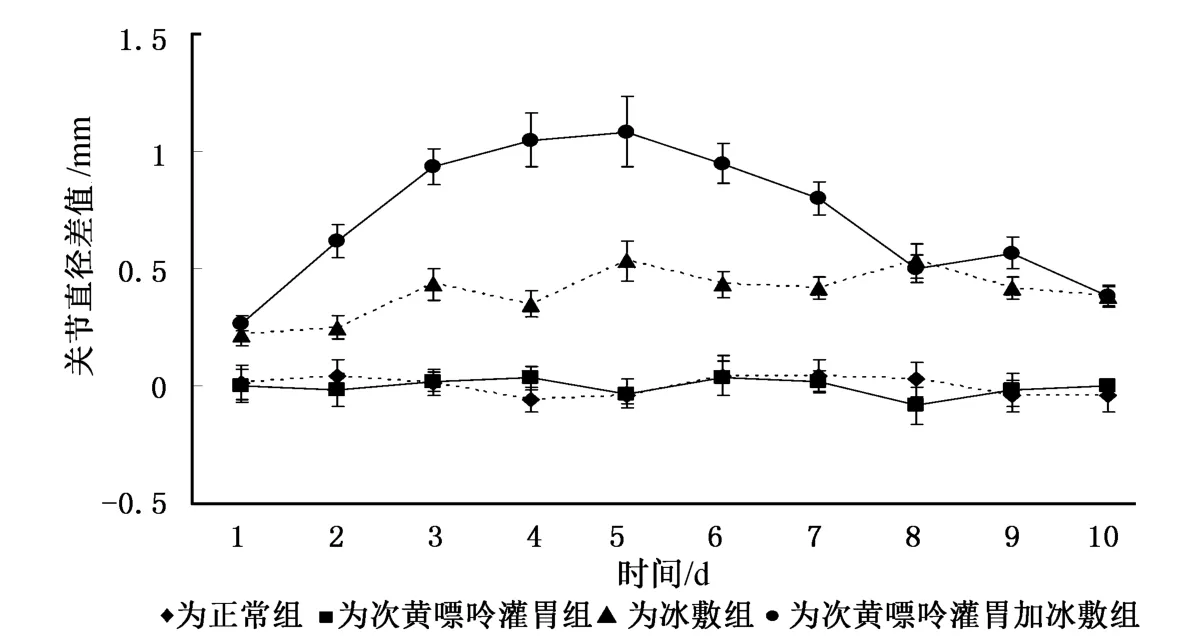
图1 不同时相各组大鼠左右膝关节横向最大径差值比较
2.2 各组大鼠步态评分比较
正常组、次黄嘌呤灌胃组和冰敷组大鼠在实验期间步态均无异常,仅次黄嘌呤加冰敷组大鼠在实验第3~6天出现轻度跛行,第1~6天步态评分分别为:0、(0.5±0.55)、(1.5±0.55)、(1.8±0.4)、(1.8±0.4)、(1.7±0.52)分。第7天开始,该组大鼠在冰敷后出现明显身体不良反应,如食欲不振、腹泻、毛发竖立、活动减少等。冰敷后数小时内,该组大鼠多俯卧不动,刺激无效,故难以判断步态,而且从偶尔站立情况来看,左右下肢并无显著差异。因此,从第7~10天,次黄嘌呤加冰敷组大鼠步态评分都记为零。
2.3 大鼠关节形态学检查
为了观测重复次黄嘌呤灌胃加冰敷对大鼠膝关节是否可造成长期影响,在停止灌胃和冰敷3d后,再次检测该组大鼠右下肢膝关节肿胀程度和步态,并以戊巴比妥钠麻醉后暴露右下肢膝关节进行形态学检测。结果发现关节肿胀消失,步态正常,镜下形态学特征与正常关节无差异。
3 讨论
人类易发痛风是因长期高嘌呤饮食和体内缺乏尿酸酶等因素导致的嘌呤代谢紊乱、高尿酸血症,最终尿酸盐因饱和在组织内沉积而引起[1]。哺乳类实验动物体内都含有尿酸酶,可迅速将体内过多的尿酸代谢为水溶性良好并无毒的尿囊素随尿液排出体外,因此通过高尿酸血症诱发痛风动物模型极为困难[11]。考虑到低温环境对痛风性关节炎的诱发作用,而国内亦有通过单纯低温处理小鼠膝关节制备骨性关节炎动物模型的先例[12],笔者设计以次黄嘌呤灌胃法建立的高尿酸血症大鼠模型为基础,并在灌胃后立即对大鼠右下肢膝关节持续冰敷3h以促发尿酸盐在低温局部析出结晶,从而建立急性痛风性关节炎大鼠模型。次黄嘌呤灌胃法建立的高尿酸血症大鼠模型可致血尿酸水平短时间内达到500μmol/L左右[9],而尿酸盐在30oC时的最大溶解度不足300μmol/L[13],若不考虑大鼠关节腔内组织液与血液间尿酸盐浓度的差异,则以局部冰敷促使膝关节内发生尿酸盐结晶在理论上是可行的。
实验结果表明单纯次黄嘌呤灌胃组大鼠对比正常对照组未出现肿胀和步态异常。而冰敷组大鼠膝关节在每次冰敷后都有一定程度肿胀,虽然与正常对照组有统计学差异,但肿胀程度并不明显,可能与低温导致的关节水肿和炎症反应有关[12]。冰敷组大鼠并未表现显著的步态异常。虽然文献有通过持续低温刺激膝关节30d建立骨性关节炎小鼠模型的报道,但在本实验的实际操作中却发现诸多不便。其一,未经过麻醉将动物固定并暴露单侧膝关节进行长时间冰敷实际对动物是一种制动,对后期行为学评价有影响;其二,操作有困难,大鼠膝关节部位较小,冰敷范围难以控制;其三,冰敷组大鼠在重复多天冰敷后出现明显身体不适,如活动力下降、腹泻和食欲减退等,说明该操作不可长期持续,否则会严重影响对结果的评价。本实验中,冰敷组大鼠持续冰敷10d,对比次黄嘌呤灌胃加冰敷组,未出现死亡和严重不良反应,但都有轻微不适,在停止实验3d后都恢复正常。
次黄嘌呤灌胃加冰敷组大鼠右下肢膝关节的肿胀程度,与其它实验组之间都存在统计学差异(P<0.01),尤以第3~6天最为显著(见图1)。而步态评分亦显示该组大鼠在第3~6天的活动障碍最为明显,至少表现为轻度跛行,多数大鼠表现为中度跛行。在实验过程中,从第1~10天,关节肿胀程度随着实验进程有明显波动,出现一定的时间依赖性,这可能与高尿酸血症建模中尿酸在实验动物体内累积的浓度有关[10]。在一定范围内,痛风性关节炎的严重程度应与血尿酸浓度呈正相关。当血尿酸浓度达到或超过尿酸的饱和度后即可析出并诱发急性痛风性关节炎,且严重程度会随浓度的增加而加重。如图1所示,血尿酸浓度应在第五天达高峰值,而后会随着尿酸酶的代偿性增多和活化而逐渐下降,最终与冰敷组相似。因此,在后期建模中加入尿酸酶抑制剂(如氧嗪酸)可能会有更好的效果9。
由于次黄嘌呤灌胃加冰敷组大鼠在第10天出现2例死亡(2/6),所以被迫停止实验。停止实验3d后该组其它大鼠各项观测数据比较正常组均无统计学差异(P>0.05),镜下检查大鼠关节软骨组织形态亦无差异,说明实验组大鼠已完全恢复,未能诱发慢性痛风性关节炎。这可能是因为大鼠本身具备尿酸酶,可以很好的矫正高尿酸血症和清除沉积的尿酸结晶。初步认为,如果无法建立稳定的高尿酸血症动物模型就难以建立以此为基础的慢性痛风性关节炎动物模型。
综上所述,重复次黄嘌呤灌胃和低温处理大鼠膝关节可诱发大鼠急性痛风性关节炎模型,与其它现有动物模型相比更符合人类痛风的发病机制。该模型完全模拟人类由高嘌呤膳食和低温环境诱发的痛风性关节炎发病机制,且避免了关节腔注射等外界干扰因素,更适用于目前对急性痛风性关节炎的相关基础和临床研究,也可成为建立完美的痛风性关节炎动物模型的基础。
[1]Chilappa CS,Aronow WS,Shapiro D,et al.Gout and hyper uricemia [J].Co mpr Ther,2010,36:3-13.
[2]Harr old L.New develop ments in gout [J].Curr Opin Rheu matol,2013,25(3):304-309.
[3]Chohan S,Becker MA.Update on emer ging urate-lowering t herapies [J].Curr Opin Rheu matol,2009,21(2):143-149.
[4]Mur unikkara V,Rasool M.Trikat u,a her bal co mpound t hat suppresses monosodiu m urate cr ystal-induced inflammation in rats,an experi mental model for acute gouty art hritis [J].Cell Biochem Funct,2013,32(1):106-14.doi:10.1002/cbf.2979.
[5]Pragasa m SJ,Rasool M.Dietary co mponent p-cou maric acid suppresses monosodiu m urate crystal-induced infla mmation in rats Mur unikkara V,Rasool M.Trikat u,a her bal co mpound t hat suppresses monosodiu m urate crystal-induced infla mmation in rats,an experi mental model for acute gouty art hritis [J].Inflamm Res,2013,62(5):489-498.
[6]Coderre TJ,Wall PD.Ankle joint urate art hritis(AJUA)in rats:an alter native ani mal model of art hritis to t hat produced by Freund's adjuvant Mur unikkara V,Rasool M.Trikat u,a her bal co mpound t hat suppresses monosodiu m urate crystal-induced inflammation in rats,an experi mental model for acute gout y art hritis [J].Pain,1987,28(3):379-393.
[7]Chen X,Burdett TC,Desjardins CA,et al.Disr upted and transgenic urate oxidase alter urate and dopaminer gic neur odegeneration[J].Proc Natl Acad Sci USA,2013,110(1):300-305.
[8]Shi Y W,Wang CP,Wang X,et al.Uricosuric and nephropr otective pr operties of Ramul us Mori et hanol extract in hyper uricemic mice[J].J Et hnophar macol,2012,143(3):896-904.
[9]徐立,时乐,仲文欣 .尿酸酶抑制剂在大鼠急性高尿酸血症模型复制中的应用 [J].中国比较医学杂志,2007,17(3):142-146.
[10]姚丽,刘树民,于书仪 .痛风性关节炎动物模型的改良 [J].中国实验动物学报,2009,17(3):210-212.
[11]时乐,徐立 .痛风性关节炎动物模型的研究现状与展望 [J].中国实验动物学报,2006,14(1):71-74.
[12]刘安军,陈宏硕,刘颖芬,等 .小鼠骨性关节炎的模型制备及评价 [J].中国现代医学杂志,2008,18(8):1045-1047.
[13]杨洪霞,杨丽芸,张灵敏,等 .痛风饮对实验性急性痛风性关节炎大鼠抗炎镇痛作用机制的研究 [J].时珍国医国药,2008,19(11):2784-2786.
