添加次黄嘌呤对环磷酸腺苷发酵产苷的影响
2016-03-30徐晓静余筱敏李俊惺刘景良王茜常景玲
徐晓静,余筱敏,李俊惺,刘景良,王茜,常景玲
(1.现代生物育种河南省协同创新中心,河南新乡453003;2.河南科技学院,河南新乡453003;3.沈阳农业大学生物科学技术学院,辽宁沈阳110866)
添加次黄嘌呤对环磷酸腺苷发酵产苷的影响
徐晓静1,2,余筱敏3,李俊惺1,2,刘景良1,2,王茜1,2,常景玲1,2
(1.现代生物育种河南省协同创新中心,河南新乡453003;2.河南科技学院,河南新乡453003;3.沈阳农业大学生物科学技术学院,辽宁沈阳110866)
研究了由次黄嘌呤发酵制造cAMP时发酵培养基中次黄嘌呤质量浓度及次黄嘌呤添加方式对cAMP发酵产苷的影响.结果表明:发酵培养基中次黄嘌呤采用一次性添加和分两批添加,经过发酵培养,次黄嘌呤质量浓度在0.018 g/L时cAMP产苷最高达6.86 g/L,在此条件下,次黄嘌呤分量两次添加cAMP发酵产苷最高可达7.23 g/L.过量的次黄嘌呤对菌种生长有抑制作用,发酵培养基中次黄嘌呤只有在最适的质量浓度下才能有效地提高cAMP发酵产苷水平,且采用次黄嘌呤分批添加更有利于cAMP发酵产苷.
环磷酸腺苷;次黄嘌呤;发酵;产苷
环磷酸腺苷(cAMP)是细胞内参与调节物质代谢和生物学功能的重要物质,是生命信息传递的“第二信使”[1].在体内可以促进心肌细胞的存活,增强心肌细胞抗损伤、抗缺血和缺氧能力,改善心功能.在临床上主要用于治疗心功能不全、心绞痛和心肌梗死.它是人体内广泛存在的一种具有生理活性的重要物质,由三磷酸腺苷在腺苷环化酶催化下生成,能调节细胞的多种功能活动.作为激素的第二信使,在细胞内发挥激素调节生理机能和物质代谢作用,能改变细胞膜的功能.此外,对糖、脂肪代谢、核酸、蛋白质的合成调节等起着重要的作用[2-3].以发酵法生产cAMP,是目前众多生产方法中最环保、最高效的方法[4].生产cAMP的方法可分为发酵法和酶法.发酵法可进一步分为补救合成途经和从头合成途经,补救合成途经是目前cAMP产率最高的方法[5-6].本文通过补救合成途经由次黄嘌呤制造cAMP,重点研究了发酵培养基中次黄嘌呤浓度对cAMP发酵产苷的影响.
1 材料与方法
1.1 试验材料
菌种:节杆菌(Arthrobacter sp.)A.sp01,河南科技学院生命科技学院发酵工程实验室保存菌株.
仪器:LXJ-IIC/B高速离心机(上海安亭科学仪器厂)、LDZX-50KBS高压灭菌锅(上海申安医疗器械厂)、SW-CJ-2FD双人垂直净化工作台(苏净集团安泰公司制造)、ZWF-2112摇床(上海智城分析仪器制造有限公司)、UV-5800紫外分光光度计(上海元析科技仪器有限公司).
试剂:cAMP标准品,葡萄糖、蛋白胨、牛肉膏、氯化钠、尿素、酵母膏、生物素、次黄嘌呤、磷酸氢二钾、磷酸二氢钾、氯化钴、硫酸镁、氟化钠、琼脂、盐酸、氢氧化钠均为化学纯.
斜面培养基:每100 mL培养基含葡萄糖1 g、蛋白胨1 g、牛肉膏1 g、NaCl 0.3 g、尿素0.4 g、酵母膏1 g、琼脂2 g,用蒸馏水补至100 mL,调pH至7.0,121℃、高压蒸汽灭菌30 min.
种子培养基:每100 mL培养基含葡萄糖1 g、蛋白胨1 g、牛肉膏1 g、NaCl 0.3 g、尿素0.4 g、酵母膏1 g,用蒸馏水补至100 mL,调pH至7.2,121℃、高压蒸汽灭菌30 min.
发酵培养基:每100 mL培养基含葡萄糖5 g,蛋白胨0.5 g,氯化钴0.001 g,生物素0.03 g,硫酸镁0.5 g,尿素1 g,磷酸二氢钾1 g,氟化钠0.01 g,磷酸氢二钾1 g,次黄嘌呤0.2 g,用蒸馏水补至100 mL,调pH至7.5,121℃、高压蒸汽灭菌30 min.
1.2 试验方法
1.2.1 菌体的活化配制斜面种子培养基,121℃,30 min灭菌.在超净工作台接菌种于斜面培养基上,于恒温培养箱中30℃培养24 h.可多次进行活化,至菌种活性稳定.
1.2.2 种子培养配制摇瓶种子培养基于250 mL锥形瓶中装30 mL培养基,121℃,30 min灭菌.将上述活化的斜面菌株在超净工作台上接种,30℃、160 r/min摇床培养24 h.
1.2.3 摇瓶发酵配制发酵培养基,250 mL锥形瓶装30 mL培养基,121℃,30 min灭菌.按接种量15%将摇瓶种子接入发酵培养基中,30℃、190 r/min培养72 h.
1.2.4 发酵培养基中次黄嘌呤对cAMP产苷的影响配制含次黄嘌呤的发酵培养基,次黄嘌呤的质量浓度分别为0、0.006、0.008、0.010、0.012、0.014、0.016、0.018、0.020、0.022、0.024 g/L,250 mL锥形瓶装30 mL培养基,121℃、30 min灭菌.按接种量15%将摇瓶种子接入发酵培养基中,30℃、190 r/min培养72 h[8].
1.2.5 发酵培养基中最佳次黄嘌呤质量浓度验证性实验根据上述试验结果确定发酵培养基中最佳次黄嘌呤质量浓度,在最佳质量浓度条件下,连续做7批验证性发酵,考查cAMP的产苷水平.
1.2.6 发酵培养基中次黄嘌呤添加方式对cAMP产苷的影响发酵培养基中次黄嘌呤质量浓度在最佳的条件下,采取将次黄嘌呤一次性添加到发酵培养基中和分两次添加,即初始发酵培养基添加1/2次黄嘌呤量,发酵36 h时再添加1/2次黄嘌呤量.30℃、190 r/min培养72 h.
1.2.7 发酵液中cAMP含量的测定采用紫外分光光度计法测定cAMP的质量浓度[7].精确配制质量浓度分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0 g/L的标准品溶液,在波长260 nm条件下,测定标准品溶液的吸光度,制作标准曲线.将发酵液于离心机中,3 000 r/min离心15 min,取上清液于紫外分光光度计上260 nm波长测定发酵液中cAMP的质量浓度.
2 结果与分析
2.1 cAMP标准曲线
精确配制质量浓度分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0 g/L的cAMP标准品溶液,其标准曲线见图1.
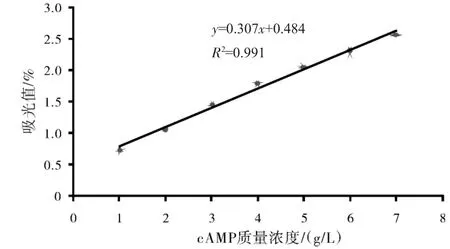
图1 cAMP标准曲线Fig.1 The standard curve line ofcAMP
2.2 不同次黄嘌呤质量浓度对cAMP产苷的影响
发酵培养基中添加不同质量浓度次黄嘌呤时的cAMP发酵产苷结果见表1.

表1 不同次黄嘌呤质量浓度发酵cAMP产苷结果Tab.1 The results ofcAMP production with different concentrations ofhypoxanthine
2.3 发酵培养基中最佳次黄嘌呤质量浓度验证性实验结果
配制次黄嘌呤底物质量浓度为0.018 g/L的发酵培养基,连续做7批摇瓶发酵培养,cAMP的产量见表2.

表2 七批次含0.018 g/L次黄嘌呤发酵的验证实验结果Tab.2 The results ofcAMP production for seven fermentation batches with 0.018 g/Lhypoxanthine addition
2.4 发酵培养基中次黄嘌呤添加方式对cAMP产苷的影响结果
采取将次黄嘌呤一次性添加到发酵培养基中和分两次添加,即初始发酵培养基添加1/2次黄嘌呤量,发酵36 h时再添加1/2次黄嘌呤量,发酵产苷见表3.

表3 次黄嘌呤添加方式对cAMP产苷的影响Tab.3 The effect ofhypoxanthine addingmode on cAMP production
3 结论
利用核苷酸生物合成补救途径由次黄嘌呤发酵制造cAMP,发酵培养基中次黄嘌呤质量浓度及次黄嘌呤的添加方式对cAMP发酵产苷有显著影响.过量的次黄嘌呤对菌种生长有抑制作用,发酵培养基中次黄嘌呤只有在最适的质量浓度下才能有效地提高cAMP发酵产苷水平,同时发酵培养基中次黄嘌呤采用分批添加更有利于提高cAMP产苷率.
[1]樊军,石奇,尚红伟,等.环磷酸腺苷的研究进展[J].中国现代应用药学杂志,2005,22(7):597-599.
[2]LIAOW,LIUY,CHENSL.Studyingpelletformation ofafilamentousfungus Rhizopus oryzae toenhanceorganicacid production[J]. Applied Biochemistry and Biotechnology,2007,137(1):689-701.
[3]WU Z F,DU G C,CHEN J.Metabolic characters and fermentation kinetics of batch cultures to produce CoQ10 by Rhizobium radiobacter[J].Journal ofChemical EngineeringofChinese Universities,2004,18(2):191-195.
[4]申艳红,张文升.环磷酸腺苷的合成[J].中国医药工业杂志,2004,35(3):132-133.
[5]张克旭,陈宁,张蓓.代谢控制发酵[M].北京:中国轻工业出版社,1998:354.
[6]Stephanopoulos GN,Aristidou AA.代谢工程:原理与方法[M].赵学明,白冬梅,译.北京:化学工业出版社,2003:12.
[7]张勇慧,王晶,吴继洲.浙贝乙素及其衍生物对豚鼠支气管平滑肌环磷酸腺苷的影响[J].中华中医药学刊,2007,25(12):2484-2485.
[8]杨天佑,田静,常景玲,等.次黄嘌呤流加对鸟苷发酵的影响[J].湖北农业科学,2010,49(8):1962-1965.
[9]岑沛森,蔡谨.工业微生物学[M].北京:化学工业出版社,2000:199-201.
(责任编辑:邓天福)
Effect of hypoxanthine addition content and mode on cyclic adenosine monophosphate production
XU Xiaojing1,2,YU Xiaomin3,LI Junxing1,2,LIU Jingliang1,2,WANG Qian1,2,CHANG Jingling1,2
(1.Cllabortive lnnovation Center ofModern Biological BreedingofHenan Province,Xinxiang453003, China;2.Henan Institute ofScience and Technology,Xinxiang453003,China;3.School ofBiological Science and Technology,ShenyangAgriculture University,Shenyang110866,China)
The influence of hypoxanthine addition content and modes on cAMP production with nucleotide remedy pathway was investigated in this study.Hypoxanthine was added into fermentation medium with 11 different concentrations and 2 different modes(by one lot or two lots).The results showed that cAMP production reached the maximum of 6.86 g/L when 0.018 g/L hypoxanthine was added by one lot,and cAMP production reached the maximum of 7.23 g/L with 0.018 g/L hypoxanthine addition by two lots.It has been proved that the growth of bacteria could be inhibited by excess hypoxanthine,and the cAMP fermentation production could be effectively improved only when hypoxanthine was added at the optimum concentration in fermentation medium.In addition,adding hypoxanthine by multiple lots would benefit cAMP fermentation more.
cyclic adenosine monophosphate;hypoxanthine;fermentation;cAMP production
TQ464.3
A
1008-7516(2016)03-0022-04
10.3969/j.issn.1008-7516.2016.03.005
2016-03-15
国家级大学生创新创业训练计划项目(201410467001)
徐晓静(1994―),女,河南开封人,本科生.
常景玲(1963―),女,河南新乡人,教授.主要从事发酵制药研究.
