吡哆胺对人肾小管上皮HK-2细胞凋亡及纤维化因子表达的影响
2014-11-28朱鹏立余惠珍
袁 音,朱鹏立,林 帆,余惠珍
(福建省立医院老年科 福建省临床老年病研究所 福建医科大学省立临床医学院, 福建 福州 350001)
研究论文
吡哆胺对人肾小管上皮HK-2细胞凋亡及纤维化因子表达的影响
袁 音,朱鹏立*,林 帆,余惠珍
(福建省立医院老年科 福建省临床老年病研究所 福建医科大学省立临床医学院, 福建 福州 350001)
目的探讨吡哆胺对人近曲肾小管上皮HK-2细胞凋亡及纤维化因子表达的影响及其作用机制。方法以吡哆胺(P)和替米沙坦(T)分别干预血管紧张素Ⅱ(AngⅡ)作用的HK-2细胞,分为对照组、AngⅡ(10-6mol/L)组、AngⅡ分别加T(10-5mol/L)组、P(0.01、0.1、1和10 mmol/L)、T+P(1 mmol/L)组,采用MTT法检测细胞存活率,Annexin V-FITC双染法检测细胞凋亡,流式细胞术分析活性氧簇(ROS)水平,ELISA检测细胞上清液晚期糖基化终末产物(AGEs)浓度,real-time PCR检测糖基化终末产物受体(RAGE)、TGF-β1、CTGF和MMP-9 mRNA表达,Western blot检测RAGE、TGF-β1、CTGF表达和NF-κB P65磷酸化水平。结果与AngⅡ组相比,吡哆胺和替米沙坦均增加HK-2细胞存活率,抑制细胞早期凋亡,降低细胞上清液AGEs浓度,减少ROS生成,下调RAGE、TGF-β1、CTGF、MMP-9 mRNA/蛋白表达和NF-κB P65磷酸化水平(均P﹤0.01)。吡哆胺的作用较替米沙坦显著(P<0.05或P<0.01),合用组的作用较替米沙坦单用组显著(P<0.01)。结论吡哆胺可能通过降低AGEs-RAGE水平、改善氧化应激以及减少NF-κB P65磷酸化,从而抑制细胞凋亡并下调纤维化分子表达。
吡哆胺;血管紧张素Ⅱ;糖基化终末产物;细胞凋亡;纤维化
近曲小管上皮细胞是肾小管间质的主要功能细胞,在局部肾素-血管紧张素系统(renin-angiotensin system, RAS)的影响下,细胞的增殖与凋亡动态平衡被破坏,同时各类炎症介质及纤维化因子的表达上调,从而进一步加速肾小管间质纤维化的进程[1- 2]。晚期糖基化终末产物(advanced glycation end products, AGEs)是糖基化反应所生成的一系列终产物的总称。目前认为血管紧张素Ⅱ(AngⅡ)可通过促进AGEs的生成,上调AGEs受体(RAGE)的表达来活化AGEs-RAGE,继而通过激活氧化应激及丝裂原活化蛋白激酶 (MAPK)和Smad等多条信号传导通路,影响核因子-κB (NF-κB)等转录因子的活性,共同参与高血压肾损害的发生[3]。吡哆胺是维生素B6的3种天然形式之一,是AGEs的强力抑制剂,之前研究发现其对自发性高血压大鼠早期肾功能的损害具有保护作用,但具体机制尚不明确[4]。替米沙坦是一种特异性AT1受体拮抗剂,与AT1受体结合作用持久而可逆[5]。本实验通过与替米沙坦的比较,研究吡哆胺对AngⅡ诱导的HK-2细胞凋亡及纤维化因子表达的影响及其作用机制。
1 材料与方法
1.1 主要试剂
人肾小管上皮HK-2细胞(ATCC)。AngⅡ、吡哆胺、替米沙坦、二苯基氯化碘盐(DPI)、二硫代氨基甲酸吡咯烷(PDTC)、AnnexinV-FITC和MTT试剂盒(Sigma公司),DMEM/F12培养液、胎牛血清(Gibco公司),ROS检测试剂盒(上海碧云天公司),人AGEs ELISA检测试剂盒(R&D),Trizol RNA提取试剂(Invitrogen公司),real-time PCR试剂盒(TaKaRa公司),兔抗β-actin、TGF-β1、NF-κB P65、p-NF-κB P65多克隆抗体、辣根过氧化酶标记羊抗兔IgG和辣根过氧化酶标记羊抗小鼠IgG (Bioworld公司),兔抗RAGE单克隆抗体(Cell Signaling Technology公司),小鼠抗CTGF单克隆抗体(Santa Cruz公司)。
1.2 实验方法
1.2.1 细胞培养与分组:HK-2细胞接种于含10%胎牛血清DMEM/F12培养基,置于37 ℃、5% CO2培养箱中孵育。实验分组:1)对照组不加任何药物;2)AngⅡ组加10-6mol/L AngⅡ;3)替米沙坦(T)组10-5mol/L替米沙坦培养1 h后加AngⅡ;4)吡哆胺(P0.01、P0.1、P1和P10)组分别加0.01、0.1、1和10 mmol/L吡哆胺培养1 h后加AngⅡ;5)NADPH氧化酶抑制剂DPI组加10-5mol/L DPI,培养1 h后加AngⅡ;6) NF-κB抑制剂PDTC组加10-5mol/L PDTC,培养1 h后加AngⅡ。
1.2.2 MTT法检测细胞存活率:细胞接种于96孔培养板,待细胞增殖至70%~80%汇合,脱血清同步化18 h后分组干预24和48 h。每孔加入MTT溶液(5 g/L)20 μL,于培养箱中孵育4 h后吸出上清液,每孔加入二甲基亚砜150 μL,振荡10~15 min后于ELISA检测仪上以570 nm波长测定各孔吸光度值。每组细胞设6个平行孔,实验重复3次。细胞存活率%=实验组A值/对照组A值×100。
1.2.3 磷脂酰丝氨酸蛋白抗体-碘化吡啶(Annexin V-PI)双染法检测细胞凋亡:细胞接种于6孔培养板中,待细胞增殖至70%~80%汇合,脱血清同步化18 h后分组干预24 h。取500 μL细胞悬液(细胞浓度1.0×106/mL)至流式管中,分别加入5 μL磷脂酰丝氨酸蛋白抗体-荧光探针FITC和10 μL碘化吡啶,混匀后于室温避光反应10 min,立即流式细胞仪检测。结果判别:正常的活细胞不被染色,早期凋亡的细胞磷脂酰丝氨酸蛋白抗体-荧光探针FITC染色阳性,碘化吡啶染色阴性,结果由CellQuest Pro软件分析。每组细胞设3个平行孔,实验重复3次。
1.2.4 活性氧簇(reactive oxygen species, ROS)水平的测定:细胞同步化18 h后分组干预24 h,6孔板每孔加入1 mL DCFH-DA探针(10 μmol/L),设立无探针空白对照组,培养箱内孵育30 min,洗净探针后取1 mL PBS重悬细胞立即于流式细胞仪检测荧光强度(激发波长488 nm,发射波长525 nm)。每组细胞设3个平行孔,实验重复3次。
1.2.5 ELISA法检测细胞上清液AGEs浓度:设立标准品孔、空白对照孔及待测样品孔,严格按试剂盒说明书进行操作。终止反应后以酶标仪于450 nm波长下测量各孔的吸光度值,用标准品的浓度与吸光度值计算标准曲线的直线回归方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。每组细胞设3个平行孔,实验重复3次。
1.2.6 荧光实时定量PCR检测RAGE、TGF-β1、CTGF和MMP-9 mRNA表达:细胞同步化18 h后干预24 h,Trizol法提取总RNA,取2 μg RNA样品,将RNA反转录为cDNA。引物由大连宝生物公司合成(表1)。反应条件:预变性 95 ℃ 30 s;反应 95 ℃ 5 s,6 0℃ 30 s(40个循环);分解 95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。以β-actin为内参校正每个样本的循环阈值Ct。数据分析采用2-△△Ct方法计算目的基因mRNA的相对表达量。每组细胞设3个平行孔,实验重复3次。

表1 人RAGE、TGF-β1、CTGF、MMP-9、β-actin基因引物序列
1.2.7 Western blot测定细胞RAGE、TGF-β1、CTGF、NF-κB P65及p-NF-κB P65蛋白表达水平:细胞同步化18 h后干预48或1.5 h,BCA法定量蛋白浓度。10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转法恒流转膜1 h,室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育1.5 h,辣根过氧化物酶-化学发光法显影,Quantity One成像分析系统进行定量分析吸光度值,以β-actin为内参照,以吸光度比值表示表达量(目的蛋白条带/内参蛋白条带)。每组细胞设3个平行孔,实验重复3次。
1.3 统计学分析
2 结果
2.1 吡哆胺对HK-2细胞存活率的影响
与对照组相比,AngⅡ组细胞存活率下降(P<0.01);干预24或48 h后,T、P0.1、P1及TP组细胞存活率较AngⅡ组均上升(P<0.05或P<0.01);吡哆胺各组中,P10组较AngⅡ组细胞存活率进一步下降,P0.01组与AngⅡ组无明显差异,故选择1和0.1 mmol/L两个吡哆胺浓度继续实验(图1)。
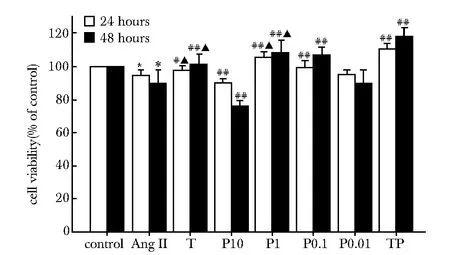
*P<0.01 compared with the control group;#P<0.05 compared with the AngⅡ group;##P<0.01 compared with the AngⅡ group;▲P<0.01 compared with the TP group图1 各组细胞存活率Fig 1 The cells viability of HK-2 cells
2.2 吡哆胺对HK-2细胞凋亡的影响
2016年,我国教育部颁布了《中国高等教育系列质量报告》,其中显示国内高等教育“硬件”建设数量正在呈现井喷式增长发展趋势,根据统计目前全国固定资产也已经全面增加42.15%左右,在教学、科研仪器等方面更增幅超过60.22%。这些数据也在告诉人们高校教育领域已经引入了全新的固定资产管理方式,它基本实现了对校内固定资产管理的管理理念与系统功能数据的优化,值得期待。
干预细胞24 h后,AngⅡ组较对照组早期凋亡率上升(P<0.01);与AngⅡ组相比,T、P0.1、P1和TP组早期凋亡率均下降(P<0.01)。其中,P0.1组和P1组早期凋亡率低于T组(均P<0.01),且P1组较P0.1组更低(P<0.05);TP组早期凋亡率显著低于T组、P1组(均P<0.01)(图2)。

*P<0.01 compared with the control group;#P<0.01 compared with the AngⅡgroup;△P<0.01 compared with the T group;★P<0.05 compared with the P1 group;▲P<0.01 compared with the TP group
图2吡哆胺对HK-2细胞早期凋亡的影响
Fig2EffectofpyridoxamineonHK-2cellsearlyapoptosis
2.3 吡哆胺对HK-2细胞ROS生成的影响
干预细胞24 h后,AngⅡ组细胞ROS生成较对照组明显增加(P<0.01);T、P0.1、P1、TP和DPI组ROS水平较AngⅡ组均降低(P<0.01)。其中P0.1组(P<0.05)、P1组(P<0.01)ROS水平低于T组;P1组低于P0.1组(P<0.01);TP组ROS水平低于T组及P1组(P<0.01)(表2)。
2.4 ELISA法检测细胞上清液AGEs浓度
干预细胞24 h后,AngⅡ组细胞上清液AGEs浓度较对照组升高(P<0.01); T、P0.1、P1、TP及DPI组较AngⅡ组AGEs浓度均降低(P<0.01)。P1组AGEs浓度低于T组(P<0.01)及P0.1组(P<0.05); TP组低于T组及P1组(P<0.01)(表2)。
2.5实时荧光定量PCR检测RAGE、TGF-β1、CTGF、MMP-9mRNA表达水平
干预细胞24 h,与对照组比较,AngⅡ组RAGE、TGF-β1、CTGF和MMP-9 mRNA表达水平显著升高(P<0.01);T、P0.1、P1、TP、DPI和PDTC组与AngⅡ组相比各基因mRNA表达均降低(P<0.01)。其中, P1组(均P<0.01),P0.1组(P<0.05或P<0.01)各基因mRNA表达水平低于T组; P1组低于P0.1组(P<0.05或P<0.01); TP组低于T、P1组(P<0.01)(表3)
表2 各组细胞ROS生成和细胞上清液晚期糖基化终末产物浓度
*P<0.01 compared with the control group;#P<0.01 compared with the AngⅡgroup;△P<0.05,△△P<0.01compared with the T group;★P<0.01 compared with the P1 group;▲P<0.01 compared with the TP group.
。
表3 各组细胞RAGE、TGF-β1、CTGF、MMP-9 mRNA表达相对量Table 4 The RAGE, TGF-β1, CTGF, MMP-9 mRNA expression in HK-2 cells(±s,2-△△Ct,n=3)
*P<0.01 compared with the control group;#P<0.01 compared with the AngⅡgroup;△P<0.05,△△P<0.01compared with the T group;★P<0.05,★★P<0.01 compared with the P1 group;▲P<0.01 compared with the TP group.
2.6Westernblot检测RAGE、TGF-β1、CTGF、NF-κBP65及p-NF-κBP65蛋白表达水平
干预细胞48或1.5 h后,AngⅡ组RAGE、TGF-β1、CTGF蛋白表达及NF-κB P65相对磷酸化水平较对照组增加(均P<0.01);与AngⅡ组相比,T、P0.1、P1、TP、DPI及PDTC组较AngⅡ组各蛋白表达及NF-κB P65磷酸化水平均下调(P<0.01)。其中,P1、TP组均低于T组(P<0.01);P0.1组TGF-β1、CTGF表达水平低于T组(P<0.01);P1组RAGE、CTGF表达及NF-κB P65磷酸化水平低于P0.1组(P<0.01)(图3,4)。
3 讨论
本研究发现,AngⅡ干预HK-2细胞后,产生了降低细胞存活率、促进细胞早期凋亡及上调纤维化因子表达的效应。目前认为, AngⅡ结合AT1受体后,一方面可活化NADPH氧化酶,使ROS生成增加[6],ROS又可进一步促进AGEs的生成和RAGE的表达[7], AGEs- RAGE可促进细胞凋亡并通过激活Smad、ERK/P38 MAPK等信号通路产生上调TGF-β1及CTGF的效应[8]。本研究引入NADPH氧化酶的抑制剂DPI干预HK-2细胞,结果显示DPI减少由NADPH氧化酶途径导致的ROS生成增加,下调AGEs-RAGE水平,同时使纤维化分子TGF-β1、CTGF、MMP-9表达减少,提示AngⅡ对HK-2细胞凋亡与纤维化分子表达的影响与ROS生成及AGEs-RAGE的激活有关。另一方面,AngⅡ可促使NF-κB P65亚基入核并发生磷酸化,激活炎性级联反应而参与纤维化的发生,NF-κB抑制剂可取消这一效应[9],在本实验中亦得到证实。
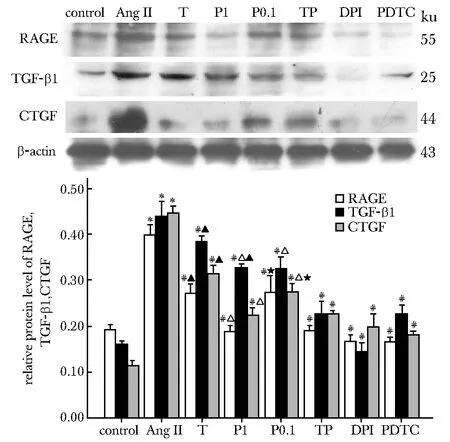
*P<0.01 compared with the control group; #P<0.01 compared with the AngⅡgroup;△P<0.01 compared with the T group;★P<0.01 compared with the P1 group;▲P<0.01 compared with the TP group图3 各组细胞RAGE、TGF-β1、CTGF蛋白表达相对量Fig 3 RAGE, TGF-β1, CTGF protein expression in HK-2 cells
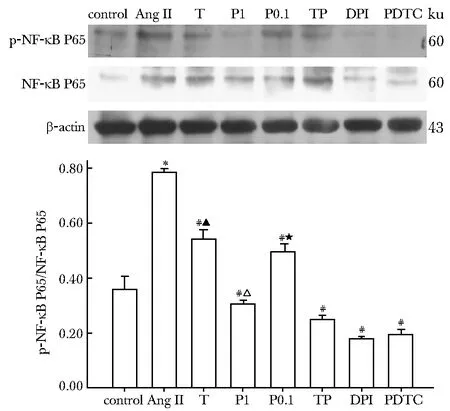
*P<0.01 compared with the control group; #P<0.01 compared with the AngⅡgroup;△P<0.01 compared with the T group;★P<0.01 compared with the P1 group;▲P<0.01 compared with the TP group图4 各组细胞NF-κB P65及磷酸化NF-κBP65表达水平Fig 4 NF-κB P65 and p- NF-κB P65 protein expression of HK-2 cells by Western blot
研究显示,1和0.1 mmol/L的吡哆胺均抑制HK-2细胞早期凋亡并下调纤维化分子的表达,高剂量较低剂量的作用更为显著。目前认为,吡哆胺作为一种亲核试剂,可捕捉AGEs的前体并抑制糖基化反应中间产物的生成,发挥强力抑制AGEs的作用。吡哆胺还可直接清除ROS,减轻氧化应激;其独特的螯合金属离子效应(主要作用于Cu2+,Zn2+)又加强了其抗氧化的作用[10]。本研究中,吡哆胺还显著下调了AngⅡ 作用下的HK-2细胞NF-κB P65磷酸化水平,且此效应能被NF-κB抑制剂PDTC拮抗,提示吡哆胺可能通过影响NF-κB的活性对细胞凋亡及纤维化分子的表达产生作用。这与前期动物实验中吡哆胺下调自发性高血压大鼠肾组织NF-κB P65表达的结果具有一致性[3],同时也提供了吡哆胺作用机制的体外证据。
相较之下,替米沙坦的效应在一定程度上依赖血流动力学及机体内环境,其在阻断AngⅡ与AT1受体结合的同时可能导致局部AngⅡ的累积,从而限制了其体外效应的发挥。因此吡哆胺较替米沙坦的显著效应可能与其拮抗AGEs-RAGE的作用更为直接且作用路径短,以及其卓越的抗氧化作用有关。合用组显示出优于单用替米沙坦及优于或不亚于单用吡哆胺的效应,提示二者合用可能发挥正向叠加的肾脏保护作用,但其具体机制仍有待进一步研究。
综上所述,吡哆胺可能通过减少AGEs-RAGE激活、改善氧化应激以及下调NF-κB P65磷酸化水平,从而抑制AngⅡ作用下的HK-2细胞早期凋亡并下调其纤维化分子的表达。本研究为吡哆胺体外发挥肾脏保护作用提供了一定的理论依据,提示合用吡哆胺和替米沙坦在高血压肾损害治疗中具有潜在的临床应用价值。
[1] Rodríguez-Iturbe B, García García G. The Role of Tubulointerstitial Inflammation in the Progression of Chronic Renal Failure[J]. Nephron Clin Pract, 2010, 116: 81- 88.
[2] 林书典,周巧玲,詹锋. 福辛普利和缬沙坦抑制AngII诱导的大鼠肾小管上皮细胞Klotho基因表达下调[J]. 基础医学与临床, 2011, 31: 25- 31.
[3] Zhu P, Lin H, Sun C,etal. Synergistic effects of telmisartan and pyridoxamine on early renal damage in spontaneously hypertensive rats[J]. Mol Med Reports, 2012, 5: 655- 662.
[4] 林虹,朱鹏立.晚期糖基化终末产物及其受体在原发性高血压中的作用机制[J].国际老年医学杂志,2010, 31: 165- 170.
[5] 许传文,徐艳梅. 替米沙坦延缓糖尿病大鼠肾病的发生发展[J]. 基础医学与临床, 2012, 32: 577- 578.
[6] Nguyen Dinh Cat A, Montezano AC, Burger D,etal. Angiotensin II, NADPH Oxidase, and Redox Signaling in the Vasculature[J]. Antioxid Redox Signal, 2013,19: 1110- 1120.
[7] Yao D, Brownlee M. Hyperglycemia-induced reactive oxygen species increase expression of the receptor for advanced glycation end products (RAGE) and RAGE ligands[J]. Diabetes, 2010, 59: 249- 255.
[8] Ishibashi Y, Matsui T, Takeuchi M,etal. Beneficial effects of metformin and irbesartan on advanced glycation end products (AGEs)-RAGE-induced proximal tubular cell injury[J]. Pharmacol Res, 2012, 65: 297- 302.
[9] Li XC, Zhuo JL. Nuclear factor-κB as a hormonal intracellular signaling molecule:focus on angiotensin II-induced cardiovascular and renal injury[J]. Curr Opin Nephrol Hypertens, 2008, 17: 37- 43.
[10] Ahmad S, Shahab U, Baig MH,etal. Inhibitory effect of metformin and pyridoxamine in the formation of early, intermediate and advanced glycation end-products[J]. PLoS One, 2013, 8:e72128. doi: 10.1371/journal.pone.0072128.
Effect of pyridoxamine on apoptosis and fibrogenicfactors expression in human proximal tubular epithelial cell line HK-2
YUAN Yin, ZHU Peng-li*, LIN Fan, YU Hui-zhen
(Dept. of Geriatric Medicine, Fujian Provincial Hospital, Fujian Provincial Institute of Clinical Geriatrics,the Provincial Clinical Medical College of Fujian Medical University, Fuzhou 350001, China)
ObjectiveTo investigate the effect and the mechanism of pyridoxamine on apoptosis and fibrogenic factors expression in HK-2 cells.MethodsCells were divided into groups as follows: control, AngⅡ(10-6mol/L), AngⅡ+ T(10-5mol/L), AngⅡ+ P(0.01,0.1,1,10 mmol/L), AngⅡ+ T+P(1 mmol/L). Cell viability was evaluated by MTT. Cell apoptosis was detected by AnnexinV-FITC/PI assay. Intracellular reactive oxygen species (ROS) was measured by flow cytometry. AGEs level in cellular supernatant were determined by ELISA. The real-time PCR was applied for the mRNA expression ofRAGE,TGF-β1,CTGFandMMP-9. The RAGE, TGF-β1, CTGF and p-NF-κB P65 expression were analyzed by Western blot.ResultsCompared with AngⅡ,pyridoxamine and telmisartan increased cell viability, inhibited cell apoptosis, decreased intercellular ROS level, and lowered the AGEs level in cell culture supernatant(allP<0.01). The mRNA and protein expression of RAGE, TGF-β1,CTGF, MMP-9 and NF-κB P65 phosphorylation were down-regulated respectively(allP<0.01). These effects were more pronounced in pyridoxamine groups than telmisartan group(P<0.05 orP<0.01)while the combination group exhibited more significant effects than the single use of telmisartan(allP<0.01).ConclusionsPyridoxamine may inhibit cell apoptosis and down-regulate fibrogenic factors expression through AGEs-RAGE inhibition, oxidative stress alleviation and NF-κB inactivation.
pyridoxamine; angiotensin; advanced glycation end products; apoptosis; fibrosis
2013- 10- 22
2014- 01- 13
福建省自然科学基金(2010J01127,2011J01137)
*通信作者(correspondingauthor): zpl7755@gmail.com
1001-6325(2014)08-1059-06
R 977.2;R329.2;R692.6
A
