缺血预处理减少大鼠肝缺血再灌注损伤期间白三烯C4生成
2014-11-28洪芬芳闵庆华郭发先陈小兵吴丽梦杨树龙
洪芬芳,周 莹,闵庆华,郭发先,陈小兵,吴丽梦,杨树龙*
(南昌大学 1.基础医学院 生理教研室;2.医学实验教学部 寄生虫研究室;3.基础医学院 组织胚胎学教研室;4.附属第一医院 妇产科, 江西 南昌 330006)
缺血预处理减少大鼠肝缺血再灌注损伤期间白三烯C4生成
洪芬芳1,2,周 莹3,闵庆华4,郭发先1,陈小兵1,吴丽梦1,杨树龙1*
(南昌大学 1.基础医学院 生理教研室;2.医学实验教学部 寄生虫研究室;3.基础医学院 组织胚胎学教研室;4.附属第一医院 妇产科, 江西 南昌 330006)
白三烯(leukotrienes,LTs)是经5-脂氧化酶(5-lipoxygenase,5-LO)途径产生的一类重要前炎症花生四烯酸类物质。它包括半胱氨酰白三烯(cysteinyl leukotrienes, Cys-LTs)(LTC4、LTD4 和LTE4)以及LTB4。Cys-LTs母体复合物LTC4由肝微粒体白三烯C4合酶(leukotriene C4 synthase, LTC4S)、谷胱甘肽S转移酶(microsomal glutathione S-transferase, mGST)mGST2和mGST3催化LTA4和还原型谷胱甘肽(reduced glutathione, GSH) 结合而成[1]。肝脏缺血再灌注损伤(ischemia reperfushion, I/R)在肝移植和肝肿瘤切除外科手术中均存在[2]。许多研究提示,肝脏I/R损伤病理机制中涉及LTs。有最近报道,I/R损伤大鼠肝组织LTC4增加部分系由LTC4S表达上调和LTC4合成酶活力增加所致; 而后者主要是由于LTC4S而非mGST2和mGST3[2]。
缺血预处理(ischemia preconditioning, IP)是指肝脏短暂缺血应激能减轻随后的长时间I/R损伤,并提高其再生能力[3]。一系列证据表明,IP 在肝移植等涉及I/R损伤的过程中具有保护作用[4]。但IP减轻肝脏I/R损伤的机制尚未完全阐明。它是否及如何影响大鼠肝I/R损伤期间前炎性因子LTC4生成未见报道。
1 材料与方法
1.1 材料:清洁级雄性SD大鼠,250~300 g,18只,[南昌大学实验动物中心,编号SCXK(赣),2008-0001]。 LTA4甲酯、LTC4和前列腺素B2 (PGB2)(Cayman公司)。LTC4S多克隆抗体(Santa Cruz公司)。增强化学发光酶检测试剂盒(Kibbuz Beit Haemek公司)。DAB试剂盒、辣根过氧化物酶联羊抗兔和羊抗鼠抗体(均北京中山生物有限公司产品)。
1.2 方法
1.2.1 肝I/R损伤动物模型:随机将大鼠均分为3组:1)肝脏I/R组,按文献[2]所述,采用Pringle’s操作方法制作大鼠肝脏I/R损伤模型。2)假手术对照组,只麻醉开腹,不阻断肝脏血流;3)IP组,以短暂10 min缺血再灌注10 min作为IP处理,之后开始较长时间60 min缺血和5 h再灌注。
1.2.2 LTC4含量的测定及免疫印迹分析:按文献[1],采用反向高效液相色谱(HPLC)法测定各实验组肝组织中LTC4含量,及采用免疫印迹法检测对照组、I/R和IP组肝组织LTC4S蛋白表达情况。
1.2.3 免疫组化检查:采用间接免疫过氧化物酶法,进行免疫组化染色检测LTC4S在对照组、I/R和IP组石蜡包埋大鼠肝组织切片表达和定位分布[1]。
1.2.4 LTC4合成酶的活性分析:取肝组织用超速离心法提取肝微粒体酶,在0.1 mol/L,pH 7.4磷酸钾缓冲液中(终体积150 μL),加底物10 mmol/L GSH和40 μmol/L LTA4 25 ℃孵化15 min后处理,做RP-HPLC分析[2]。
2 结果
2.1 IP对肝脏I/R期间LTC4含量和肝微粒LTC4合成酶活性的影响:与对照组相比,I/R组肝组织中LTC4含量和肝微粒LTC4合成酶的活性显著增加(P<0.01),IP组上述指标显著回降(P<0.05)(图1)。
2.2 IP对大鼠肝脏I/R期间LTC4S蛋白表达的影响:I/R组LTC4S蛋白表达水平明显高于对照组(P<0.05),IP组显著回降(P<0.05) (图2)。
2.3 免疫组化染色检查IP对大鼠肝组织LTC4S表达定位分布的影响:对照组肝细胞和血管内皮细胞的LTC4S免疫阳性染色较低(图3A,B);I/R肝组织内皮细胞和肝细胞LTC4S染色强阳性,并呈现出小叶分布异常(图3C,D),IP组大鼠肝组织LTC4S染色轻微阳性(图3E,F)。

A.leukotriene C4 content; B.LTC4 synthesis activities of liver microsomes; *P<0.05 compared with control; #P<0.01 compared with I/R图1 对照组、I/R和IP组大鼠肝LTC4的含量及肝微粒体LTC4合成酶活性变化Fig 1 Changes of hepatic Leukotriene C4 content and LTC4 synthesis activities of liver microsomes in control, I/R and IP groups rats (±s, n=6)

A.shows an immunoreactive band corresponding to LTC4S;B.depicts a histogram obtained by densitometric analysis of several immunoblots for LTC4S; *P<0.05 compared with control; #P<0.05 compared with I/R图2 对照组、I/R和IP组大鼠肝组织LTC4S蛋白表达变化Fig 2 Changes of hepatic protein expressions of LTC4S in control, I/R and IP groups rats (±s, n=3)
3 讨论
本实验I/R大鼠肝组织中LTC4生成增加, 与以前的报告一致[5],还发现,IP处理显著减少I/R损伤期间肝脏LTC4生成,这可能是IP防治肝脏I/R损伤的原因之一。
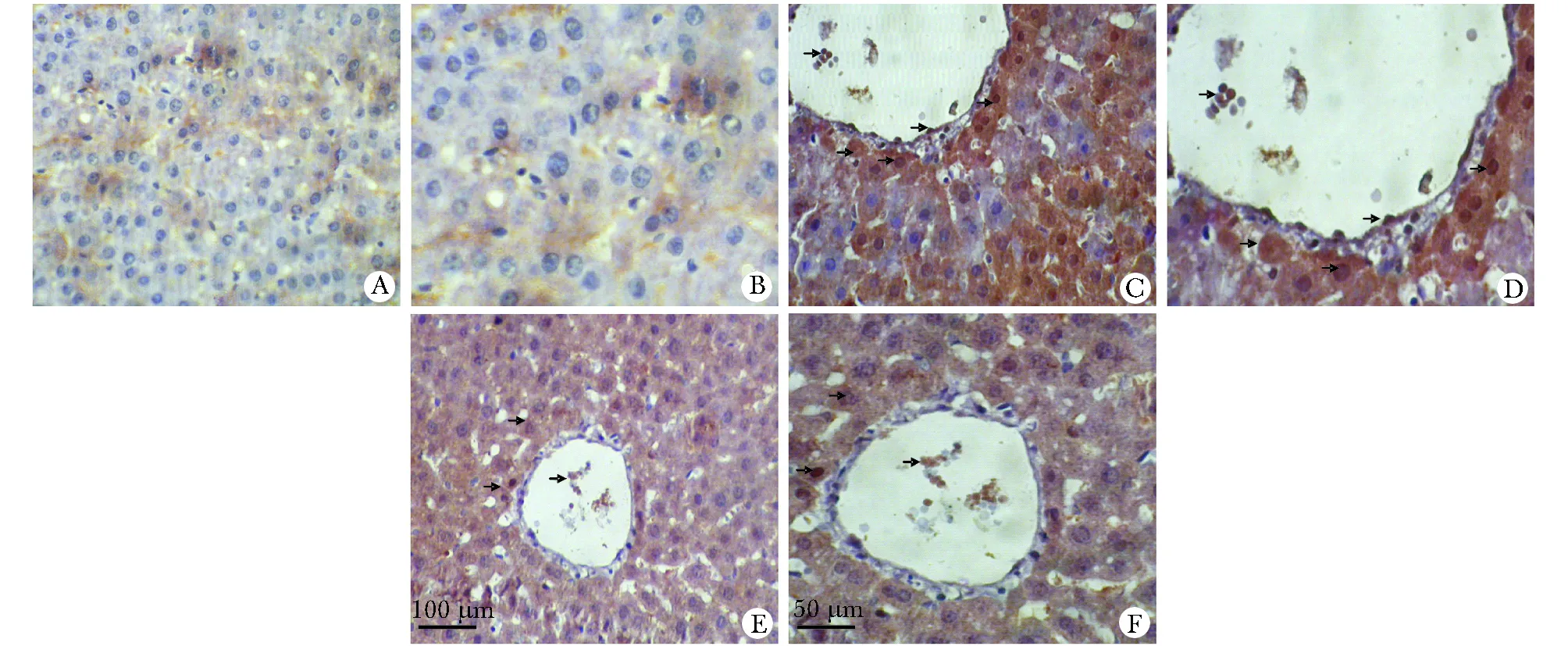
A,B.show immunohistochemical staining for LTC4S in normal rat liver; C,D.show immunohistochemical staining for LTC4S in I/R group rat liver (arrows); E,F.show immunohistochemical staining for LTC4S in IP group rat liver (arrows)(A,C,E:Bar=100 μm,B,D,F: Bar=50 μm)
图3免疫组化检测各组大鼠肝脏LTC4S蛋白表达和定位分布变化
Fig4ImmunohistochemicaldistributionsofLTC4Sincontrol,I/RandIPratliver
虽然曾有报道大鼠在3,12和24 h再灌注后,肝组织中LTC4S的mRNA表达无显著变化[5],但笔者最近研究表明,LTC4的生成增加可能部分与肝I/R期间LTC4S过度表达有关[2]。为了进一步阐明IP减少肝I/R损伤期间LTC4生成的机制,作者检测了IP对I/R损伤肝脏LTC4S的表达和定位分布的影响。结果显示,肝脏再灌注5 h后,I/R组,而不是IP处理组大鼠肝LTC4S蛋白表达较未处理组明显增加; IP组LTC4S蛋白表达与I/R组相比则显著下降。LTC4S在I/R组大鼠肝脏中血管内皮细胞和肝细胞有较强的阳性表达,但在IP组,大鼠肝脏血管内皮细胞和肝细胞中仅显示轻微LTC4S染色阳性。这些结果表明,IP减少LTC4生成可能涉及其下调大鼠I / R损伤肝脏中LTC4S蛋白表达。
LTC4合成酶(LTC4S,mGST2和mGST3)都能共轭结合LTA4和GSH生成LTC4,其mRNA和蛋白质在大鼠肝脏均有表达。本研究曾报道,肝脏I /R期间LTC4堆积可能部分由LTC4合成酶活性增加造成,其中,主要是由于LTC4S所致[2]。有理由设想IP降低LTC4生成,也可能与其改变LTC4合成酶的活性有关。本研究证实,IP显著降低肝I/R损伤大鼠肝微粒部分LTC4合成酶的活性,表明IP降低LTC4的形成可能与其在I/R过程中抑制肝LTC4合成酶的活性有关。
[1] Yang SL, Lou YJ. Sodium nitroprusside decreased leukotriene C4 generation by inhibiting leukotriene C4 synthase expression and activity in hepatic ischemia-reperfusion injured rats[J]. Biochem Pharmacol,2007,73:724- 735.
[2] Yang SL, Huang X, Chen HF,etal. Increased leukotriene c4 synthesis accompanied enhanced leukotriene c4 synthase expression and activities of ischemia-reperfusion-injured liver in rats[J]. J Surg Res, 2007,140:36- 44.
[3] Ambros JT, Herrero-Fresneda I, Borau OG,etal. Ischemic preconditioning in solid organ transplantation: from experimental to clinics[J]. Transpl Int, 2007,20:219- 229.
[4] Montalvo-Jave EE, Garcia-Puig MA, Escalante-Tattersfield T,etal. Biochemical analysis and lipid peroxidation in liver ischemic preconditioning[J]. Cirugia y cirujanos, 2011,79:132- 140.
[5] Takamatsu Y, Shimada K, Chijiiwa K,etal. Role of leukotrienes on hepatic ischemia/reperfusion injury in rats[J]. J Surg Res, 2004,119:14- 20.
2013- 09- 04
2013- 11- 25
国家自然科学基金(81260504);江西省教育厅科研基金(GJJ12073)
*通信作者(correspondingauthor): slyang@ncu.edu.cn
1001-6325(2014)08-1098-03
R 363
A
