海洋生物碱Eccteinascidins-743的合成研究进展
2014-11-27刘德秀王延风
刘德秀,王延风
(1.苏州卫生职业技术学院,江苏 苏州 215009;2.山东省医学科学院 药物研究所,山东 济南 250062)
四氢异喹啉生物碱是一类结构复杂、数目庞大的生物碱.双四氢异喹啉是其中的一个分支,广泛的分布在自然界中.该类化合物的结构都是由两个四氢异喹啉结构单元连接而成,其核心部分是一个哌嗪并四双异喹啉的五环骨架,Eccteinascidins-743(Et-743)就属于该类化合物.
早在1969年SIGEL等就发现海鞘的乙醇粗提物显示出很强的抗肿瘤活性[1],于是在随后的十几年里诸多研究小组致力于从该提取物中分离鉴定活性物质.1986年,Hllinois大学的RINEHART K教授领导的研究小组首次从加勒比海ecteinascidia turbinate海鞘中分离鉴定了一系列具有很强抗肿瘤活性的海洋生物碱Eccteinascidins类化合物,其中含量最多、药理活性最好的就是Et-743[2-7].Et-743不但具有很强的抗肿瘤活性,而且抗肿瘤面广[8-13],在体内对B16黑色素瘤、M5076子宫瘤、Lewis肺瘤等均显示出良好的治疗效果;体外药理研究表明,Et-743比目前临床上广泛使用的抗肿瘤药物,如taxol、camptothecin、adriamycin、mytomycin C、以及etoposide等的IC50高出1~3个数量级(IC50=0.1~1nmol/L),并且对耐camptothecin及etoposide的癌细胞也显示出很好的抗肿瘤活性[14-19].目前Et-743已经推向市场,商品名为Yon-delis.
Et-743具有复杂新颖的化学结构(见图1)和显著的生物活性,但由于其在自然界中含量极微(在加勒比海鞘中的含量为1.4×10-6),使得它成为有机合成化学家进行全合成研究的目标分子.
1 Et-743的全合成
1.1 COREY等对Et-743的全合成
1996年,COREY等[20]首次报道了Et-743的全合成.他们在构建该类五环骨架时运用了两个具有光学活性的化合物,并且在后来合成Saframycin A中亦用到了该类化合物[22].利用苯基硒酸酐能够将图2中化合物1的a环部分进行选择性的羟基化,引入一个羟基,再使用四丁基氟化铵(TBAF)去除硅醚对羟基的保护,脱保护的羟基经酯化后与双保护的半胱氨酸衍生物作用得到化合物2.在温和条件下巯基成环以79%的产率形成化合物3.去除氨基上的甲酸烯丙酯基之后再在1,8-二氮杂双环[5,4,0]-7-十一烯(DBU)催化下再形成α-酮内酯4,产率为59%.在化合物4上引入化合物5,并通过一些后续反应最终在去除甲氧基甲基(MOM)后得到Et-743.整个合成过程经过了40多步反应,总收率为0.53%.虽然合成过程比较复杂,限制了其在实际生产中的应用,但是却为Et-743的全合成指明了方向(见图2).
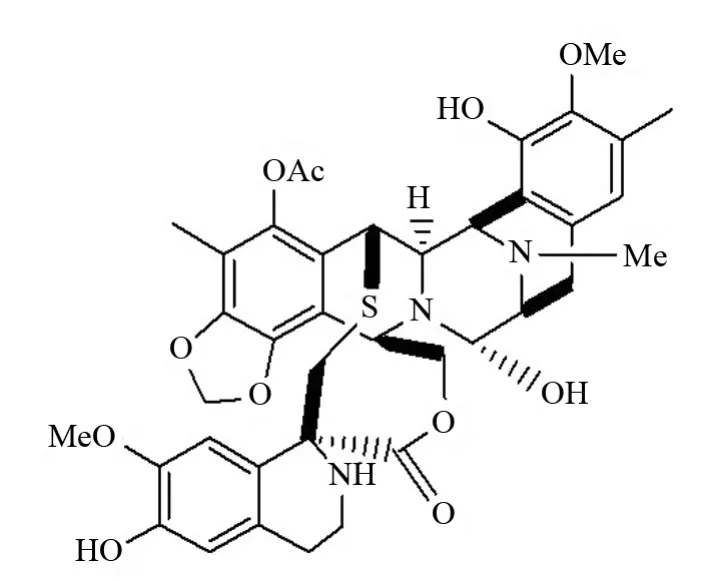
图1 Et-743的结构Fig.1 The structure of Et-743
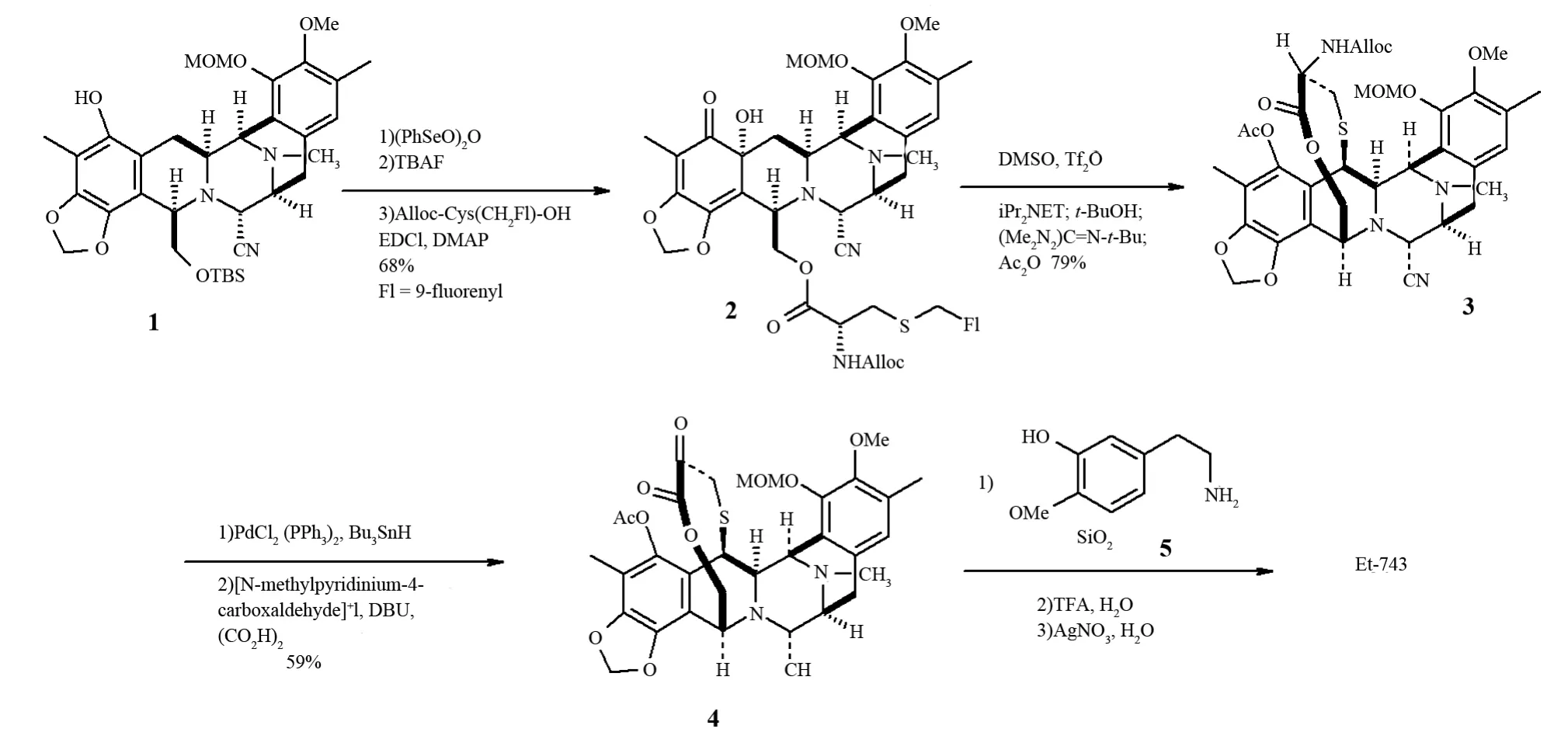
图2 COREY等的Et-743全合成Fig.2 COREY’s total synthesis of Et-743
1.2 CUEVAS等对Et-743的半合成
2000年,CUEVAS等[21]以Cyanosafracin B(6)为起始原料进行了半合成研究.Cyanosafracin B通过四步连续的反应转换成化合物7,通过对化合物7的酚羟基保护、氨基去叔丁基氧羰基的保护、酰胺裂解等一系列反应得到化合物8.再对化合物8的另一侧环的酚羟基保护、氨基羟基化得到化合物9,随后的反应步骤和上面提到的COREY[20]提出的Et-743的合成步骤类似.整个合成路线共包括21步反应,总收率1.0%.反应利用了与Et-743相似的五环骨架且具有与之对应手性中心化合物,只是对其他部位的取代基进行了结构修饰(见图3).
1.3 FUKUYAMA等对Et-743的全合成
2002年,FUKUYAMA等[23]也对Et-743的全合成做了系统研究.他认为合成Et-743的关键是合成五联苄基醇环12,而三环醛13是合成化合物12最好的平台.基于这种理念,他们利用多组分反应完成了Et-743的全合成(见图4).整个路线也经历了50多步反应,总收率为0.78%,这比COREY等的0.53%有了不小的提高.他们首先分别合成出苯基甘氨醇衍生物14和碘代苯丙氨酸衍生物15两个化合物,然后与对甲氧基苯基异腈化物16和乙醛17通过四组份Ugi缩合反应,生成二肽化合物18,通过这一步反应就得到了
形成五环的中间体骨架.闭环后得到哌嗪二酮化合物19,再经分子内Heck反应得到四环化合物,酚-醛环化构建五环中间体[24],从化合物24开始到最后生成Et-743的几步反应和COREY[20]和CUEVAS[22]进行的Et-743的合成步骤类似.
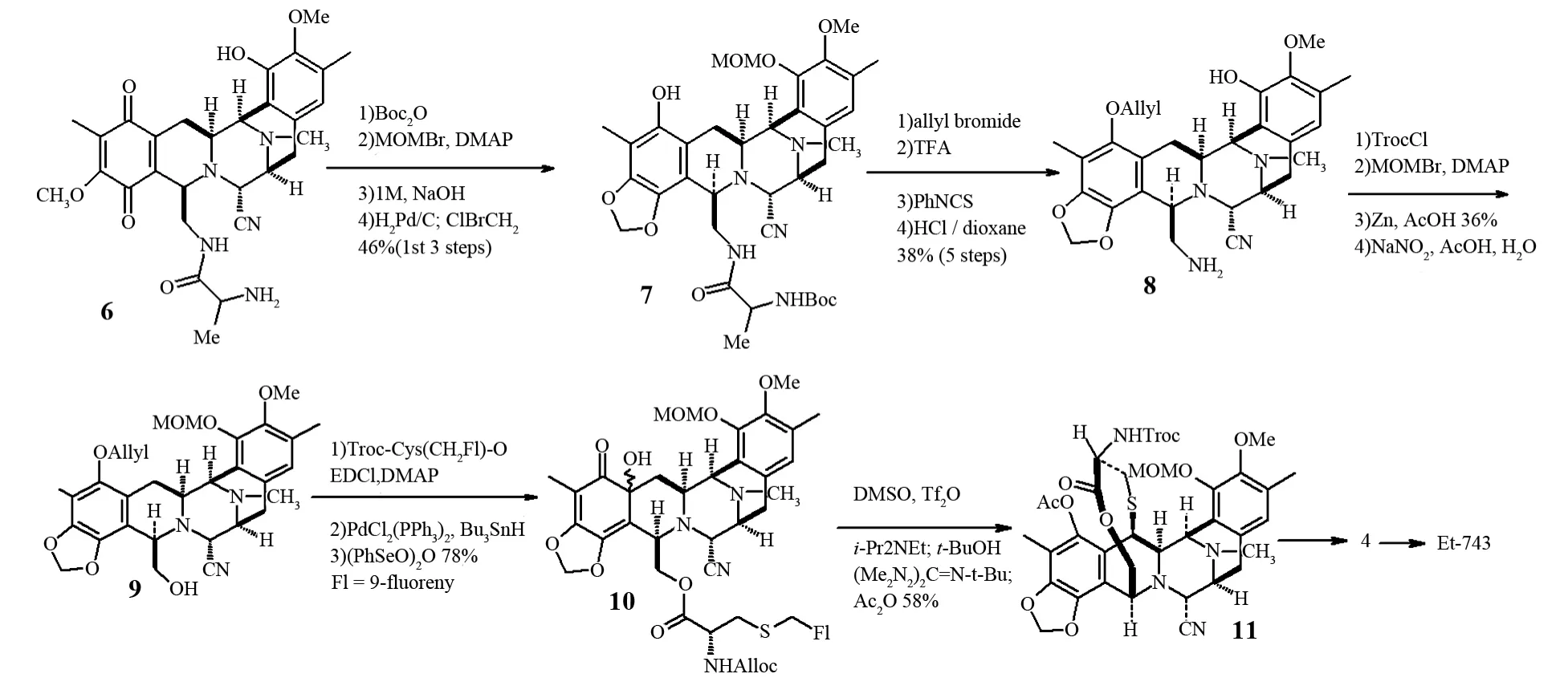
图3 CUEVAS等的Et-743半合成Fig.3 CUEVAS semi-synthesis of Et-743
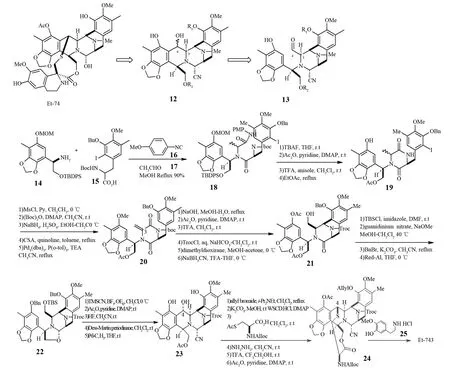
图4 FUKUYAMA等的Et-743全合成Fig.4 FUKUYAMA’s total synthesis of Et-743
1.4 CHEN等对Et-743的合成
2005年,CHEN等[25]报道了对Et-743进行的合成研究(见图5).他们采用倒推的方式分析了合成Et-743应该经过的中间体,认为要想生成Et-743必须经过适当保护的醇胺27,因为化合物27具备合成目标产物的所有功能性基团,而它可以追溯到化合物28.化合物28可以通过组合具有所有官能团的四氢异喹啉29和氨基醛30经过几步反应来生成.他们成功的合成了化合物27并详细介绍了随后的环化反应的结果.仅半年后同一个组的CHEN等[26]就实现了Et-743的全合成(见图6).整个合成路线经过了31步反应,总收率达到1.7%,这种合成方法具有以下几个明显的优点:①由醛和取代的苄基胺通过高选择性的Pictet-Spengler反应快速形成D-E部分;②选择性的N-烷基化的消旋苄基溴和光学纯的氨基醇反应形成所需骨架的前驱体;③采用一锅法对S-保护的前驱体脱保护、C-S键成环直接形成1,4-桥的十元环.整个反应过程没有复杂的反应条件,并且完全是直线进行.CHEN等认为采用该路线可以实现大规模生产.
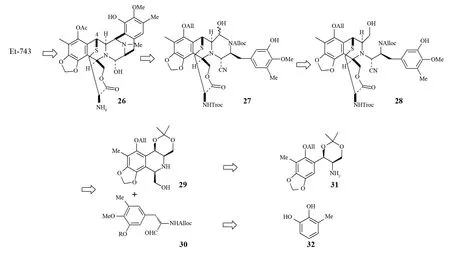
图5 Et-743逆合成分析Fig.5 Retrosynthesis analysis of Et-743
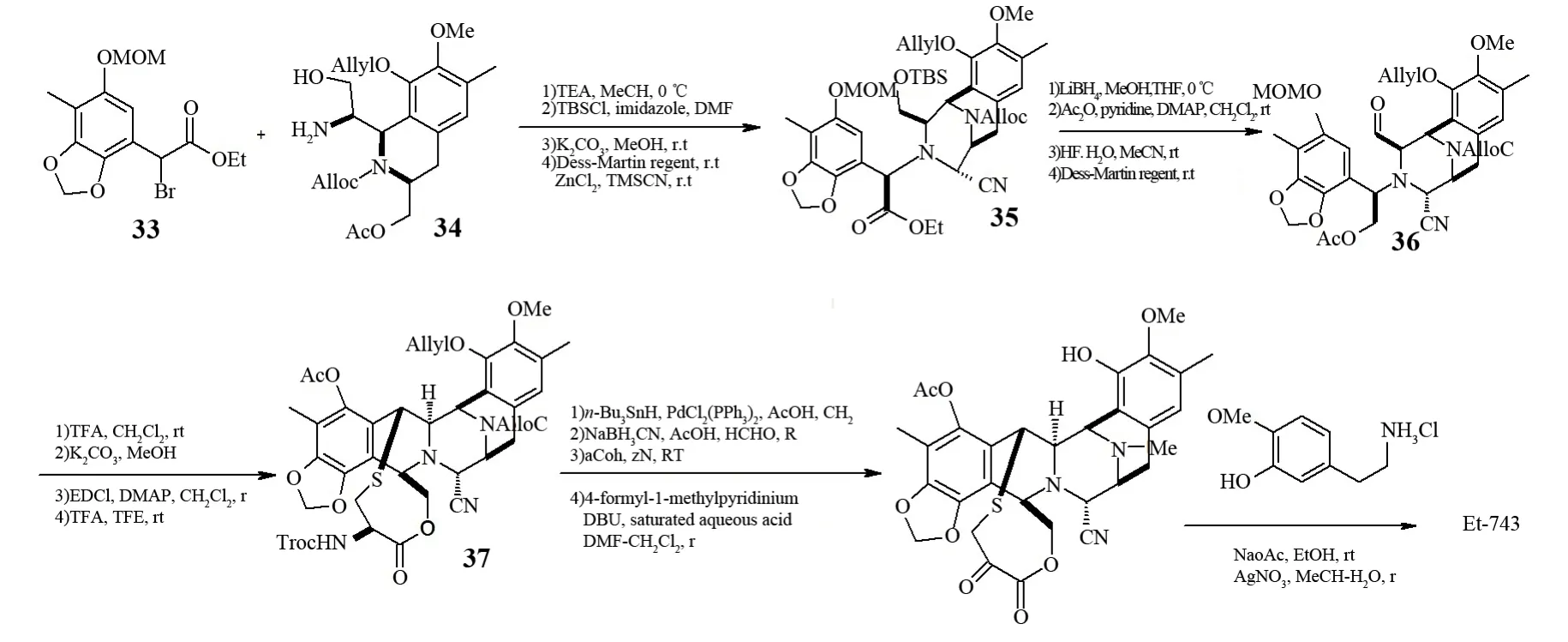
图6 CHEN等的Et-743全合成Fig.6 CHEN’s total synthesis of Et-743
1.5 ZHENG等对Et-743的全合成
ZHENG等[27]也在2005年实现了Et-743的全合成(见图7),他们把化合物42作为能够合成Et-743的突破点,而这个化合物也是FUKUYAMA等[23]当时重点突破的对象.从化合物38开始,C21的修饰就成了重点,经过图7中所列的几步反应,得到目标化合物42.从化合物42开始到最后生成Et-743的几步反应与COREY[20]和CUEVAS[22]等进行的Et-743的合成步骤类似.这个路线的特点在于能够比较直接的生成需要的中间化合物,以及采用并不常用的羟基苯乙烯Pictet-Spengler成环,这能够在一定程度上简化合成步骤.
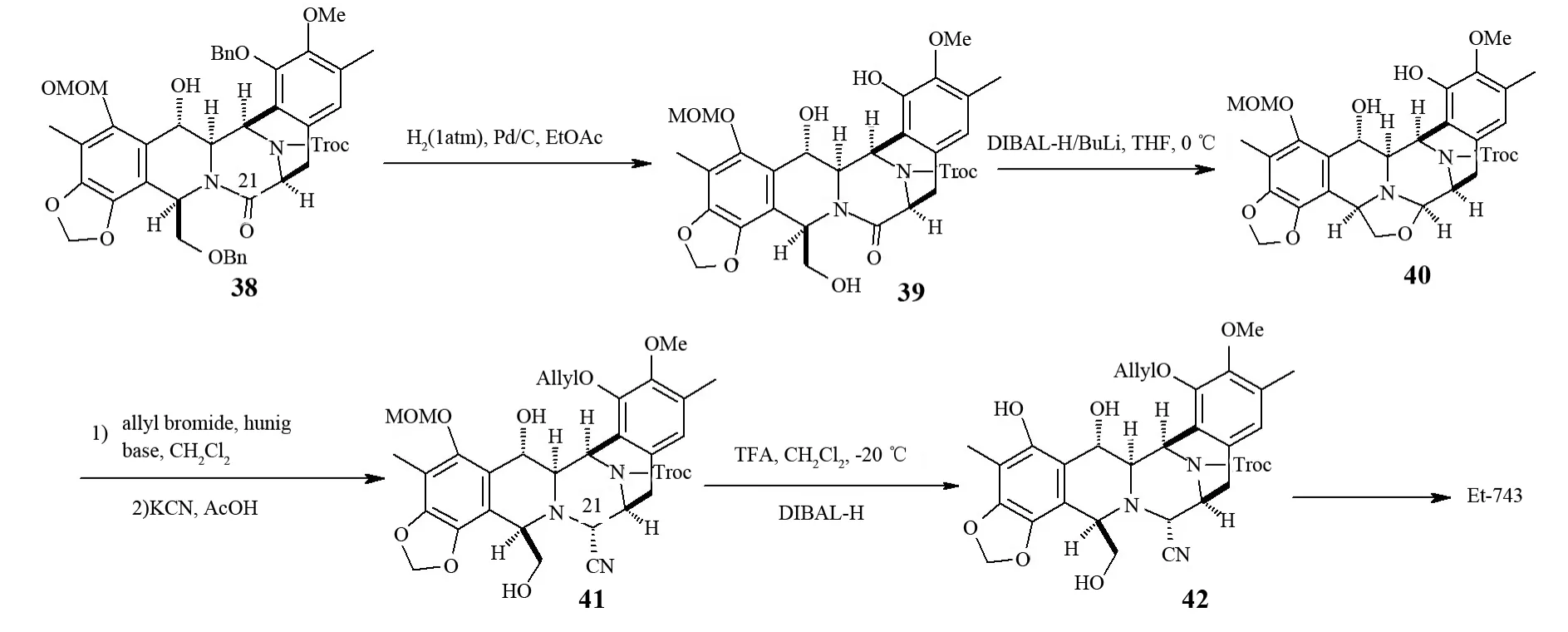
图7 ZHENG等的Et-743全合成Fig.7 ZHENG’s total synthesis of Et-743
1.6 FISHLOCK等对Et-743的全合成
到2008年,美国科罗拉多州州立大学的FISHLOCK[28]小组也实现了Et-743的全合成(见图8).他们首先合成前驱化合物43和44,两者再作用得到化合物45,通过保护化合物45的酚羟基得到化合物46,化合物46通过一系列反应得到化合物51.这期间的反应借鉴了CHEN[26]的一些经验,而从化合物51到化合物52中间经历的几步反应则采用了ZHENG[27]的合成路线,从化合物53开始到目标产物Et-743中间经历的五步反应则是借鉴的ENDO[23]的合成路线.

图8 FISHLOCK等的Et-743全合成Fig.8 FISHLOCK’s total synthesis of Et-743
2 展望
Et-743化合物具有广泛的生物活性激励着化学家及药学家不断地探索.从1986年分离出Et-743至今的二十多年里,越来越多的化学工作者投入到它的全合成研究中来.关于合成路线的设计除了上面讨论的以外,其他几种完全的或不完全的合成路线,以及含有该类骨架的衍生物的合成也逐渐见诸报道[29-39],在此不再一一赘述.根据这个领域的发展趋势以及对Et-743研究现状的了解,作者认为在今后相当长的时间里Et-743的全合成仍将是合成化学研究的热点之一,研究工作将主要集中在设计新的合成路线,以及对现有的合成路线进行优化等方面.
[1]SIGEL M M,WELLHAM L L,LICHTER W,et al.In food-drugs from the sea proceedings 1969[C].Youngken H W Jr,Ed.Washington D C:Marine Technol Soc,1970:281-294.
[2]WRIGHT A E,FORLEO A,GUNAWANDANA G P,et al.Antitumor tetrahydrodisoquinoline alkaloids from the colonial ascidian ecteinascidia turbinate[J].J Org Chem,1990,55(15):4508-4512.
[3]RINEHART K L,HOLT T G,FREGEAU N L,et al.Ecteinascidins 729,743,745,759A,759B,and 770:potent antitumor agent from the caribbean tunicate ecteinascidia turbinate[J].J Org Chem,1990,55(15):4512-4515.
[4]SCOTT J D,WILLAMS R M.Chemistry and biology of the tetrahydroisoquinoline antitumor antibiotics[J].Chem Rev,2002,102(5):1669-1730.
[5]DAMIA G,SILVESTRI S,CARRASSA L,et al.Unique pattern of ET-743activity in different cellular systems with defined deficiencies in DNA-repair pathways[J].Int J Cancer,2001,92(4):583.
[6]SCOTTO K W.ET-743:more than an innovative mechanism of action[J].Anti Cancer drugs,2002,13(S 1):3-6.
[7]郭建平,唐满成,李 凯.番红菌素中碳甲基转移酶(SfcF)的表达纯化及酶活性的检测[J].东华大学学报:自然科学版,2013,39(2):202-206.
[8]SESSA C,DE BRAUD F,PEROTTI A,et al.Trabectedin for women with ovarian carcinoma after treatment with platinum and taxanes fails[J].J Clin Oncol,2005,23(9):1867-1874.
[9]ZELEK L,YOVINE A,BRAIN E,et al.A phase II study of yondelis(trabectedin,ET-743)as a 24-h continuous intravenousinfusion in pretreated advanced breast cancer[J].Br J Cancer,2006,94(11):1610-1614.
[10]FAYETTE J,COQUARD I R,ALHERTI L,et al.ET-743:a novel agent with activity in soft-tissue sarcomas[J].Curr Opin Oncol,2006,18:347-353.
[11]SCHOFFSKI P,WOLTER P,CLEMENT P,et al.Trabectedin(ET-743):evaluation of its use in advanced soft-tissue sarcoma[J].Future Oncol,2007,3(4):381-392.
[12]CVETKOVIC R S,FIGGITT D P,PLOSKER G L.ET-743[J].Drugs,2002,62(8):1185-1192.
[13]王 燕,乔善义.海洋天然产物的药物开发[J].国际药学研究杂志,2009,36(4):307-309.
[14]SCOTLANDI K,PERDICHIZZI S,MANARA M C.Effectiveness of ecteinascidin-743against drug-sensitive and resistant bone tumor cells[J].Clin Cancer Res,2002,8:3893-3903.
[15]FAYETTE J,COQUARD I R,ALBERTI L,et al.ET-743:a novel agent with activity in soft tissue sarcomas[J].Oncologist,2005,10:827-832.
[16]丁肇卫,汤 华,张 文.ET-743,现代海洋药物研究的成功典范[J].药学服务与研究,2011,11(5):325-329.
[17]SIMMONS T L,ANDRIANASOLO E,MCPHAIL K,et al.Marine natural products as anticaneer drugs[J].Mol Cancer Ther,2005,4:333-342.
[18]KANZAKI A,TAKEBAYASHI Y,REN X Q,et al.Overcoming multidrug drug resistance in P-glycoprotein/MDR1-overexpressing cell lines by ecteinascidin 743[J].Mol Cancer Ther,2002,1:1327-1334.
[19]SESSA C,DE BRAUD F,PEROTTI A,et al.Trabectedin for women with ovarian carcinoma after treatment with platinum and taxanes fails[J].J Clin Oncol,2005,23(9):1867-1874.
[20]COREY E J,GIN D Y,KANIA R S.Enantioselective total synthesis of ecteinascidin 743[J].J Am Chem Soc,1996,118(38):9202-9203.
[21]CUEVAS C,PEREZ M,MARTIN M J,et al.Synthesis of ecteinascidin ET-743and phthalascidin Pt-650from cyanosafracin B[J].Org Lett,2000,2(16):2545-2548.
[22]MARTINEZ E J,COREY E J.Enantioselective synthesis of saframycin a and evaluation of antitumor activity relative to ecteinascidin/saframycin hybrids[J].Org Lett,1999,1:75-78.
[23]ENDO A,YANAGISAWA A,ABE M,et al.Total synthesis of ecteinascidin 743[J].J Am Chem Soc,2002,124(23):6552-6554.
[24]王 晔,唐叶峰,刘站柱.Saframycins及Ecteinascidins化合物的合成研究进展[J].有机化学,2005,25:42-52.
[25]CHEN Xiaochuan,CHEN Jinchun,MICHAEL D P,et al.Synthetic studies toward ecteinascidin 743[J].J Org Chem,2005,70:4397-4408.
[26]CHEN Jinchun,CHEN Xiaochuan,BOIS-CHOUSSY M,et al.Total synthesis of ecteinascidin 743[J].J Am Chem Soc,2006,128(1):87-89.
[27]ZHENG Shengping,CHAN C,FURUUCHI T,et al.Stereospecific formal total synthesis of ecteinascidin 743[J].Angew Chem Int Ed,2006,45(11):1754-1759.
[28]FISHLOCK D,WILLIAMS R M.Synthetic studies on Et-743.Assembly of the pentacyclic core and a formal total synthesis[J].J Org Chem,2008,73(24):9594-9600.
[29]LIU Zhanzhu,WANG Ye,CHEN Shizhi.Construction of the skeleton of phthalascidin,mechanism of the formation of the key tricyclic lactam intermediate[J].Chin Chem Lett,2002,13(8):701-704.
[30]TANG Yefeng,LIU Zhanzhu,CHEN Shizhi.Study on the total synthesis of Et-743and its analogues:synthesis of a tricyclic intermediate and its 11-Epimer[J].Chin Chem Lett,2003,14(10):996-998.
[31]LIU Zhanzhu,CHEN Shizhi.Synthetic studies of Et-743,preparation of a racemic amino alcohol precursor[J].Chin Chem Lett,2003,14(11):1127-1129.
[32]CHANDRASEKHAR S,REDDY N R,RAO Y S.Synthetic studies on ecteinascidin-743:synthesis of building blocks through sharpless asymmetric dihydroxylation and aza-Michael reactions[J].Tetrahedron,2006,62(51):12098-12107.
[33]FISHLOCK D,WILLIAMS R M.Synthetic studies on Et-743.Asymmetric stereocontrolled construction of the tetrahydroisoquinoline core via radical cyclization on a glyoxalimine[J].Org Lett,2006,8(15):3299-3301.
[34]FISHLOCK D,WILLIAMS R M.Synthetic studies on Et-743.Assembly of the pentacyclic core and a formal total synthesis[J].J Org Chem,2008,73(24):9594-9600.
[35]GORZALEZ J F,SALAZAR L,DE LA CUESTA E,et al.Synthesis of phthalascidin analogs[J].Tetrahedron,2005,61(31):7447-7455.
[36]VELASCO A,ACEBO P,GOMEZ A,et al.Molecular characterization of the safracin biosynthetic pathway from pseudomonas fluorescens A2-2:designing new cytotoxic compounds[J].Mol Microbiol,2005,56(1):144-154.
[37]彭 超.四氢异喹啉生物碱类抗生素番红霉素A和萘啶霉素的生物合成研究[D].上海:上海有机化学研究所,2009:26-31.
[38]NELSON J T,LEE J,SIMA J W,et al.Characterization of Saf C,a catechol 4-O-methyltransferase involved in saframycin biosynthesis[J].Appl Environ Microbiol,2007,73(11):3575-3580.
[39]ENOMOTO T,YASUI Y,TALEMOTO Y.Synthetic study toward ecteinascidin 743:concise construction of the diazabicyclo[3.3.1]nonane skeleton and assembly of the pentacycliccore[J].J Org Chem,2010,75(14):4876-4879.
