Jagged1活化Notch通路促进RAW 264.7向破骨分化但抑制增殖①
2014-11-27王汝杰刘复州沈伟伟毛德举卓云云陈武桂初同伟
王汝杰 刘复州 沈伟伟 胡 旭 陈 培 毛德举 卓云云 陈武桂 周 跃 初同伟
(第三军医大学第二附属医院骨科,重庆 400037)
恶性肿瘤患者大部分死于转移,骨骼是肿瘤最常见的转移部位之一[1]。肿瘤细胞到达骨组织定居并释放大量因子,与骨细胞及肿瘤相关免疫细胞相互作用,引起破骨细胞异常活化,导致骨溶解破坏,而骨破坏后又可释放多种因子促进肿瘤细胞的生长,形成恶性循环。在此过程中众多的肿瘤相关细胞因子及信号通路发挥了重要的作用[2]。肿瘤一旦发生骨转移,将引起严重的骨痛、病理性骨折、恶性高钙血症、脊髓压迫等骨相关事件,严重影响患者的生存时间和生活质量[3]。
Jagged1为Ⅰ型跨膜蛋白,是Notch受体的重要配体之一。当Jagged1与Notch受体结合后激活Notch通路,首先Notch的胞外段被细胞外基质金属蛋白酶切割,再被γ-分泌酶复合体识别并将Notch的胞内段酶切,释放Notch的活性片段NICD,NICD转位到细胞核内与DNA结合蛋白CSL及Mastermindlike蛋白结合形成三聚体,使CSL蛋白由原来的转录抑制状态转换为激活状态。Jagged1与肿瘤的发展及预后密切相关,Jagged1高表达的前列腺癌和乳腺癌预后不佳。Kung等[3]通过全基因组关联分析(GWAS)发现我国及中欧混血人群中Jagged1的多态性与骨密度密切相关。但Jagged1对破骨细胞的作用目前尚不清楚。本研究通过探讨Jagged1/Notch通路对破骨细胞的作用,为进一步研究Notch通路在肿瘤骨转移中的作用机制提供支持。
1 材料与方法
1.1 主要材料 RAW 264.7细胞系(ATCC,美国),胎牛血清(Gibco,美国),DMEM培养基、0.25%胰酶和青链霉素双抗(HyClone,美国),鼠重组RANKL(R&D,美国),Jagged1重组蛋白(义翘神州,北京),γ-分泌酶抑制剂{3,5-二氟笨乙酰-L-丙氨酰-S-苯基甘氨酸 t-丁酯 N-[N-(3,5-difluorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester,DAPT}和 TRAP 染色试剂盒(Sigma,美国),兔抗人Notch1多克隆抗体(Abnova,美国),山羊抗兔 FITC荧光二抗(中杉金桥,北京),RNAiso Plus、PrimeScript®逆转录试剂盒及荧光染料SYBR®Premix EX TaqTMII试剂盒(TaKa-Ra,日本),CCK-8 试剂盒(碧云天,北京)。
1.2 方法
1.2.1 细胞培养及实验分组 RAW 264.7细胞用含10%胎牛血清及100 U/ml青霉素、100 μg/ml链霉素的高糖DMEM培养基培养,2~3 d换液1次。将RAW 264.7细胞分为三组:对照组(10%胎牛血清+DMEM+100 U/ml青霉素+100 μg/ml链霉素+鼠重组RANKL 50 ng/ml)、Jagged1组(10%胎牛血清+DMEM+100 U/ml青霉素+100 μg/ml链霉素+鼠重组RANKL 50 ng/ml+50 ng/ml Jagged1重组蛋白)、DAPT组(10%胎牛血清+DMEM+100 U/ml青霉素+100 μg/ml链霉素+鼠重组RANKL 50 ng/ml+50 ng/ml Jagged1重组蛋白+10 nmol/L DAPT)。接种细胞当天计为0 d,第3、6天换液同0 d。
1.2.2 Real-time PCR检测破骨细胞标志基因及Notch通路下游靶基因mRNA的表达 RAW264.7细胞约5×105个接种于25 cm2细胞培养瓶中,按分组诱导培养。各组细胞培养至第3天提取细胞总RNA,经反转录后实时定量PCR检测组织蛋白酶K(Cathepsin K,CK)、抗酒石酸性磷酸酶(Tartrate-resistant acid phosphatase,TRAP)、降钙素受体(Calcitionin receptor,CTR)及Notch通路下游靶基因Hes-1、Hey-1的mRNA表达。引物序列见表1,由大连宝生物工程有限公司设计合成。反应条件:95℃ 30 s 1个循环;95℃ 5 s、60℃ 30 s,40个循环。基因相对表达量采用2-ΔΔCt方法计算表达。
1.2.3 TRAP染色检测RAW264.7细胞向破骨细胞的分化情况 96孔板内各分组每孔接种细胞约1 ×103个细胞,培养体系 1 000 μl,培养第 6 天按TRAP试剂盒说明行TRAP染色,细胞浆呈玫瑰红且细胞核≥3为TRAP+破骨细胞。低倍镜下随机取5个视野进行计数。
1.2.4 扫描电镜检测骨陷窝的形成 牛皮质骨硬组织切片机切割成100 μm厚的薄片,细砂纸打磨至50 μm厚,切成大小约4 mm ×4 mm,75%乙醇冲洗3次,放于75%乙醇中浸泡过夜,无菌PBS冲洗3次,48孔培养板中高糖DMEM培养基中孵育24 h。每孔放置1片骨片,每孔接种约2×105个细胞,每3 d换液1次,第9天超纯水冲洗骨片3次,每次5 min,清除骨片上的细胞,梯度乙醇脱水,CO2临界点干燥,喷金,扫描电镜观察骨吸收陷窝。于200倍下随机选取5个视野,用Image-Pro plus6.0软件分析溶骨面积所占整个视野面积的百分率。

表1 实时荧光定量PCR引物序列Tab.1 Primer sequences for real-time fluorescence quantitative-PCR
1.2.5 细胞免疫荧光检测NICD的表达 每个共聚焦培养皿种植RAW264.7细胞约104个,接种24 h换为含0.5% 胎牛血清的高糖DMEM饥饿培养24 h,再按分组换液:对照组(10%胎牛血清+DMEM+100 U/ml青霉素 +100 μg/ml链霉素)、Jagged1组(10%胎牛血清+DMEM+100 U/ml青霉素+100 μg/ml链霉素+50 ng/ml Jagged1重组蛋白)、DAPT组(10%胎牛血清+DMEM+100 U/ml青霉素+100 μg/ml链霉素 +50 ng/ml Jagged1重组蛋白+10 nmol/L DAPT)。72 h后行激光共聚焦免疫荧光检测。
1.2.6 CCK-8检测细胞的增殖 RAW264.7细胞以2 000个/孔接种于96孔板中,含10%胎牛血清的α-MEM培养24 h后按同免疫荧光检测所分组换液。每组设5个复孔,培养体系100 μl,继续培养48 h后加入10 μl/孔CCK-8试剂,37℃孵育2 h,在全波长扫描式多功能读数仪上检测波长为450 nm处各孔的吸光度(D)值。实验重复3次。
1.3 统计学处理 应用SPSS18.0软件对实验数据进行统计分析,实验数据以应表示,组间比较采用单因素方差分析,样本间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 Jagged1重组蛋白上调RAW264.7细胞中的破骨细胞标志基因的表达 Real-time PCR结果显示,RAW264.7细胞在RANKL存在条件下50 ng/ml Jagged1作用6 d后,其破骨细胞标志基因TRAP、CK、CTR mRNA的表达量与对照组相比均显著增加(P<0.05)。而 DAPT组较 Jagged1组TRAP、CK、CTR表达量明显下降,但与对照组无明显变化(图1)。

图1 Jagged1重组蛋白对RAW264.7细胞中的破骨细胞标志基因表达影响Fig.1 Effects of Jagged1 on mRNA expression levels of TRAP,CK and CTR in RAW264.7 cells
2.2 Jagged1重组蛋白促进TRAP+多核细胞的形成 TRAP染色结果显示,在50 ng/ml Jagged1作用下RAW264.7细胞形成破骨细胞的数量明显高于对照组(P<0.05),DAPT阻断Notch通路后破骨细胞的数量较Jagged1组明显降低(P<0.05),但与对照组无明显差异。在光镜下随机选取5个视野对破骨细胞计数(图2)。
2.3 Jagged1重组蛋白促进骨吸收陷窝的形成 扫描电镜显示Jagged1重组蛋白组骨陷窝面积明显高于对照组,DAPT组溶骨面积较Jagged1蛋白组明显降低,但较对照组无明显变化。扫描电镜下随机选取5个视野,对溶骨面积占整个视野面积的百分率Image-Pro plus6.0软件分析并进行统计学分析,对照组与Jagged1重组蛋白组、Jagged1重组蛋白组与DAPT组间差异有统计学意义,而对照组与DAPT组两组差异无统计学意义(图3)。
2.4 Jagged1上调 Notch靶基因 HES-1、HEY-1 mRNA的表达 Real-time PCR结果显示,Jagged1干预3 d后,HES-1和HEY-1 mRNA的表达量均明显高于对照组(P<0.05),γ-分泌酶抑制剂(DAPT)阻断 Notch通路后 Jagged1组 HES-1和HEY-1表达量下降,明显低于对照组(P<0.05,图4)。
2.5 细胞免疫荧光检测NICD的荧光表达 细胞免疫荧光显示对照组NICD主要表达于细胞膜、细胞质及细胞核,Jagged1蛋白组NICD除主要表达于细胞膜,细胞质外细胞核表达明显较对照组及DAPT组增强(图5)。
2.6 Jagged1对 RAW264.7细胞的增殖作用CCK-8结果显示,培养 48h后 Jagged1组RAW264.7细胞的增殖率与对照组相比明显降低[(0.95 ±0.12)vs(1.44 ±0.13),P <0.05],DAPT组的增殖率高于 Jagged1组[(1.41±0.12)vs(0.95±0.12),P <0.05],而 DAPT组增殖率低于对照组[(1.41±0.12)vs(1.44±0.13),P>0.05],但组间差异无统计学意义。
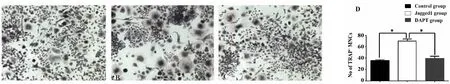
图2 Jagged1蛋白诱导破骨细胞分化(TRAP染色,×400)Fig.2 Jagged1 stimulates osteoclastic differentiation(TRAP staining,×400)

图3 Jagged1蛋白诱导破骨细胞分化细胞活性骨陷窝形成扫描电镜检测(SEM,×400)Fig.3 Jagged1 stimulates osteoclastic differentiation measured by scanning electron microscopy(SEM,×400)

图4 Jagged1上调Notch靶基因HES-1、HEY-1 mRNA的表达Fig.4 Jagged1 upregulated mRNA expression of HES-1 and HEY-1
3 讨论
肺癌骨转移主要为破骨细胞异常活化所引起溶骨性病变为主。恶性循环学说可以较好地解释肿瘤的骨转移和骨损害。一方面,肿瘤细胞到达骨组织定居并释放多种因子,影响成骨细胞介导的骨形成与破骨细胞介导的骨吸收直接的生理平衡,另一方面,成骨细胞、破骨细胞及骨基质溶解也同时释放多种因子,促进肿瘤细胞的生长、侵袭、转移。抑制破骨细胞异常活化不仅可以减少骨吸收并可以减轻肿瘤负荷[5]。
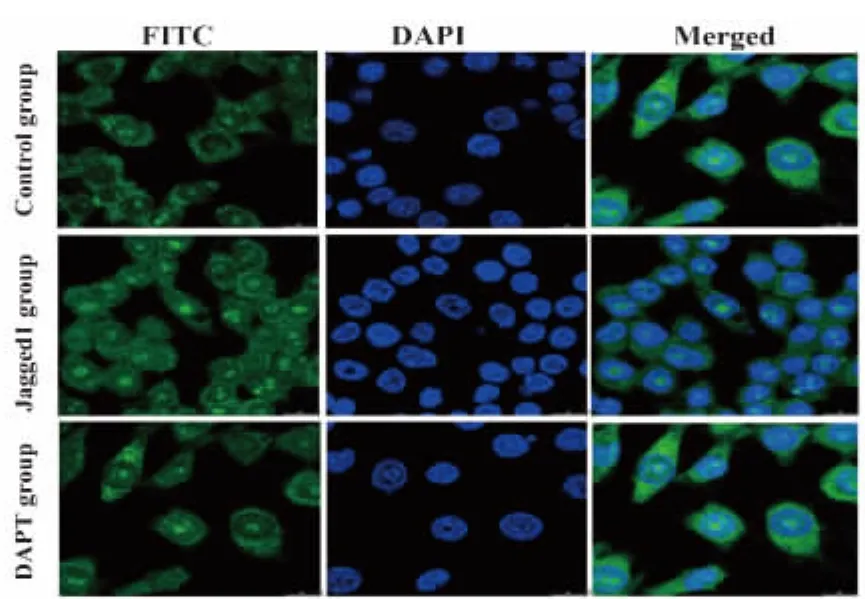
图5 免疫荧光检测Notch活性片段NICD表达情况Fig.5 Nuclear translocation of active fragment NICDwas determined by immunofluorescence
有研究表明Jagged1在乳腺癌骨转移标本中较在肝、脑、肺转移增高,可能为促进肿瘤细胞定植于骨的特异因子[6]。Jagged1不仅与前列腺癌、乳腺癌的预后相关,还通过激活Notch通路参与肿瘤的发生、发展及侵袭、转移等。Notch通路还通过调节上皮-间质转化(EMT)等作用与肿瘤的发展相关。Notch 通路通过调节 TGF-β、β-链蛋白、低氧[7-9]等促进肿瘤细胞的侵袭,也可以通过调节基质金属蛋白酶-9(MMP-9)及血管内皮生长因子(VEGF)促进肿瘤的侵袭[10],并可以被MARK活化后促进肿瘤血管的形成[11]。
我们前期发现血小板衍生生长因子-D(PDGFD)可以促进破骨细胞的活化[12],而抑制Notch通路可以抑制由PDGF-D所引起的细胞生长及血管生成[13]。本研究证实Jagged1在RANKL存在下可促进RAW 264.7细胞向破骨细胞的分化并增加骨溶解的能力,而γ-分泌酶抑制剂(DAPT)阻断Notch通路可以明显降低其促进破骨细胞分化及骨溶解的作用。免疫荧光显示Jagged1可以使Notch活化并向细胞核内转移,同样通过基因表达检测Notch下游靶基因HEY1、HES1的表达也证明了Jagged1可以使Notch活化,而加入DAPT后这些变化受到抑制,说明DAPT可以有效阻断Notch通路。Jagged1在RANKL和M-CSF存在下可以明显促进RAW264.7细胞形成破骨细胞个数及破骨细胞标志基因CK、CTR、TRAP的表达,增加所形成破骨细胞的骨溶解能力,而DAPT阻断Notch通路后可以明显降低Jagged1促进RAW264.7细胞向破骨细胞分化及骨溶解的作用。我们还发现,Jagged1可以抑制RAW264.7细胞的增殖,而加入 DAPT后 Jagged1抑制RAW264.7细胞增殖作用明显减弱。
肿瘤骨转移所引起的骨溶解是一个多因子参与的复杂过程,目前尚无十分有效的治疗手段。我们的实验证明DAPT可阻断Notch通路,抑制Jagged1所引起的促破骨细胞分化和骨质溶解。目前Jagged1活化Notch通路后如何促进破骨细胞分化的分子机制尚不明确,DAPT在动物肺癌骨转移模型中的作用仍不明确,因此将Jagged1作为抑制肺癌骨转移骨破坏的一个潜在治疗靶点,仍需要进一步的研究。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA:Cancer J Clin,2013,63:11-30.
[2]Sterling JA,Edwards JR,Martin TJ,et al.Adances in the biology of bone metastasis:How the skeleton affects tumor behavior[J].Bone,2011,48(1):6-15.
[3]Loftus LS,Edwards-Bennett S,Sokol GH.Systemic therapy for bone metastases[J].Cancer Control,2012,19:145-153.
[4]Kung AW,Xiao SM,Cherny S,et al.Association of JAG1 with bone mineral density and osteoporotic fractures:a genome-wide association study and follow-up replication studies[J].Am J Hum Genet,2010,86:229-239.
[5]Kawatani M,Osada H.Osteoclast-targeting small molecules for the treatment of neoplastic bone metastases[J].Cancer Sci,2009,100:1999-2005.
[6]Zhang XH,Wang Q,Gerald W,et al.Latent bone metastasis in breast cancer tied to Src-dependent survival signals[J].Cancer Cell,2009,16:67-78.
[7]Timmerman LA,Grego-Bessa J,Raya A,et al.Notch promotes epithelial-mesenchymal transition during cardiac development and oncogenic transformation[J].Genes Dev,2004,18:99-115.
[8]Balint K,Xiao M,Pinnix CC,et al.Activation of Notch1 signaling is required for beta-catenin-mediated human primary melanoma progression[J].J Clin Invest,2005,115:3166-3176.
[9]Bedogni B,Warneke JA,Nickoloff BJ,et al.Notch1 is an effector of Akt and hypoxia in melanoma development[J].J Clin Invest,2008,118:3660-3670.
[10]Wang Z,Banerjee S,Li Y,et al.Down-regulation of notch-1 inhibits invasion by inactivation of nuclear factor-kappaB,vascular endothelial growth factor,and matrix metalloproteinase-9 in pancreatic cancer cells[J].Cancer Res,2006,66:2778-2784.
[11]Zeng Q,Li S,Chepeha DB,et al.Crosstalk between tumor and endothelial cells promotes tumor angiogenesis by MAPK activation of Notch signaling[J].Cancer Cell,2005,8:13-23.
[12]刘栓得,黄晨,许红飞,等.PDGF-D抗体对体外破骨前体细胞分化过程影响的相关研究[J].中国免疫学杂志,2013,29(7):681-685.
[13]Wang Z,Kong D,Banerjee S,et al.Down-regulation of platelet-derived growth factor-D inhibits cell growth and angiogenesis through inactivation of Notch-1 and nuclear factor-kappaB signaling[J].Cancer Res,2007,67:11377-11385.
