CD40信号联合细胞因子体外制备过继免疫治疗细胞的实验研究①
2014-11-27高腾飞古彦铮徐俊驰李晓晨朱一蓓张学光
高腾飞 古彦铮 徐俊驰 沈 宇 李晓晨 朱一蓓 张学光
(苏州大学医学部基础医学与生物科学学院,苏州 215013)
肿瘤的过继细胞免疫治疗(Adoptive cellular immunotherapy,ACI)是继肿瘤的手术治疗、放疗、化疗后的第四种治疗方式,并日受到重视[1]。主要原理是采集肿瘤患者外周血中单个核细胞、经细胞因子诱导、扩增出一定数量的具有肿瘤杀伤能力的细胞,再回输到病人体内[2]。其中细胞因子诱导的杀伤性细胞(CIK)在培养过程中细胞增殖速度快、具有一定的杀伤肿瘤活性、对多种耐药肿瘤细胞均较为敏感[3],在当今肿瘤的过继细胞免疫治疗中被广泛应用。它的主要效应细胞是CD3+CD56+细胞[4]。但是CIK细胞在治疗中存在一定不足,所以临床疗效达不到预期的结果。本实验建立一种新的过继免疫细胞诱导方案:CD40激发型单抗5C11联合细胞因子IFN-α、IL-7和IL-2(CD40激发组)体外制备过继免疫治疗细胞,并与常规CIK(CD3激发组)进行对比性分析,为临床肿瘤过继免疫治疗提供一种新方法。
1 材料与方法
1.1 标本来源 在苏州大学附属第一医院收集正常人外周血来源的PBMC,标本征得本人及其家属同意,并签署知情同意书。
1.2 主要试剂 抗人CD3单克隆抗体(OKT-3)、IL-2、IFN-γ、IL-1α、IL-7 和 IFN-α 均购自美国的 PeproTech公司;激发型CD40抗体来自本研究所研制,克隆号为5C11;淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司;小牛血清、RMPI1640培养基购自美国 Hyclone公司;CD56-FITC、CD3-PE、CD4-PE-Cy7、CD8-PE-Cy5、CD14-PE、CD11c-PECy5、CD25-PE-Cy5和Foxp3-FITC荧光抗体均购自美国eBioscience公司;Foxp3检测试剂盒购自美国eBioscience公司。
1.3 过继免疫治疗细胞体外扩增培养及形态观察
将PBMC细胞用RMPI1640完全培养基(含10%小牛血清)配成细胞悬液,然后转入6孔板(5.0×106/孔)和24孔板(3.0×105/孔)里,然后于各组细胞培养液中加入相应细胞因子:CD3激发组起始时(即第0天)加入 IFN-γ(1 000 U/ml),24 h后再加入 IL-2(1 000 U/ml)、IL-1α(100 U/ml)和抗CD3mAb(50 ng/ml);CD40激发组起始时(即第0天)加入5C11(2 μg/ml),IL-7(10 ng/ml),IFN-α(5 ng/ml),IL-2(300 U/ml)。然后将培养板放到37℃、5%CO2、饱和湿度95%的CO2培养箱内培养。之后,视细胞状态每隔2~3 d即每3 d补一次细胞因子液,其中CD3激发组仅补加IL-2(1 000 U/ml),而CD40激发组则补加全部4种细胞因子5C11(2 μg/ml)、IL-7(10 ng/ml)、IFN-α(5 ng/ml)和 IL-2(300 U/ml)。每天观察,并拍照记录。
1.4 CD3激发组和CD40激发组细胞增殖情况分析 在细胞培养的第6、9、12天收集适量细胞,台盼蓝染液(10 μl)以1∶1混合均匀,在 3 min 内,分别计数活细胞和死细胞,镜下观察,死细胞被染成明显的蓝色,而活细胞拒染呈无色透明状,最后按照公式:(细胞悬液的细胞数)/ml=(四个大格子细胞数/4)×稀释倍数×104统计活细胞数量。
1.5 流式细胞术检测细胞免疫表型 在第9天分别收集CD3激发组和CD40激发组培养的过继免疫治疗细胞。①T细胞、NKT细胞和Mo-NK-DC细胞组成的流式检测:加入适量的FITC、PE、PE-Cy5或者PE-Cy7荧光素标记的混合抗体,包括 CD56、CD3、CD4、CD8、CD14 和 CD11c,震荡,4℃避光孵育30 min,加入适量PBS 洗涤,震荡,1 500 r/min,5 min离心,弃上清液,加入500 μl PBS,流式细胞仪机器上检测。②Treg细胞组成的流式检测:应用Foxp3检测试剂盒,在加入CD4-PE和CD25-PE-Cy7荧光素标记的混合抗体并4℃避光孵育30 min后,使用固定剂4℃避光孵育90 min,然后使用破膜剂同时加入Foxp3-FITC荧光素标记的抗体,4℃避光孵育30 min,最后经过同①的方法处理后流式细胞仪机器上检测。③数据文件使用Flowjo软件分析。
2 结果
2.1 体外扩增的过继免疫细胞的形态学观察 体外培养细胞形态观察显示,CD3激发组和CD40激发组细胞均出现明显的集落样增殖,CD3激发组的集落较大,而CD40激发组的集落要略小而密,但二者在形态上无明显差异,均表现为胞体和胞核增大,胞浆增多,浆中出现颗粒、空泡等特征(见图1)。
2.2 两组过继免疫细胞增殖速率的动态比较 本实验使用24孔板体外培养过继免疫治疗细胞,起始接种量为3.0×105/孔,在培养的第6、9、12天使用台盼蓝法对培养的过继免疫治疗细胞进行活力计数,发现CD3激发组的细胞增殖速度略快于CD40激发组(见图2)。体外培养第12天时,CD3激发组的细胞的数量达到了接种时的24倍左右(3.0×105~7.12×106),这与经典的过继免疫治疗细胞增殖速度(细胞数量平均增加25倍)一致,而CD40激发组培养的过继免疫治疗细胞到第12天时,细胞的数量达到了接种时的20倍左右。

图1 CD3激发组和CD40激发组的细胞形态学观察Fig.1 Cell morphology of CD3 and CD40 agonist groups

图2 CD3激发组和CD40激发组的细胞增殖曲线图Fig.2 Cell growth curve of CD3 and CD40 agonist group
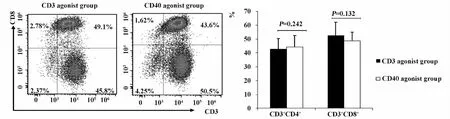
图3 CD3激发组和CD40激发组的T淋巴细胞的表达情况Fig.3 Expression of T lymphocyte in CD3 and CD40 agonist group
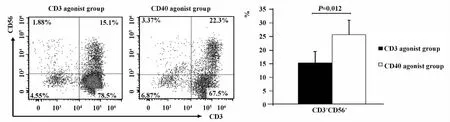
图4 CD3激发组和CD40激发组的CD3+CD56+细胞的表达情况Fig.4 Expression of CD3+CD56+cells in CD3 and CD40 agonist group
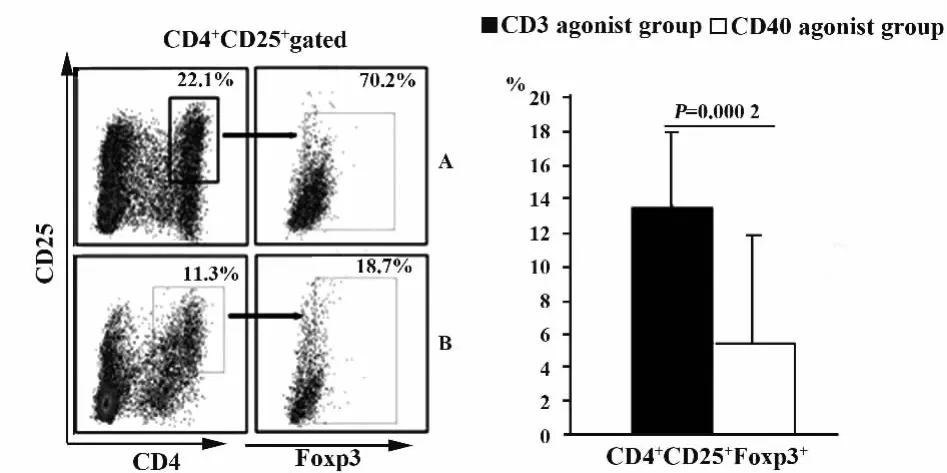
图5 CD40激发组的Treg细胞比例显著低于CD3激发组Fig.5 Treg cell percentage of CD40 agonist group is significantly lower than of CD3 agonist group
2.3 CD3激发组和CD40激发组的T淋巴细胞亚群分析 在培养的第9天收集培养的过继免疫治疗细胞,检测其CD3+CD4+T和CD3+CD8+T细胞群体的变化状况。结果显示,CD3激发组的 CD3+CD4+T和CD3+CD8+T细胞比例分别在(42.8%±7.56%)和(52.6% ±8.34%)左右,而CD40激发组的CD3+CD4+T和CD3+CD8+T细胞频率分别在(44.3% ±9.45%)和(48.7% ±6.18%)左右,两组间无显著差异(P>0.05,见图3)。
2.4 CD40激发组的NK-T(CD3+CD56+)细胞比例显著高于CD3激发组 在培养的第9天收集过继免疫治疗细胞,检测其CD3+CD56+细胞群体的变化状况。结果显示,CD3激发组的CD3+CD56+细胞比例为(15.3% ±4.12%),CD40激发组的CD3+CD56+细胞比例为(25.6% ±5.34%),两组之间存在显著差异(P<0.05,见图4)。
2.5 CD40激发组的Treg细胞比例低于CD3激发组 在培养的第9天收集过继免疫治疗细胞,检测其Treg细胞的变化。结果显示,CD40激发组过继免疫治疗细胞中Treg细胞的频率显著低于CD3激发组,两组有显著差异(P<0.05,见图5)。
2.6 CD40激发组出现独特的Mo-NK-DC样细胞群体 在培养的第9天收集培养的过继免疫治疗细胞,检测其 CD14+CD56+和 CD56+CD11c+细胞的变化状况。结果显示,CD40激发组培养的过继免疫治疗细胞中出现一群特殊的Mo-NK-DC样细胞群体,而在CD3激发组几乎未出现(见图6)。
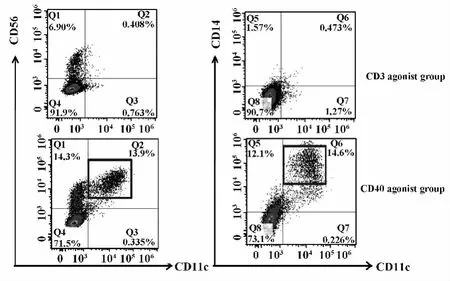
图6 CD40激发组出现独特的Mo-NK-DC样细胞群体(CD14+CD11c+/CD56+CD11c+)Fig.6 There occurs an unique set of Mo-NK-DC like cell group in CD40 agonist group(CD14+CD11c+/CD56+CD11c+)
3 讨论
恶性肿瘤是严重危害人类健康的重要疾病之一。目前,手术、放疗和化疗仍是主要的治疗手段,但各种原因都可导致疾病的复发,以致死亡率甚高。过继细胞免疫治疗(ACI)正成为当今继放化疗后治疗恶性肿瘤的一种新的治疗手段,主要通过取自体或异体免疫细胞,在细胞因子诱导下大量扩增具有抗肿瘤活性的淋巴细胞回输给肿瘤病人,介导患者的抗肿瘤免疫力[5]。
虽然常规以 CD3McAb联合细胞因子 IL-2,IFN-γ,IL-1α诱导的CIK细胞治疗是目前最为常用的方案,但存在着一些亟待解决的疗效不佳问题:由于用大剂量IL-2维持后期T细胞的增殖,大剂量IL-2会诱导一定数量的调节性T细胞(Treg)[6],这可能是影响CIK疗效的关键因素。鉴于常规CIK培养方案的不足,寻找更为有效的过继免疫细胞体外诱导方案始终是肿瘤免疫研究的热点。
CD40信号是抗原提呈细胞(APC)的分化及功能的关键调节途径[7];CD40信号激发可增强单核细胞和树突状细胞(DC)的生存能,促进单核细胞的杀瘤活性[8,9],以致对T细胞和APC细胞的功能均产生重要影响[10]。IFN-α 可提高 CD4+T细胞、CD8+T细胞和 NK细胞对 IFN-γ的表达,并平衡Th1/Th2免疫应答[11];IFN-α还能有效地扩增CD8+T细胞,提高其细胞活性[12];还有研究发现,IFN-α还可以促进DC细胞的活化和增加NK细胞的细胞毒性[13],因此被用于抗病毒感染和癌症免疫治疗中。研究表明,IL-7能刺激初始和记忆淋巴细胞增殖,同时IL-7协同促进T细胞成熟,向Th1细胞分化,抑制细胞凋亡[14];IL-7对淋巴细胞的各个亚群包括CD8+和CD4+T细胞、调节性T细胞和记忆性T细胞等均有促进增殖、活化和调节作用。已有研究显示,IL-7正逐渐成为肿瘤免疫应答和肿瘤免疫治疗研究的热点之一[15]。
本研究显示,尽管CD40激发组的细胞增殖数量略低于CD3激发组,但是这对要求数量的过继免疫治疗回输细胞没有影响。卫生部“人体细胞治疗临床研究质控要点”和中国免疫学会制定的“过继性免疫治疗癌症规范”规定每例患者需平均治疗2个疗程,每疗程回输细胞总数应不少于5×109个[16],通过血细胞分离仪采集的 PBMC,完全能达到治疗要求的数量,我们只需在培养前根据需要取足量PBMC即可。
我们研究发现,与CD3激发组相比,CD40激发组体外诱导的过继免疫细胞中,Treg比例明显下降,而CD3+CD56+NKT细胞比例显著增加,并且培养细胞群体里出现一群新的细胞群体,即表达CD14、CD56和CD11c分子的Mo-NK-DC样细胞,这群细胞的生物学特性和功能也有待探讨。综上所述,本研究通过CD40单克隆抗体联合细胞因子IFN-α和IL-7能有效扩增过继免疫细胞,降低Treg细胞比例同时提高了抗肿瘤能力的NKT细胞,该方法可能为肿瘤细胞过继免疫治疗提供又一崭新的途径。
[1]Wang ZX,Cao JX,Liu ZP,et al.Combination of chemotherapy and immunotherapy for colon cancer in China:A meta-analysis[J].World J Gastroenterol,2014,20(4):869-1126.
[2]Wang XP,Xu M.Intraperitoneal perfusion of cytokine-induced killer cells with local hyperthermia for advanced hepatocellular carcinoma[J].World J Gastroenterol,2013,19(19):2841-2978.
[3]蒋敬庭.细胞因子诱导的杀伤细胞抗肿瘤机制及应用[J].临床检验杂志,2012,30(10):837-842.
[4]郭 智,陈惠仁.细胞因子诱导的杀伤细胞体外培养的初步研究[J].中华临床医师杂志,2011,5(21):6318-6321.
[5]Beloki L,Ciáurriz M.The abrogation of TCR-independent interactions with human serum ensures a selective capture of therapeutic virus-specific CD8(+)T-cells by Multimer Technology in Adoptive Immunotherapy[J].J Immunol Methods,2013,396(1-2):168-172.
[6]Sandra Hervas-Stubbs,Jose Luis Perez-Gracia,Ana Rouzaut,et al.Direct effects of type I interferons on cells of the immune system[J].Clin Cancer Rese,2011,17(9):2619-2627.
[7]Agnieszka Anna Rucki,Zheng Li.Pancreatic cancer stroma:understanding biology leads to new therapeutic strategies[J].World J Gastroenterol,2014,20(9):2127-2428.
[8]Khalifeh MS ,Stabel JR.Clinical disease upregulates expression of CD40 and CD40L on peripheral blood mononuclear cells from cattle naturally infected with mycobacterium avium subsp.paratuberculosis[J].Clin Vaccine Immunol,2013,20(8):1274-1282.
[9]Li D,Zhong Y.Autocrine TNF-α-mediated NF-κB activation is a determinant for evasion of CD40-induced cytotoxicity in cancer cells[J].Biochem Biophys Res Commun,2013,436(3):467-472.
[10]文丽君,刘海燕.淋巴细胞表面CD40分子的表达和作用[J].免疫学杂志,2011,27(5):448-450.
[11]Jiang W ,Zhang Ch.IFN-α gene modification augments human natural killer cell line anti-human hepatocellular carcinoma function[J].Gene,2013,20(4):1062-1069.
[12]Sachdeva R,Shilpi RY.The interplay between the X-DING-CD4,IFN-α and IL-8 gene activity in quiescent and mitogen-or HIV-1-exposed PBMCs from HIV-1 elite controllers,AIDS progressors and HIV-negative controls[J].Innate Immun,2013,20(7):173-183.
[13]Zhang ZR ,Duan YC.Interferon Alpha 2b for Treating Patients with JAK2V617F Positive Polycythemia Vera and Essential Thrombocytosis[J].Asian Pac J Cancer Prev,2014,15(4):1681-1684.
[14]Juan Ramón Larrubia,Megha Uttam Lokhande.Role of T cell death in maintaining immune tolerance during persistent viral hepatitis[J].World J Gastroenterol,2013,19(2):1855-2010.
[15]Pérez-Bercoff L ,Vudattu NK.Reduced IL-7 responsiveness defined by signal transducer and activator of transcription 5 phosphorylation in T cells may be a marker for increased risk of developing cytomegalovirus disease in patients after hematopoietic stem cell transplantation[J].Biol Blood Marrow Transplant,2014,20(1):128-132.
[16]Zhihua W.CIK cell therapy for cancer:Current status of international clinical trials and future prospects[J].Chin J Cancer Biother,2013,20(2):129-137.
