猪流行性腹泻病毒野毒株/疫苗株RT-PCR鉴别诊断方法的建立
2014-11-23李长龙陈建飞时洪艳
李长龙,陈建飞,张 鑫,时洪艳,冯 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室猪传染病研究室,黑龙江 哈尔滨 150001)
猪流行性腹泻(PED)是由猪流行性腹泻病毒(PEDV)引起的以仔猪腹泻、呕吐和脱水为主要症状的一种急性、高度接触性肠道传染病。PED在世界范围内广泛流行,1978年首次在英国和比利时暴发[1-2]。我国PED流行也非常严重,自2010年下半年开始同猪传染性胃肠炎病毒、轮状病毒等混合感染呈现大规模流行。现地病料检测结果表明,2010-2011年我国部分地区PEDV的感染率高达54.7%,远高于猪传染性胃肠炎病毒(TGEV)(38.1%)和猪轮状病毒(PoRV)(5.04%)的感染率[3],给我国养猪业造成了巨大的经济损失。
PEDV其基因组从5′~3′依次编码复制酶多聚蛋白1ab、纤突蛋白(S)、ORF3蛋白、小膜蛋白(E)、膜糖蛋白(M)和核衣壳蛋白(N)。其中ORF3基因是PEDV基因组中的惟一辅助基因,也是造成强弱毒差异的主要基因[4-5],疫苗毒在ORF3内部存在碱基缺失现象。
目前国内外PEDV商品化疫苗毒株均为基因缺失弱毒疫苗,如我国的CV777株,日本的P-5V株和韩国的KPED-9和DR13株等[6]。这3个疫苗毒株均是从患病仔猪分离到强毒后经Vero细胞连续传代致弱而成。通过分析ORF3基因,在其缺失区域两端设计合理的引物,采用RT-PCR方法可对野毒和疫苗毒感染进行鉴定(引物所在位置见图1)。我们对黑龙江、吉林等地区送检的15份病料进行了检测,发现PEDV呈现混合感染,但仍以野毒感染为主,从而为PEDV的诊断和免疫提供重要参考。

1 材料与方法
1.1 病料来源 来自黑龙江、吉林等地有腹泻、呕吐等症状仔猪的小肠和粪便,共15份。
1.2 阳性质粒 PEDV野毒株(CH/S株)和疫苗株的ORF3基因阳性质粒均由本实验室克隆、保存;在本试验中做为阳性对照模板。
1.3 主要试剂 TRIZol总RNA提取试剂,购自Invitrogen公司;鼠源反转录酶(M-MLV)及反转录试剂,购自Promega公司;EmeraldAmp PCR Master Mix,购自TaKaRa公司。
1.4 引物设计 根据PEDV野毒/疫苗毒ORF3基因序列比对后结果在疫苗毒缺失区域两端用Primer 5.0设计引物,引物序列:PORF3-U:5′-GGAGCTCAATGTAGTTCCAA-3′(24 881~24 900);PORF3-L:5′-AGCTGCTTTACCATTGAGAA-3′(25 180~25 199),由哈尔滨博仕生物技术有限公司合成。预期野毒扩增长度为319 bp,疫苗毒扩增长度为270 bp。
1.5 特异性检验 以PEDV野毒株CH/S和疫苗株ORF3阳性质粒、猪传染性胃肠炎病毒、猪轮状病毒、猪瘟病毒、猪伪狂犬病病毒和猪繁殖和呼吸综合征病毒的cDNA为模板进行PCR扩增。反应在20 μL体系中进行,预混酶10 μL;cDNA 1 μL;上下游引物各1 μL;水7 μL。反应条件:94 ℃ 5 min;98 ℃ 10 s、55 ℃ 30 s;72 ℃ 30 s,30个循环;72 ℃ 10 min。
1.6 病料处理和总RNA提取 取适量小肠内容物或粪便放入1.5 mL灭菌EP管中,加入800 μL PBS混悬后12 000 r/min,(4 ℃)离心10 min,取上清,按照TRIZol说明书提取总RNA。
1.7 cDNA合成和PCR检测 按照鼠源反转录酶(M-MLV)及反转录试剂说明书合成,以合成的cDNA模板进行PCR扩增。反应体系和反应条件同1.5。扩增产物用2%琼脂糖凝胶电泳检测。
2 结果
2.1 PEDV野毒株和疫苗株ORF3基因的扩增 以PEDV 野毒 CH/S(GU372733)和 PEDV 疫 苗 毒 株CV777细胞适应毒(GU372744)ORF3基因的阳性质粒为模板进行PCR扩增,经2%琼脂糖凝胶电泳检测结果显示,野毒扩增片段为319 bp,疫苗毒扩增片段为270 bp,与预期大小相符,差异明显(图2)。

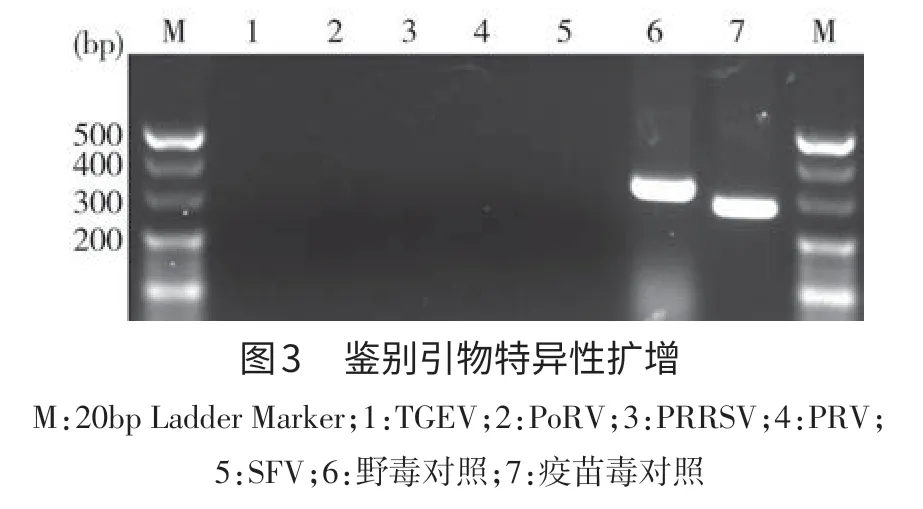
2.2 特异性扩增 以已检测确诊的TGEV、PoRV、PRRSV、PRV、SFV阳性病料的cDNA为模板进行扩增。2%琼脂糖凝胶电泳检测结果显示没有目的条带,而PEDV野毒和疫苗毒均有预期大小的目的条带,表明本研究所设计的鉴别引物扩增效果特异性较好(图3)。
2.3 病料cDNA扩增 对2012年10月份至2013年2月份送检的15份疑似PEDV感染猪病料cDNA为模板进行扩增,经2%琼脂糖凝胶电泳检测结果显示,15份病料均能检测到PEDV,其中13份为野毒感染,2份为疫苗毒感染(图4)。
3 讨论
PEDV是引起仔猪腹泻的重要病原之一,而且新生仔猪一旦发病,死亡率往往接近100%,给养猪业带来极大的经济损失,自2010年下半年以来,我国出现大范围的猪流行性腹泻疫情,而且疫情多持续存在。经本实验室所检测病料数据的统计结果显示,PEDV感染率明显高于另外两个猪病毒性腹泻病原-TGEV和PoRV[7]。
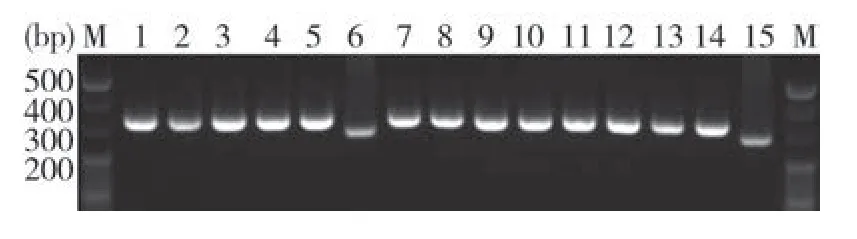
图4 病料cDNA扩增
PEDV的ORF3基因是PEDV毒力的决定性因素之一[8]。弱毒普遍都是在ORF3基因中连续缺失数十个碱基,而且在弱毒缺失区域周围的序列却相对保守,不同毒株的ORF3基因相似性达到97.8%[8-9]。这也为PEDV野毒和疫苗毒的鉴定提供了一个很好的基础。
目前已有多个实验室建立了多种PEDV病毒检测方法[10-11]。但是目前这些对PEDV病原的检测也多无法区别野毒和疫苗毒。本研究利用PEDV强弱毒株之间自然存在的ORF3基因部分缺失设计引物进行检测,既可以对PEDV病原进行检测,还可以通过PCR产物大小进行野毒疫苗毒鉴别诊断,而且费用相对较低,可进行大规模流行病学调查。对PEDV的免疫和强毒感染情况进行区分,有助于减少免疫猪被淘汰的可能,降低经济损失。
[1]Pensaert M B,de Bouck P.A new coronavirus like particle associated with diarrhea in swine[J].Arch Virol,1978,58:243-247.
[2]Sergeev O V.Porcine epidemic diarrhea[J].Vopr Virusol,2009,54(2):4-8.
[3]陈建飞,刘孝珍,时洪艳,等.2010-2011年仔猪腹泻的病因分析和预防控制[J].养猪,2011,5(1):81-83.
[4]Woods R D.Efficacy of a transmissible gastroenteritis coronavirus with an altered ORF3 gene[J].Canadian Journal of Veterinary Research,2001,65:28-32.
[5]Song D S,Yang J S,Oh J S,et al.Differentiation of a Vero cell adapted porcine epidemic diarrhea virus from Korean field strains by restriction fragment length polymorphism analysis of ORF 3[J].Vaccine,2003,21:1833-1842.
[6]Kocherhans R,Bridgen A,Ackermann M,et al.Completion of the porcine epidemic diarrhoea coronavirus(PEDV)genome sequence[J].Virus Genes,2001,23(2):137-144.
[7]张强敏,郭福生,尹燕博,等.猪流行性腹泻病毒分子生物学特征[J].中国病毒学,2002,17(4):381-384.
[8]PARK S,MOON H,LUO Y,et al.Cloning and further sequence analysis of the ORF 3 gene of wild and attenuated type porcine epidemic diarrhea viruses[J].Virus Genes,2008,36(1):95-104.
[9]Chen J F,Sun D B,Wang C B,et al.Molecular characterization and phylogenetic analysis of membrane protein genes of porcine epidemic diarrhea virus isolates in China[J].Virus Genes,2008,36(2):355-364.
[10]邹勇,钱永清,唐永兰,等.猪流行性腹泻、猪传染性胃肠炎和猪轮状病毒RT-PCR鉴别诊断技术研究[J].上海农业学报,2003,19(2):82-84.
[11]刘邓,袁秀芳,冉多良,等.TaqMan荧光定量PCR检测猪流行性腹泻病毒方法的建立与初步应用[J].中国动物传染病学报,2010,18(1):28-33.
