绿色荧光蛋白转基因小鼠骨髓间充质干细胞脑内移植后的成活及迁移
2014-11-23毕涌林晓滨李晓莉魏鹏王廷华张旭洪娟
毕涌 林晓滨 李晓莉 魏鹏 王廷华 张旭 洪娟
帕金森病(Parkinson disease,PD)的中枢神经系统损伤是一个持续进展的过程,其治疗关键在于防止病情进展、修复已损害的多巴胺能神经元,延缓其发生不可逆损害,细胞和基因治疗是实现这一目标的最佳途径之一[1-2]。骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一种具有自我复制、多向分化潜能的成体干细胞,具有免疫原性弱,能稳定高效表达外源基因等优点,已成为组织工程、基因治疗和再生医学研究中理想的种子细胞[3]。然而,干细胞移植后在体内的迁移、定植、分布、分化等有赖于对干细胞的示踪和定量技术。从绿色荧光蛋白(green fluorescent protein,GFP)转基因动物分离得到的干细胞标记稳定,转染率高,安全有效,是最为理想的选择[4]。因此,本研究拟建立GFP转基因小鼠MSCs细胞系,并经脑内移植治疗PD模型大鼠,观察大鼠行为学、脑组织形态学的变化及MSCs成活和迁移分布情况,为MSCs在组织工程等研究领域中的应用提供实验基础。
1 材料和方法
1.1 材料
1.1.1 实验动物:GFP转基因小鼠由昆明医学院神经科学研究所提供。成年健康SD大鼠68只,体质量180~230g,由上海斯莱克实验动物有限公司提供。
1.1.2 主要试剂和仪器:DMEM/F1培养基、胎牛血清(fetal bovine serum,FBS)购自Hyclone公司;胰蛋白酶购自 Gibco公司;6-羟基多巴(6-OHDA)和0.1%(体积分数)阿扑吗啡(apomor-phine,APO)购自 Sigma公司。CD44、CD54、CD45抗体及二步法免疫组化试剂盒(国产,北京中山生物技术有限公司),超净工作台,SHEL LAB TC2323CO2Incubator,Olmyplus倒置相差显微镜、Leica DM IRB荧光显微镜。
1.2 方法
1.2.1 建立GFP转基因小鼠 MSCs细胞系:(1)MSCs的分离与培养:参照Phinney等[5]的方法,脱颈法处死GFP转基因小鼠,于75%(体积分数)乙醇中浸泡消毒后无菌条件下取小鼠股骨并分离其骨髓,采用全骨髓贴壁培养法获取MSCs。用适量DMEM/F12液吹打成密度为1×106/mL的细胞悬液,接种于含10%(体积分数)胎牛血清的DMEM/F12混合培养液中,在37℃、5%(体积分数)CO2、饱和湿度的恒温培养箱中培养。接种8 h后首次全量换液,此后每隔3d全量换液1次。当细胞贴壁达90%融合时即可进行传代。传代至第5代,100倍荧光显微镜下直接观察,MSCs传代培养后如形成形态均一的梭形细胞,呈GFP强阳性表达,则可进行MSCs表型鉴定。
(2)MSCs的表型特点及鉴定:采用CD44、CD45和CD54抗体分别对原代培养3d及传代培养至第5代的细胞进行免疫组织化学染色,对MSCs进行鉴定。DAB显色后于250倍倒置显微镜下观察,对培养瓶底的中心及四个象限随机各取1个视野(×250)计算阳性细胞的百分数。经免疫组化鉴定,第5代MSCs的CD44和CD54阳性率较原代细胞明显增高,而CD44阳性率明显降低则提示纯度得到提高,可用于PD大鼠模型移植。
1.2.2 PD模型大鼠 MSCs移植后行为学及MSCs在脑组织中的成活及迁移分布情况观察:(1)PD大鼠模型的制备:通过随机数表将68只SD大鼠随机分为两组,其中6-OHDA实验组62只,对照组6只。参照大鼠立体定位图谱,采用单侧纹状体内两点注射6-OHDA法制作PD大鼠模型,对照组6只注射生理盐水。分别于术后1、2、4、6、8、10周于颈部皮下注射APO,诱发大鼠向健侧的单向旋转行为,PD模型旋转检测仪记录动物旋转情况,每次记录30min,平均旋转圈数≥7次/min为造模成功。实验组62只SD大鼠中共47只造模成功,主要表现为运动迟缓,少动,竖毛,躬身,尾僵等症状,术后4周出现稳定的超过7次/min的旋转行为。对照组术后未诱发出旋转行为。
(2)PD模型大鼠脑内的细胞移植:47只成功PD模型大鼠随机按随机数表抽取30只并分为3组:MSCs移植组(MSCs组)17只,DMEM/F12培养液对照组(DMEM/F12组)7只,PD空白对照组6只。造模成功后,MSCs组右侧纹状体分别注入5μL细胞悬液,每点植入的MSCs细胞数约5×105个。DMEM/F12组以等体积DMEM/F12培养液代替细胞同法注入右侧纹状体(排除细胞培养过程中使用培养液成分对实验结果的干扰)。PD空白对照组麻醉后不作任何移植处理。
(3)MSCs组移植后对应时间点各组的行为学检测:MSCs组移植后的1、2、4、6周4个时间点,各组动物均按体质量0.1mL/100g予颈部皮下注射0.1%(体积分数)APO,诱发大鼠单向旋转行为。APO注射后30min开始计数旋转行为,以旋转360°为1次,分别计数各时间点的旋转次数。
(4)移植细胞的荧光染色观察:利用移植细胞自身能发出荧光的特点于术后不同时段观察移植细胞在MSCs组动物脑内成活及迁移的情况。每次从MSCs组动物中随机选出2只大鼠,分别于移植后的1d、1周、4周及6周在腹腔麻醉下灌注,取移植区脑组织切片进行观察。将细胞移植组切片置100倍倒置荧光显微镜下观察并予以摄片记录。GFP转基因小鼠MSCs自身可发出荧光,观察到的荧光细胞即为植入后存活的细胞。
1.3 统计学处理 采用SPSS17.0软件进行分析。所有计量资料数据均以均数±标准差()表示;CD44、CD54和CD45抗体对原代培养3d及传至5代的细胞进行免疫组织化学染色后的表型鉴定结果比较采用t检验;MSCs移植后的行为学检测结果与DMEM/F12组及PD空白对照组进行比较,采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 MSCs生长情况及GFP表达 骨髓原代细胞接种于培养瓶,梭形生长的细胞数量逐渐增多,胞质中央均可见椭圆形胞核,符合成纤维细胞的特征(图1A)。传至第5代时,MSCs形成形态均一,呈漩涡状或放射状平行排列生长的梭形细胞(图1B)。荧光显微镜下直接观察,可见原代和传代5代的MSCs均呈GFP强阳性表达(图1)。
2.2 MSCs的表型鉴定 第5代MSCs的CD44〔(95.8±0.8)%〕、CD54〔(91.4±1.3)%〕阳性率高于原代培养3d细胞的CD44〔(64.4±2.2)%〕(t=2.73,P<0.05)、CD54〔(63.2±0.5)%〕(t=2.24,P<0.05)阳性率;CD45阳性率降低〔分别为(2.1%±1.8)%和(33.6 ±4.1)%,t=4.19,P<0.05)〕。经免疫组化鉴定,第5代MSCs的抗原标记蛋白CD45和CD54阳性率较原代细胞明显增高,而造血细胞表面标记蛋白CD44阳性率明显降低,上述结果表明经全骨髓贴壁分离法传代培养,MSCs的纯度得到了提高(图2)。
2.3 MSCs组MSCs移植后在脑内的分布与存活情况 MSCs组大鼠于移植点及邻近部位均可见绿色荧光细胞,针道周围组织内有明显的细胞迁移。移植后4周针道基本愈合,针道周围及充填的组织内均可见大量的绿色荧光细胞。移植后6周针道完全愈合,移植点及周围组织仍可见绿色荧光细胞,未见明显的胶质瘢痕形成。上述表现表明外源性MSCs能在PD大鼠纹状体内存活并与周围组织建立良好的整合(图3)。
2.4 各组不同时间点行为学表现 MSCs组大鼠在术后第2周,其活动程度、范围和觅食能力均较DMEM/F12组和PD空白对照组明显增强;在APO诱发下30min内平均旋转圈数较移植术前明显减少(P<0.05),并低于DMEM/F12组和PD空白对照组(P<0.05);移植术后第4周和第6周改善最为明显,平均旋转圈数较移植后第2周明显减少(P<0.05),较 DMEM/F12组和PD空白对照组也明显减少(P<0.05)。DMEM/F12组和PD空白对照组的旋转圈数MSCs组移植术前后对应时间点比较无明显变化(P>0.05)(表1)。
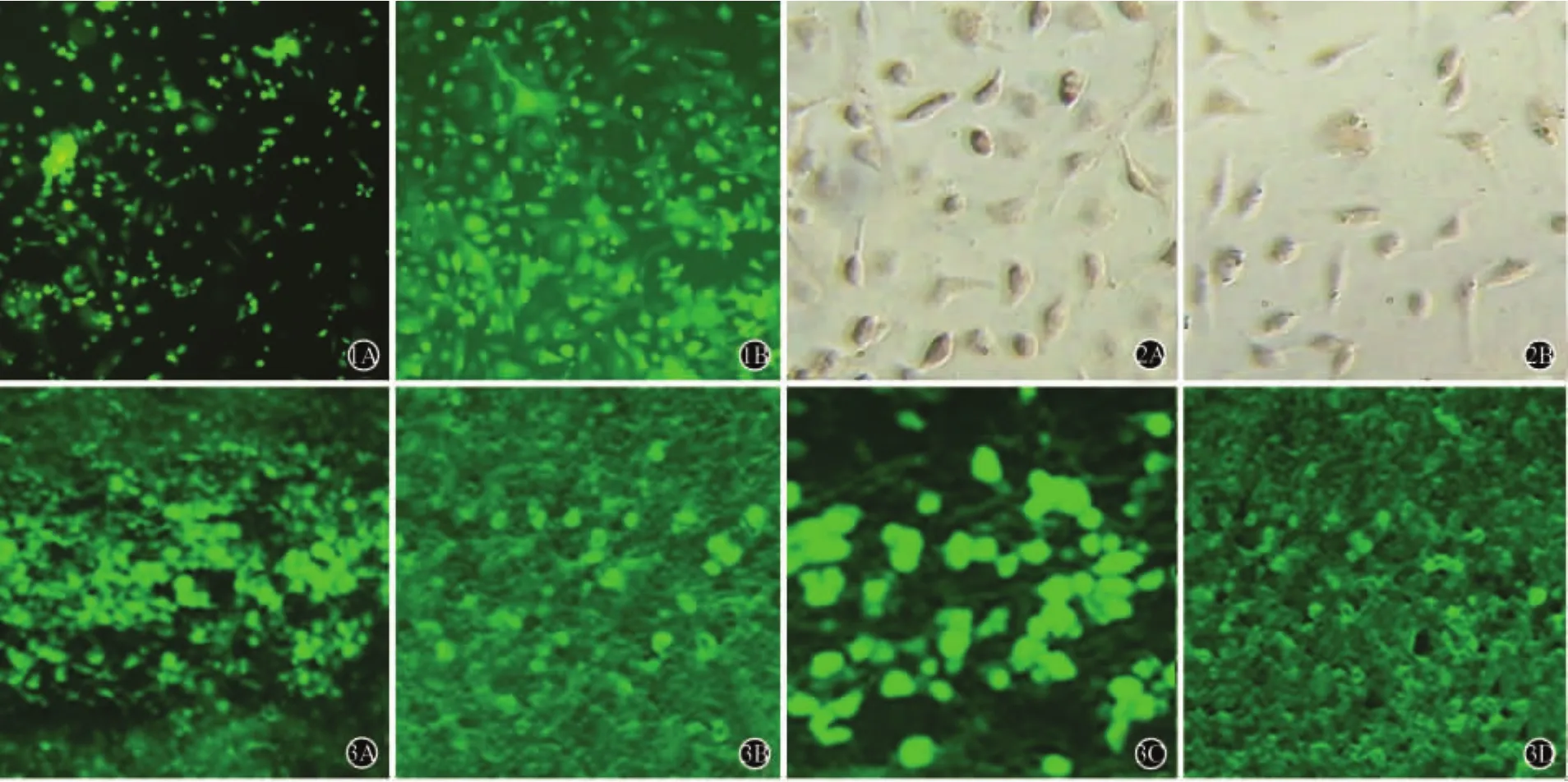
图1 GFP转基因小鼠MSCs培养(免疫荧光染色×100)A:原代培养3d;B:传代培养5代图2 传代培养第5代MSCs的表型鉴定(免疫组化×250)A:CD44表达阳性;B:CD54表达阳性图3 MSCs移植组移植后在针道周围脑组织中的分布情况(免疫荧光染色×100)A:移植后1d;B:移植后1周;C:移植后4周;D:移植后6周
表1 APO诱发各组大鼠旋转行为的实验结果(,r/min)

表1 APO诱发各组大鼠旋转行为的实验结果(,r/min)
注:移植前:MSCs组移植前对应时间点;移植后:MSCs组移植后对应时间点;与移植前比较,*P<0.05;与PD空白对照组和DMEM/F12组分别比较,#P<0.05;与移植后2周组比较,▽P<0.05;与移植后4周组比较,▲P<0.05
组别 n 移植前移植后2周 4周 6周MSCs组 17 10.8±1.8 9.2±1.8*# 5.7±2.1*#▽ 6.2±1.9*#▽▲DMEM/F12组 7 10.3±1.2 10.1±2.1 10.6±1.8 10.2±1.4 PD空白对照组6 11.3±1.9 10.8±2.2 11.1±2.1 10.4±1.7
3 讨论
PD是第二大常见的神经系统变性疾病,其治疗关键是防止病情进展,修复已损害的多巴胺能神经元。目前临床以左旋多巴进行的递质替代治疗,只能部分改善PD的早期症状,不能阻止多巴胺能神经元的持续变性,新兴的干细胞移植治疗方法为PD 的治疗带来了新的希望[1,3]。
有研究显示,鼠的MSCs能够自我复制,表达音速波状蛋白(Shh)受体、转染核相关因子1(Nurr 1)和成纤维细胞生长因子(FGF)2-1、4等典型的多巴胺基因产物;纹状体内移植MSCs后,不仅可以提高移植部位的酪氨酸羟化酶蛋白、mRNA以及多巴胺水平,还明显促进了内源性神经干细胞的分化和修复作用[6-8]。此外,MSCs还可通过分泌神经营养因子和免疫调节作用机制对多巴胺神经元产生保护作用[9-10]。多项研究显示,MSCs移植在脑内可与损伤细胞融合,替代受损细胞重建神经功能区和传导通路,通过分泌神经营养因子和减轻炎性损伤等作用机制减轻PD大鼠模型的运动功能障碍,缓解和逆转病情[11-13]。
本研究中,PD模型大鼠分别在MSCs脑内移植治疗后2周、4周和6周进行动物行为学检测,结果显示其平均旋转圈数较PD空白及培养液对照组明显降低,表明MSCs移植治疗不仅在短时间内缓解PD症状,还能够较为长期的改善PD临床症状,与黄月等[14]的研究结果一致。此外,在MSCs移植组PD模型大鼠的移植点及邻近部位均可观察到绿色荧光细胞,针道周围组织内有明显的细胞迁移(图3)。移植后4~6周针道基本愈合,而针道周围及充填的组织内仍可见大量的绿色荧光细胞,未见明显的胶质瘢痕形成(图3),进一步支持外源性的MSCs能在PD大鼠纹状体内存活、迁移,并与周围组织建立良好的整合的观点[1,3]。
MSCs可与脑内损伤细胞融合,替代受损细胞重建神经功能区,然而移植后在活体中观察其治疗机制如分化、迁移、存活、体内分布等都离不开良好的示踪技术。传统的示踪方法,如荧光染料标记、核酸标记等均需在离体状态下鉴定,难以满足MSCs移植进入临床的需求。GFP转基因小鼠所有体细胞均有稳定的绿色荧光表达,对于MSCs移植后长期观察其体内分化、迁徙、整合等过程的示踪方面有着独到之处,不仅能够用于动态观察体内外MSCs生长分化过程,还可观察研究MSCs移植后分化的新生神经元与宿主神经元之间的突触联系,为 MSCs示踪研究提供了一种新途径[4,15]。
本研究中,课题组成功分离、培养了GFP转基因小鼠的MSCs,为干细胞移植后在体内的迁移、定植、分布、分化等研究提供了成熟、有效的示踪技术。此外,本研究还采用特异性相对较高的标记分子CD44和CD54抗体进行免疫组织化学染色进行鉴定,利用造血细胞的特异性标记CD45作为对照。研究结果显示,传代培养第5代细胞的CD44、CD54阳性率明显较高,而CD45阳性率降低,说明采用贴壁分离传代培养的方法可明显提高MSCs的纯度,与Colter等[16]的研究结果一致 。
综上,本研究成功建立了GFP转基因小鼠MSCs细胞系并进行了鉴定,并将所培养的MSCs细胞移植入PD模型大鼠脑组织,结果显示,MSCs脑内移植不仅能明显改善PD模型大鼠行为学症状,还能够与宿主组织产生整合,具有良好的组织相容性,为今后MSCs移植治疗PD及在体观察MSCs作为种子细胞参与神经再生和修复的治疗机制提供了实验基础。
[1]Kitada M,Dezawa M.Parkinson’s disease and mesenchymal stem cells:potential for cell-based therapy[J].Parkinsons Dis,2012,2012:873706.
[2]Allen SJ,Watson JJ,Shoemark DK.GDNF,NGF and BDNF as therapeutic options for neurodegeneration[J].Pharmacol Ther,2013,138(2):155-175.
[3]Uccelli A,Laroni A,Freedman MS.Mesenchymal stem cells for the treatment of multiple sclerosis and other neurological diseases[J].Lancet Neurol,2011,10(7):649-656.
[4]Remy S,Tesson L,Usal C,et al.New lines of GFP transgenic rats relevant for regenerative medicine and gene therapy[J].Transgenic Res,2010,19(5):745-763.
[5]Phinney DG.Isolation of mesenchymal stem cells from murine bone marrow by Immunodepletion[J].MethodsMol Biol,2008,449:171-186.
[6]Kramer BC,WoodburyD,Black TB.Adult rat bone marrow stromal cells express genes associated with dopamine neurons[J].Biochem Bio Phys Res Conunun,2006,343(4):1045-1052.
[7]Jin GZ,Cho SJ,Lee YS,et al.Intrastriatal grafts of mesenchymal stem cells in adult intact rats can elevate tyrosine hydroxylase expression and dopamine levels[J].Cell Biol Int,2009,16;34(1):135-140.
[8]Cova L,Armentero MT,Zennaro E,et al.Multiple neurogenic and neurorescue effects of human mesenchymal stem cell after transplantation in an experimental model of Parkinson’s disease[J].Brain Res,2010,1311(1):12-27.
[9]Kim YJ,Park HJ,Lee G,et al.Neuroprotective effects of human mesenchymal stem cells on dopaminergic neurons through anti-inflammatory action[J].Glia,2009,57(1):13-23.
[10]Sadan O,Bahat-Stromza M,Barhum Y,et al.Protective effects of neurotrophic factor-secreting cells in a 6-OHDA rat model of Parkinson disease[J].Stem Cells Dev,2009,18(8):1179-1190.
[11]Glavaski-Joksimovic A,Virag T,Chang QA,et al.Reversal of dopaminergic degeneration in a parkinsonian rat following micrografting of human bone marrow-derived neural progenitors[J].Cell Transplant,2009,18(7):801-814.
[12]Bahat-Stroomza M,Barhum Y,Levy YS,et al.Induction of adult human bone marrow mesenchymal stromal cells into functional astrocyte-like cells:potential for restorative treatment in Parkinson’s disease[J].J Mol Neurosci,2009,39(1-2):199-210.
[13]丁伟荣,吴晓牧,陈元仲,等.音速波状蛋白促进骨髓间充质干细胞向多巴胺能神经元分化[J].中国神经免疫学和神经病学杂志,2007,14(4):221-223,228.
[14]黄月,常成,张杰文.TH-NTN基因修饰的骨髓间充质干细胞对帕金森病模型大鼠脑内相关蛋白表达的影响[J].中华医学杂志,2012,92,(33):2353-2356.
[15]Hayakawa J,Migita M,Ueda T,et al.Generation of a chimeric mouse reconstituted with greenfluorescent protein—positive bonemarrow cells:a useful model for studying the behavior of bone marrow cells in regeneration in vivo[J].Int J Hematol,2003,77(5):456-462.
[16]Colter D,Class R,DiGirolamo C,et al.Rapid expransion of recycling stem cells in cultures of plastic-adherent cells from human bone marrow[J].Proc Natl Acad Sci USA,2000,97(7):3213-3218.
