奈达铂联合β-榄香烯对宫颈癌HeLa细胞增殖和凋亡的影响
2014-11-21马力天任秦有王彦达蒋宏祥荆云涛杨明会
郑 瑾,马力天,任秦有,刘 毅,王彦达,蒋宏祥,荆云涛,杨明会*
(1解放军总医院中医院,北京100085;2第四军医大学唐都医院中医科暨中西医结合肿瘤科;3第四军医大学;#共同第一作者;*通讯作者,E-mail:Ymh9651@sina.com)
奈达铂[1]、β-榄香烯[2-4]对宫颈癌 HeLa 细胞都有抑制作用,但是宫颈癌对化疗的敏感性差,并且大剂量使用化疗药物会产生严重的副作用。β-榄香烯拥有较好的抗肿瘤作用,并且可以改善化疗后出现的骨髓抑制[5]。本实验采用体外培养的宫颈癌HeLa细胞为靶细胞,用MTT法观察不同剂量榄香烯、奈达铂单独和联合作用不同时间对HeLa细胞增殖的影响,流式细胞术检测其对HeLa细胞凋亡的情况。旨在为进一步研究新的化疗方案和榄香烯的作用机制提供参考。
1 材料与方法
1.1 材料
β-榄香烯乳(大连华立金药业有限公司),MTT(购自晶彩生物有限公司),奈达铂(齐鲁制药有限公司)、DMEM高糖培养基(Thermofisher)、四季青胎牛血清(浙江天杭生物科技有限公司)。HeLa细胞来自第四军医大学放射医学教研室,流式细胞仪(美国Bection Dickinson公司)。
1.2 HeLa细胞的培养及传代
用含 10%胎牛血清、100μg/ml青霉素、100 μg/ml链霉素、1%L-谷氨酰胺的DMEM培养基将HeLa细胞培养于37℃、5%CO2的细胞孵箱中,每天换液一次。在倒置显微镜下观察细胞密度为80%-90%时,以胰酶37℃消化2-3 min传代。
1.3 药物浓度的选择
按公式 S=0.006 1×身高 +0.012 4×体重-0.009 9(S为体表面积,单位:m2;H为身高,单位:cm;W为体重,单位:kg)计算体重为50 kg,身高170 cm人的体表面积为1.647 1 m2。奈达铂的化疗剂量为100 mg/m2,因此化疗量为1.647 1×100=164.71 mg。细胞外液约占体重的20%,即50×20%=10 L,即病人体内药物浓度为16.471μg/ml,所以设计奈达铂的浓度梯度为 7.5,15,30,45,60 μg/ml。同理得出榄香烯的梯度为 25,50,100,150,200 μg/ml。
1.4 MTT法检测HeLa细胞的增殖情况
对数生长期的HeLa细胞,1 000 r/min离心5 min,用高糖DMEM(含10%胎牛血清)将细胞浓度调为1×105/ml细胞悬液后,接种于96孔培养板,每孔加细胞悬液100μl,放在37℃、5%CO2的细胞培养箱中,细胞贴壁长满孔底后,更换培养基,并且每孔分别加入无菌β-榄香烯,使终浓度达到25,50,100,150,200 μg/ml;奈达铂溶于PBS 中,使终浓度达到 7.5,15,30,45,60 μg/ml。每一浓度设3个复孔,另设空白对照组。此外,每一浓度分别设立单加培养基、药物,不加细胞的对照组,用来判定药物本身是否会和MTT反应而影响实验结果。单独作用24 h、48 h,去培养基,用PBS将每个孔洗三遍(以排除药物对光密度值产生的影响)、加入200μl培养基后,每孔加20μl 5 mg/ml MTT溶液,孵育4 h,每孔加入二甲基亚砜180μl,在微型混合器上振荡10 min后于全自动酶标仪上测定490 nm OD值。实验重复三次,取均值计算增殖抑制率。增殖抑制率=(1-OD药物组/OD对照组)×100%。
1.5 联合用药浓度的选择
根据绘制出的增殖曲线,结合临床上使用奈达铂[6]和 β-榄香烯[7]的不同剂量和最大耐受量,我们选择奈达铂的最适浓度为15μg/ml,β-榄香烯的最适浓度为150μg/ml。
1.6 MTT法检测奈达铂联合β-榄香烯乳对HeLa细胞的增殖情况
方法同1.4,共分四组作用24 h、48 h。A 组:β-榄香烯乳(150μg/ml),B组:奈达铂(15μg/m),C组:联合用药组(浓度同前两组),D组:空白对照组。每一浓度设4个复孔。实验重复三次,取均值计算增殖抑制率。
1.7 流式细胞术检测联合用药时细胞的凋亡情况
取对数生长期的HeLa细胞,1 000 r/min离心5 min,用高糖DMEM(含10%胎牛血清)将细胞浓度调为1×106/ml细胞悬液后,接种于6孔板。共分四组,A组:β-榄香烯(150μg/ml),B组:奈达铂组(15μg/m),C组:联合用药组(浓度同前两组),D组:空白对照组,每孔加细胞悬液2 ml,放在37℃、5%CO2的细胞培养箱中,细胞贴壁长到70%-80%后,按照不同组别分别加入奈达铂和β-榄香烯。
使用Bection Dickinson公司流式细胞仪,按照说明书收集加药后24 h的细胞上清和贴壁细胞(悬浮细胞直接收集到离心管中,贴壁细胞用胰酶消化),细胞数不少于5×105个。常规离心(1 000 r/min)离心5 min,用PBS将细胞洗3遍,离心,倒掉上清后混匀。根据AnnexinⅤ-FITC/PI双标记试剂盒说明,取195μl细胞悬液,加入5μl AnnexinⅤ-FITC混匀,室温反应10 min,PBS洗细胞一次,再以190μl稀释的结合缓冲液重悬,加10μl碘化丙啶染色液(PI),轻轻混匀,随即用流式细胞仪分析。
1.8 统计学分析
不同反应时间以及药物在不同作用时间OD值的差别用t检验。采用单因素方差分析(one way ANOVA)比较各组均数之间的差异有无统计学意义。流式细胞仪分析采集软件:BD FACSDiva Software,以P<0.05为差异具有统计学意义。使用两药相互作用系数(CDI)评价两药相互作用性质,CDI=E/(A×B),E是两药联合组与对照组吸光度比值,A或B是各单药组与对照组吸光度的比值。如果CDI<1,则两药作用性质为协同;如果CDI=1,则两药作用性质为相加;如果CDI>1,则两药作用性质为拮抗。
2 结果
2.1 奈达铂和β-榄香烯乳对HeLa细胞增殖的影响
奈达铂(图1)和β-榄香烯(图2)对HeLa细胞均有显著抑制作用,通过单因素方差分析认为榄香烯和奈达铂分别作用的6个处理组的光密度值总体均数不全相等,即不同剂量药物对HeLa细胞增殖抑制有影响。
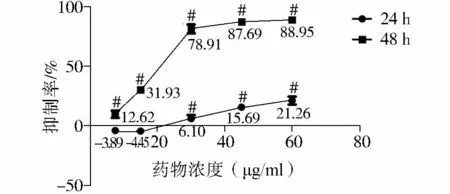
图1 奈达铂对HeLa细胞增殖的影响Figure 1 Effect of nedaplatin on the proliferation of HeLa cells
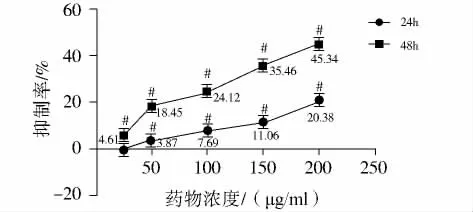
图2 β-榄香烯对HeLa细胞增殖的影响Figure 2 Effect ofβ-elemene on the proliferation of HeLa cell
2.2 奈达铂联合β-榄香烯乳对HeLa细胞增殖的影响
MTT法结果显示联合用药组24 h抑制率为(52.70±6.76)%,高于榄香烯组(26.39±5.79)%和奈达铂组(0.82±5.79)%;48 h联合用药抑制率为(67.04±3.78)% ,高于榄香烯组(54.44±2.00)%和奈达铂组(31.21±4.63)%(图3)。联合用药组对HeLa细胞有显著抑制作用,抑制率均大于单独用药(P<0.01)。24h和48 h的CDI值依次为 0.65、1.05。
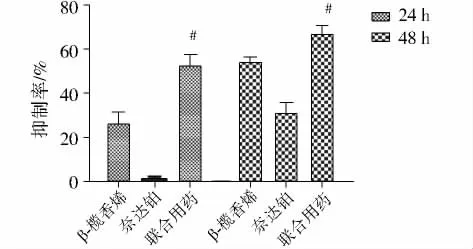
图3 联合用药对HeLa细胞增殖的影响Figure 3 Effect ofβ-elemene combined with nedaplatin on the proliferation of HeLa cell
2.3 联合用药对HeLa细胞凋亡的影响
与单独用药组相比,联合用药组在24 h后细胞的凋亡率凋亡(B2+B4)虽然不高,但是死细胞(B1)较多(见图4),一方面与榄香烯的细胞毒性有关,另一方面,可能与检测的时间点有关。
3 讨论
宫颈癌的发病率在我国女性生殖系统恶性肿瘤中最高,目前主要的治疗方法是手术切除和放疗,对化疗相对不敏感,故化疗效果难以令人满意[8]。寻找一种副作用较小、化疗增效且病人可以耐受的方案显得很重要。β-榄香烯 (β-elemene)是从姜科植物温郁金中提取的抗癌有效成分,在用药过程中不发生骨髓抑制。对肝癌 HepG2细胞[9]、胃癌[10]、乳腺癌[11]等有较好的抑制作用。在本实验中,用β-榄香烯和适当剂量的奈达铂联合使用其抑制作用显著高于单独使用奈达铂。奈达铂(nedaplatin)配伍参加大多数化疗方案,副作用较小,但是在使用期间依然会发生过敏反应[12,13]。其抑制细胞增殖的作用机制和顺铂相似,都是破坏DNA复制而抑制细胞增殖。不同浓度奈达铂对细胞的影响有差异性,低剂量的奈达铂可能导致细胞的耐药,这种耐药主要是通过DNA的损伤修复能力增强产生的[14]。榄香烯可以通过影响PI3-K-Akt/PKB和MAPK信号转导通路来抑制细胞增殖[15-17],并且可以使细胞周期阻滞在 G0/G1期[18]。
在本实验中,用MTT法分别检测了奈达铂和β-榄香烯对HeLa细胞的抑制作用,β-榄香烯对He-La细胞确实有抑制作用是毋庸置疑的,但是其抑制率仍然值得商榷,因为MTT法测得的结果还可能受下列因素的影响:①药物的放置时间和保存方式,榄香烯的规格为20 ml,一次实验中不可能将其全部用完,剩余的药物保存在血清瓶中,拧紧瓶盖,贴上封口膜放置于4℃冰箱,虽然再次使用该药和上次使用时间间隔很短,但依然无法确保这样做不会对实验产生影响。②榄香烯是乳白色液体,我们通过设计单加培养基和药物,不加细胞的对照组证实该剂量的β-榄香烯不会和MTT反应,并且我们在加入MTT之前将细胞用PBS洗三次,去除了培养基中的β-榄香烯,但是有部分残留在细胞内的β-榄香烯会对最终的光密度值产生影响。此外,不同生长状态的细胞和细胞密度可能对相同浓度的药物的敏感性不同,这还需要更多的研究来证实。
图1显示,24 h时7.5和15μg/ml浓度所对应的抑制率依次为(-3.89±0.94)%、(-4.44±2.15)%,即,该浓度药物对细胞抑制作用不明显。其可能的原因如下:药物作用时间太短,细胞因受到刺激产生某种方式的代偿,细胞代谢增强,线粒体活性增加,产生较多的蓝紫色结晶,使OD值增加,抑制率变为负值。但是随着药物作用时间的延长,最终使细胞活性受到抑制。
在联合用药时,β-榄香烯150μg/ml 24 h、48 h的抑制率依次为:(26.39±5.79)%,(54.44±2.00)%,高于图2中所示结果,这种误差可能来自于实验者操作上的差异,也可能来自不标准的仪器,也可能来自外环境非实验因素的不平衡等。我们已经多次重复,并且尽力消除这种误差。
在使用流式细胞仪检测凋亡时,通过AnnexinⅤ/PI双染色法来检测细胞凋亡。其原理是在细胞凋亡早期,磷脂腺丝氨酸(PS)从细胞膜内转移到细胞膜外,PS暴露在细胞膜外表面,AnnexinⅤ易于和PS结合,利用此特性,将AnnexinⅤ标记荧光来检测早期凋亡的细胞。本研究中最终只使用了195μl的细胞悬液,依然有大量的细胞未被使用,尽管细胞已经被混匀,但是这195μl的细胞悬液依然不能完全代表该组细胞的凋亡情况。此外,在本实验中,我们检测了加药后24 h细胞的凋亡情况,这仅仅只能反映出24 h的凋亡情况,药物导致细胞的具体凋亡过程我们依然不能确切的全部知晓。有研究报道,β-榄香烯除了会导致细胞凋亡之外,也有直接的细胞毒性作用。
联合用药时,其24 h CDI=0.65<1,即两药可协同抑制细胞增殖;48 h CDI=1.05>1,尽管其大于1,但是仅仅只高出0.05,我们还要考虑到标准误,所以我们不能认为此时两药是相互拮抗的。单从抑制率的角度讲,联合用药时,其抑制率确实高于单独用药。
本实验通过奈达铂和β-榄香烯联合使用,以体外培养的HeLa细胞为模型,通过MTT法、流式细胞术,发现奈达铂联合β-榄香烯可以协同促进HeLa细胞凋亡,下一步我们将进一步明确β-榄香烯联合奈达铂抑制HeLa细胞增殖及促凋亡的机制。
致谢:真诚感谢第四军医大学军事预防医学系放射医学教研室郭国祯主任,王晋副教授,感谢他们在实验平台、技术等多方面给予的指导和帮助。
[1]Su XY,Yin HT,Li SY,etal.Intervention effects of nedaplatin and cisplatin on proliferation and apoptosis of human tumour cells in vitro[J].Asian Pac J Cancer Prev,2012,13(9):4531-4536.
[2]马东礼,肖家祁,童善庆,等.榄香烯诱导HeLa细胞凋亡的实验研究[J].上海第二医科大学学报,2000,20(6):484-487.
[3]陈小军,顾立刚,李佩文,等.榄香烯乳对人宫颈癌Hela细胞转录因子ELK1及其靶基因的影响[J].中国中医药信息杂志,2008,15(1):26-27.
[4]陈光,丁晓飞,肖晋芳,等.榄香烯衍生物诱导HeLa细胞凋亡的实验研究[J].中国药理学通报,2007,23(2):246-250.
[5]佟富中,乔新民,刘宏军,等.榄香烯乳对化疗药物引起的骨髓抑制的改善和预防作用的临床比较观察[J].中国肿瘤临床,1999,26(7):50-51.
[6]程斌,王增,翁琳.奈达铂小剂量多次给药与大剂量单次给药的不良反应比较[J].中国临床药学杂志,2011,20(2):114-116.
[7]王子平,储大同,刘雨桃,等.榄香烯乳注射液耐受性试验Ⅰ期临床研究[J].中国新药杂志,2006,15(21):1867-1870.
[8]周洁晶,齐宇红,邵秋菊,等.宫颈癌术后腹壁切口种植转移1例报告及分析[J].山西医科大学学报,2013,44(8):669-670.
[9]Mao Y,Zhang J,Hou L,etal.The effect of beta-elemene on alpha-tubulin polymerization in human hepatoma HepG2 cells[J].Chin JCancer Res,2013,25(6):770-776.
[10]Yan B,Zhou Y,Feng S,etal.Beta-elemene-attenuated tumor angiogenesis by targeting notch-1 in gastric cancer stem-like cells[J].Evid Based Complement Alternat Med,2013,2013:268468.
[11]Zhang X,Li Y,Zhang Y,etal.Beta-elemene blocks epithelialmesenchymal transition in human breast cancer cell line MCF-7 through Smad3-9mediated down-regulation of nuclear transcription factors[J].PLoSOne,2013,8(3):e58719.
[12]Yamamoto G,Shimada T,Nishida T,etal.[Evaluation of a combination chemotherapy with nedaplatin and 5-FU for oral cancers][J].Gan To Kagaku Ryoho,2001,28(8):1111-1115.
[13]彭莉贞,罗琳,吴云燕.奈达铂治疗宫颈癌15例过敏反应分析[J].实用临床医学,2011,12(7):66-68.
[14]李建旺,李邦华.切除修复交叉互补基因1与铂类耐药的研究进展[J].江西医药,2009,44(6):625-628.
[15]李蕾,胡雪君.β-榄香烯通过抑制PI3K/Akt及Erk1/2信号转导通路诱导肺腺癌A549细胞凋亡并上调CbI-b,c-CbI蛋白表达[C].广州:第十二次全国呼吸病学学术会议,2011.
[16]张晔,曲秀娟,刘云鹏,等.β-榄香烯对人胃癌SGC7901/Adr细胞ERK通路的活化和GST-π表达的影响[J].世界华人消化杂志,2011,19(13):1394-1397.
[17]赵永顺,董斌,吴春明,等.榄香烯阻碍大鼠胶质瘤C6细胞ERK信号通路中Hsp90/Raf-1分子复合体的形成[J].实用药物与临床,2011,14(4):274-276.
[18]陈光,丁晓飞,肖晋芳,等.榄香烯衍生物诱导HeLa细胞凋亡的实验研究[J].中国药理学通报,2007,23(2):246-250.
