甘丙肽过表达转基因小鼠的制作和鉴定
2014-11-21陈喜英刘田福郭永昌
陈喜英,刘田福,郭永昌
(山西医科大学实验动物中心,太原 030001;*通讯作者,E-mail:13603528575@163.com)
甘丙肽(galanin,GAL)是由29个氨基酸组成的羧基末端酰胺化的肽类物质,由Tatemoto等于1983年首次从猪小肠中检测出来,广泛分布在外周和中枢神经系统中[1]。研究发现,它具有抑制葡萄糖介导的胰岛素释放,抑制脂肪组织中抵抗素基因的表达,促进食欲,抑制胃肠蠕动,提高垂体生长激素、促黄体生成激素、催乳素释放等功能,参与摄食、学习记忆、痛觉和神经性损伤、修复与退行性变等一系列生物活动[2-6]。
在正常的生理情况下,甘丙肽的表达量很低,而且大脑不同区域的甘丙肽与不同神经递质组成复杂的功能系统[7-9],但是由于研究技术受到限制,使得甘丙肽的生理病理功能的研究工作进展缓慢。到目前为止,甘丙肽的具体功能和作用机制仍不十分清楚,因此,有待于新的甘丙肽研究工具推进甘丙肽的研究步伐。本文以显微注射的方法建立了甘丙肽过表达转基因小鼠模型,为进一步研究GAL在神经系统的生物学功能奠定了基础。
1 材料与方法
1.1 实验动物
C57BL/6J小鼠,4-6周龄,40只;由山西医科大学实验动物中心提供,许可证号:SCXK(晋2009-0001)。明周期7:30-19:30,暗周期19:30-7:30,温度19-22℃。相对湿度:40%。自由进食进水。
1.2 主要试剂和仪器
质粒PUC18-PDGFβ-GAL(本实验室前期制备),质粒提取试剂盒(Qiagen公司);胶回收试剂盒(Qiagen公司);M2培养基,M16培养基,透明质酸酶,矿物油(Sigma公司);孕马血清(PMSG),人绒毛膜促性腺激素(HCG)(宁波激素制药厂);Taq酶、内切酶和鼠尾提取DNA试剂盒等(大连TAKARA公司);体视显微镜(Motic)、显微注射仪,毛细玻璃管、精细镊子(Dumont)等各种手术器械。
1.3 实验方法
1.3.1 转基因片段的制备 质粒提取(按质粒提取试剂盒进行),将所提取的质粒用XbaⅠ和Hin dⅢ进行双酶切,37℃水浴4 h,后用1%琼脂糖凝胶电泳分离鉴定。对目的条带进行胶回收(按QIA quick Gel Extraction Kit进行),把胶回收的DNA溶液移入针头式滤器中进行纯化,用TE缓冲液稀释成3 ng/μl备用。
1.3.2 转基因小鼠的制备
1.3.2.1 取胚 以4-6周龄性成熟雌鼠为胚胎供体,腹腔注射PMSG和HCG进行超数排卵,每只5 IU,后与种雄鼠合笼。次日,处死见栓小鼠,在解剖显微镜下将胚胎细胞捡出,置于覆盖有石蜡油的M16微滴中,于5%CO2,37℃培养箱暂时培养。
1.3.2.2 受精卵显微注射 显微注射于取胚当日13:00左右开始,把胚胎取出置于M2液滴中。将DNA溶液注射至雄性原核中,见到原核稍稍膨大即取针进行下一枚卵的注射。注射后的胚胎重新移回新的M2液滴中,准备移植。
1.3.2.3 胚胎移植 将形态良好的胚胎吸入移卵针细长端,尽量将胚胎排列紧密以减少培养液的吸入量。采用输卵管端口插入移植法,将含有胚胎的M2段吹入输卵管。做完手术后,把它放入温暖的环境中,苏醒后5 h禁饮食,之后加精饲料喂养,待产。
1.3.3 转基因小鼠的鉴定
1.3.3.1 PCR鉴定转基因小鼠 仔鼠出生后2周剪取约1 cm长鼠尾,按鼠尾提取DNA试剂盒抽提基因组。以此基因组为模板进行 PCR反应。在25 μl反应体系中分别加入:ddH2O 8.6 μl,引物1 上游引物0.8 μl,下游引物 0.8 μl,引物 2 上游引物0.4 μl,下游引物 0.4 μl,Premix Taq 12.5 μl,DNA 1.5 μl。
所用引物序列为:引物 1上游引物:5’-CCCACCTCTCGCACTCTCC-3’,下游引物:5’-TTCTCCTTTGCAGGCATCCCA-3’;引物2上游引物:5’-TCTTAGCTCTGCTCTCCGGT-3’,下游引物:5’-CACTGGCTGAGGAAGGAGAC-3’。转基因产物长度 397 bp,体内自身 GAL产物长度196 bp。反应条件:94℃ 3 min;94℃ 30 s,60℃ 35 s,72℃ 35 s,38个循环;72 ℃ 5 min。取5 μl PCR产物进行1%的琼脂糖凝胶电泳,凝胶图像分析系统分析结果。
1.3.3.2 Western-blot检测转基因小鼠GAL表达通过组织匀浆分别提取甘丙肽首建鼠PCR鉴定阳性转基因小鼠和同窝阴性对照小鼠的肝、脑组织蛋白,蛋白定量后,取100μg进行10%十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,将蛋白条带电转至PVDF膜上,5%脱脂奶封闭液中室温封闭1 h。加入新鲜一抗液(GAL一抗和GAPDH一抗稀释度均为1∶500),4℃孵育过夜,回收一抗,PBST液洗膜3次,每次5 min。加入新鲜配制的二抗液(GAL二抗稀释度为1∶3 000;GAPDH二抗稀释度为1∶5 000),室温孵育1 h,弃二抗,PBST液洗膜3次,每次5 min,经荧光化学发光成像仪曝光、显影。
2 结果
2.1 质粒PUC18-PDGFβ-GAL的双酶切鉴定
质粒经XbaⅠ和Hin dⅢ进行双酶切后,骨架大小约为2 700 bp,目的片段 PDGF-GAL大小在3 000 bp左右(图1)。测序结果与理论上的重组片段进行比对,相似性达到99%,并且在编码区没有出现碱基的突变。
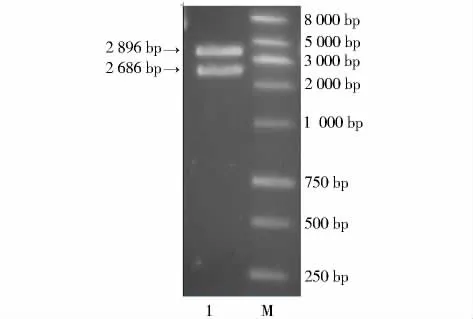
图1 重组质粒PDGFβ-GAL的双酶切电泳图Figure 1 Electrophoresis of enzyme digestion of recombinant plasmid PDGFβ-GAL
2.2 转基因小鼠的整合鉴定
小鼠出生14 d提取基因组DNA,用PCR扩增GAL目的基因397 bp的片段来鉴定GAL转基因小鼠基因表型(见图2),共得到8只首建鼠,5只雄鼠和3只雌鼠,其中7只已传代。

图2 GAL过表达转基因小鼠PCR鉴定图Figure 2 Identification of galanin-overexpression transgenic mice by PCR
2.3 GAL转基因小鼠的表达分析
为了验证外源性GAL在小鼠体内的蛋白表达水平,我们取4只PCR鉴定阳性的小鼠断髓处死后解剖,同时取1只阴性小鼠作对照分别取肝、脑组织,匀浆处理后部分Western blot检测GAL蛋白表达水平。F0代阳性小鼠GAL在脑组织中表达水平明显高于同窝阴性小鼠,而在肝组织中无明显差异(见图3)。

图3 Western blot检测脑、肝组织中GAL蛋白的表达Figure 3 Expression of GAL protein in brain and liver tissues by Western blot
3 讨论
转基因动物技术是功能基因组时代医学生物学研究不可或缺的遗传工程技术。自20世纪80年代初Palmiter等[10]开创了转基因动物研究的先河以来,转基因动物技术取得了很大进展。在现行的转基因动物制备技术中,显微注射法最经典、应用最广泛,并在多个物种均有成功报道的转基因动物制备技术。
甘丙肽是近年来倍受研究者关注的一个基因,其功能是通过GAL受体GALR1、GALR2和GALR3中的一个或多个介导的,由此研究者从甘丙肽与其不同受体的相互作用着手,深入研究其与各种疾病的联系。早期研究表明GAL参与促进神经系统神经元的生长,发育和再生,随着免疫组化、原位杂交技术的广泛应用,发现神经损伤、缺血、老年性痴呆(Alzheimer’s disease,AD)、抑郁症(depression)等病人GAL及其受体的表达都明显上调[11,12]。这些结果提示了GAL极有可能参与了神经损伤反应,神经再生或修复等事件[13,14]。甘丙肽作为脑内重要的神经肽之一,已被证明不但参与许多神经系统性疾病如癫痫等的重要功能活动,还具有抗肿瘤作用[15,16],在不同组织中甘丙肽的作用主要取决于其与GALR1-3中不同受体的作用,如在人垂体腺瘤中可同时检测到甘丙肽及其受体GALR1和GALR2基因的mRNA,但是GALR3 mRNA仅出现在接受手术治疗后又复发的病人的垂体腺瘤组织中,这项研究成果为垂体腺瘤病人的预后提供了重要依据[17],有研究者明确提出甘丙肽受体对伤害性直觉,癫痫等生理病理方面有重要调节作用[18,19],说明不仅甘丙肽蛋白,其甘丙肽受体在不同疾病发生发展中也起着举足轻重的作用。总而言之,甘丙肽及其相关蛋白在机体生理或病理状态下的作用是广泛而复杂的,至今仍成为国内外学者的研究热点。
但由于机体自身甘丙肽的表达量少,使得研究工作一直进展缓慢。基于之前的研究报道,我们以GAL为靶基因,成功构建了PDGFβ-GAL目的片段,通过显微注射技术成功建立了8只GAL过表达的的转基因小鼠,操作过程简单,无需特殊设备,而且注射卵的成活率高,很大程度上提高了转基因的效率。PCR技术能够方便、快捷的检测出转基因事件的发生,被广泛用于转基因动物的检测,但是当目的基因拷贝数较低时容易出现假阳性[20],而Southern杂交的方法对于转基因小鼠的PCR整合检测可以起到互补作用。构建转基因动物的关键在于外源性蛋白的表达以及产生的蛋白是否具有生物学活性,因此我们进一步通过Western blot的方法进行了外源性GAL蛋白表达的检测,研究结果显示转基因阳性小鼠较同窝阴性对照高表达外源性GAL。综上所述,通过显微注射的方法构建了GAL转基因小鼠,并能稳定传代,即GAL过表达转基因小鼠在转录和蛋白表达水平构建成功。
我们取PCR鉴定阳性F0及同窝阴性对照的脑、肝组织分别提取组织蛋白,进行Western blot检测,获得了脑组织特异性高表达的GAL转基因小鼠。这是因为甘丙肽主要分布在神经系统中,而我们构建目的片段时使用的启动子PDGFβ链是在神经组织特异性表达的[21,22],包括神经元、树突、部分轴突、脑的终端神经和脊索的背根和灵长类的垂体后叶[23],而且PDGFβ链启动子参与调控其下游基因在神经组织特异表达[24,25]。因此我们所制备的转基因小鼠同人类的表达情况是相吻合的,这可以对以后GAL参与的疾病的治疗预后研究中提供动物模型。
[1]Tatemoto K,R kaeus A,Jornvall H,etal.Galanin—a novel biologically active peptide from porcine intestine[J].FEBS Lett,1983,164(1):124-128.
[2]Jacobowitz DM,Kresse A ,Skofitsch G.Galanin in the brain:chemoarchitectonics and brain cartography a historical review[J].Peptides,2004,25:433-464.
[3]Sporn MB,Roberts AB.Autocrine growth factors and cancer[J].Nature,1985,313:745-747.
[4]Xu XJ,H kfelt T,Wiesenfeld-Hallin Z.Galanin and spinal pain mechanisms:where do we stand in 2008[J].Cell Mol Life Sci,2008,65(12):1813-1819.
[5]Langel U,Bartfai T.Chemistry and moleular biology of galaninreceptor ligands[J].Ann N Y Acad Sci,2004,863:86-93.
[6]Abramov U,Floren A,Eehevarria DJ,etal.Regulation of feeding by galanin[J].Neuropeptides,2004,38(1):55-61.
[7]王雪岷,周长满.甘丙肽和经典神经递质在大鼠和家兔背根神经节细胞内共存的免疫组织化学研究[J].解剖学报,1997,12(1):48-53.
[8]庞志平,李鑫.甘丙肽和经典激素在大鼠垂体前叶细胞内共存的研究—免疫组织化学方法[J].解剖学报,1995,19(4):67-71.
[9]Botella BA,Delvaux M,Bueno L,etal.Intracellar pathways triggered by galanin to induce contraction of pig ileum smooth muscle cells[J].J Physiol,1992,458:475-486.
[10]Palmiter RD,Brinster RL,Hammer RE.Dramatic growth of mice that develop from eggs microinjected with metallothionein-growth hormone fusion genes[J].Nature,1982,300(5893):611-615.
[11]Hwang IK,Yoo KY,Kim DS,etal.Expression and changes of galanin in neurons and microglia in the hippocampus after transient forebrain ischemia in gerbils[J].Brain Res,2004,1023(2):193-199.
[12]Vrontakis ME.Galanin:a biologically active peptide[J].Curr Drug Targets CNSNeurol Dis,2002,1(6):531-541.
[13]Shen PJ,Larm JA,Gundlach AL.Expression and plasticity of galanin systems in cortical neurons,oligodendrocyte progenitors and proliferative zones in normal brain and after spreading depression[J].Eur JNeurosci,2003,18(6):1362-1376.
[14]Shen PJ,Yuan CG,Ma J,etal.Galanin in neuro(glio)genesis:expression of galanin and receptors by progenitor cells in vivo and in vitro and effects of galanin on neurosphere proliferation[J].Neuropeptides,2005,39(3):201-205.
[15]Berger A,Santic R,Hauser Kronberger C,etal.Galanin and galanin receptors in human cancers[J].Neuropeptides,2005,39(4):353-359.
[16]Tofighi R,Joseph B,Xia S,etal.Galanin decreases proliferation of PC12 cells and induces apoptosis via its subtype 2 receptor(GalR2)[J].Proc Natl Acad Sci,2008,105(7):2717-2722.
[17]Tofighi R,Barde S,Palkovits M,etal.Galanin and its three receptors in human pituitaryadenoma[J].Neuropeptides Cell,2012,46(5):195-201.
[18]Lemons LL,Wiley RG.Galanin receptor-expressing dorsal horn neurons:Role in nociception[J].Neuropeptides,2011,45(6):377-383.
[19]Kapur J.Galanin receptors modulate seizures[J].Epilepsy Curr,2011,39(8):207-211.
[20]杨继山,潘庆杰,董晓.转基因动物检测方法的研究进展[J].中国农业科技导报,2010,12(3):45-49.
[21]Sasahara A,Kott JN,Sasahara M,etal.Platelet-derived growth factor B-chain-like immunoreactivity in the developing and adult rat brain[J].Brain Res Dev Brain Res Cell,1992,68(1):41-53.
[22]Sasahara M,Sato H,Iihara K,etal.Expression of platelet-derived growth factor B-chain in the mature rat brain and pituitary gland[J].Mol Brain Res,1995,32(1):63-74.
[23]杜静,全雄志,赵海平.脑组织特异表达胆囊收缩素转基因小鼠的建立[J].中国比较医学杂志,2008,17(11):629-631.
[24]Sasahara M,Fries JWU,Raines EW,etal.PDGF B-chain in neurons of the central nervous system,posterior pituitary,and in a transgenic model[J].Cell,1991,64(1):217-227.
[25]Games D,Adams D,Alessandrini R,etal.Alzheimer-type neuropathology in transgenic mice overexpressing V717F beta-amyloidprecursor protein[J].Nature,1995,373(65):523-527.
