miR-145抑制口腔鳞状细胞癌Tca-8113细胞增殖活性及其与CDK6的靶向关系
2014-11-21郭芳,黄硕
郭 芳,黄 硕
(西安医学院口腔医学系,西安 710021;*通讯作者,E-mail:guofang198419@163.com)
miRNA是一类内源性的具有调控功能的非编码RNA,其大小长约20-25个核苷酸。其不但可以直接发挥原癌基因或者抑癌基因的作用,而且可以通过降解靶mRNA或者抑制靶信使RNA(mRNA)的翻译调节其他癌基因或者抑癌基因的表达[1,2]。据报道,miRNA 在人类的各种生物过程均发挥重要作用,如新陈代谢、分化、细胞增殖和凋亡[3]。microRNA已被证实与癌症的发生和发展是密切相关的,其可能成为癌症诊断的新的生物学标记物[4]。
研究表明,miR-145 在调节干细胞分化[5,6]、多种恶性肿瘤(如结肠癌[7]、前列腺癌[8]、乳腺癌[9]、宫颈癌[10]等)的发生过程中发挥着重要作用。有关miR-145在口腔鳞状细胞癌中的研究报道尚少。本研究通过生物信息学预测miR-145的靶基因,构建pcDNATM6.2-GW-pre-miR-145重组表达质粒,通过双荧光素酶报告基因预测miR-145对下游靶基因CDK6表达的影响,以及对口腔鳞状细胞癌细胞增殖的影响。
1 材料与方法
1.1 材料
pcDNATM6.2-GW、pmirGLO真核载体、口腔鳞状细胞癌Tca-8113细胞株、E.coli DH5α均由西安交通大学医学部实验中心提供。
T4DNA连接酶、限制性内切酶(Hin dⅢ、Eco RⅠ、SacⅠ和 XhoⅠ)、SYBR Premix Ex TaqTMⅡ和逆转录试剂盒(PrimeScript3®RT)均购自Takara公司(大连),质粒抽提、凝胶回收试剂盒购自Qiagen公司,RNA抽提试剂Trizol转染试剂Lipofectamine2000购自美国vitrogen公司,RIPA、SDSPAGE凝胶配制试剂盒购自碧云天生物技术公司,PVDF膜、蛋白发光液购自Millipore公司,鼠抗人βactin购自Santa Cruz公司,兔抗人CDK6购自北京博奥森生物技术有限公司,双荧光素酶报告基因检测试剂盒购自Promega公司,其余试剂均为国产分析纯试剂。
1.2 方法
1.2.1 miR-145表达载体的构建与鉴定 从miRBase网站数据库中检索has-miR-145的pre-miR-145颈环序列,设计合成两端带有Hin dⅢ和Eco RⅠ酶切位点的互补双链DNA,序列交由生工生物工程(上海)股份有限公司合成,一条为 AAT TCCACCTTGTCCTCACGGTCCAGTTTTCCCAGGAATC CCTTAGATGCTAAGATGGGGATTCCTGGAAATACTG TTCTTGAGGTCATGGTTA,另一条为AGCTTAACCAT GACCTCAAGAACAGTATTTCCAGGAATCCCCATCTT AGCATCTAAGGGATTCCTGGGAAAACTGGACCGTGA GGACAAGGTGG。Hin dⅢ和Eco RⅠ双酶切质粒载体pcDNATM6.2-GW,用T4DNA连接酶连接线性化质粒载体与目的基因退火片段,转化感受态细菌E.coli DH5α,挑取单个克隆后采用含壮观霉素的LB培养基筛选扩增,12-16 h后提取质粒送生工生物工程(上海)股份有限公司对重组质粒pcDNATM6.2-GW-premiR-145进行测序鉴定。
1.2.2 实时荧光定量 PCR(qRT-PCR)验证 miR-145在Tca-8113细胞中的表达 将构建成功的重组质粒 pcDNATM6.2-GW-pre-miR-145转染 Tca-8113细胞,然后采用qRT-PCR检测成熟miR-145的表达水平。实验分组:miR-145组为转染重组质粒pcDNATM6.2-GW-pre-miR-145;control组为未作处理的Tca-8113细胞;miR-145的逆转录引物序列GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTG GATACGACAGGGATT,上游引物为:5’-CAGTGCGTGTCGTGGAGT-3’,下游引物为:5’-AGGTCCAGTTTTCCCAGG-3’,U6作为内参。使用SYBR Premix Ex TaqTMⅡ进行扩增,条件:95℃,1 min预变性,95℃变性10 s,60℃退火,延伸40 s,重复40个循环,采用2-ΔΔCt计算miR-145表达量。
1.2.3 MTT检测miR-145对Tca-8113细胞增殖的影响 Tca-8113细胞采用含10%胎牛血清的DMEM培养基,放置于37℃,5%CO2的恒温细胞培养箱中进行培养。96孔板每孔约3 000个细胞,采用Lipofectamine2000脂质体转染试剂按说明书进行转染。实验分组:miR-145组为转染pcDNATM 6.2-GW-pre-miR-145重组质粒;Neg-miR-145组为转染pcDNATM6.2-GW空质粒;各组设3个复孔,于转染后24 h、48 h、72 h后加入20μl,37℃孵育4 h后弃上清,加入150μl后于492 nm波长下检测Tca-8113细胞的吸光度值。
1.2.4 荧光素酶报告基因载体的构建与鉴定 采用targetscan(http://www.targetscan.org/)根据碱基互补配对原则选取miR-145的候选靶基因CDK6,分别于CCAATAATCCTTTGGAAACTGGATC及其互补链TCGAGATCCAGTTTCCAAAGGATTATTGGAGCT两侧添加SacⅠ和XhoⅠ双酶切位点,命名为野生型CDK6(WT-CDK6),同时在种子区设计突变型CDK6(MT-CDK6),碱基序列由公司加工合成,并采用Annealing Buffer退火为双链,并连接于pmirGLO真核表达载体上,转化与测序方法和miR-145相一致。
1.2.5 双荧光素酶报告基因检测miR-145对CDK6的靶向作用 收集对数期的Tca-8113细胞,铺于96孔板,每孔约4×103个细胞,设4组、每组设3个复孔,24 h后分别转染Neg-miR(pcDNATM6.2-GW空质粒)+WT-CDK6,Neg-miR+MT-CDK6,miR-145+WT-CDK6,miR-145+MT-CDK6。24h后,根据Promega公司双荧光素酶报告基因检测试剂盒说明书添加萤火虫和海肾荧光素酶试剂上机检测。
1.2.6 Western blot检测 miR-145 对 CDK6 蛋白表达的调控 实验分组同MTT,转染24 h后胰酶消化细胞后采用PBS洗2遍后收集Tca-8113细胞,采用RIPA裂解液按照操作说明提取蛋白,配置10%的SDS-PAGE凝胶,每孔20μg蛋白量上样、电泳,室温下5%脱脂牛奶封闭2 h,一抗(CDK6 1∶100;β-actin 1∶3 000)4 ℃孵育过夜,二抗室温下孵育1.5 h,TBST洗膜,化学发光观察蛋白的表达情况。
1.2.7 统计学分析 采用SPSS12.0软件进行统计学分析,组间比较采用t检验进行分析,P<0.05时认为差异具有统计学意义。
2 结果
2.1 成功构建miR-145表达载体
Hin dⅢ和Eco RⅠ双酶切质粒载体pcDNATM6.2-GW与退火成双链的pre-miR-145相连接后,将重组的miR-145真核表达载体进行测序,结果表明重组的pcDNATM6.2-GW-pre-miR-145真核表达载体无碱基序列的突变与丢失。采用qRT-PCR检测miR-145在miR-145组与control组中的表达,结果显示miR-145组中miR-145的表达显著高于内源性表达量(P<0.001,见图1)。
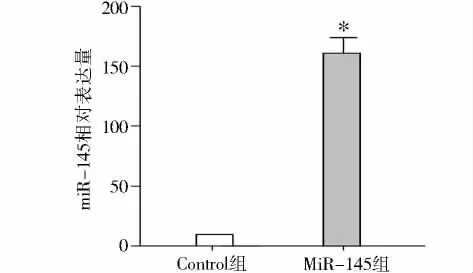
图1 qRT-PCR检测miR-145在miR-145组与control组中的表达Figure 1 The expression of miR-145 in miR-145 group and control group using qRT-PCR
2.2 miR-145能够抑制Tca-8113细胞的增殖
将 pcDNATM6.2-GW-pre-miR-145 和 pcDNATM 6.2-GW空载体分别转染口腔鳞状细胞癌Tca-8113细胞;如图2所示,转染miR-145的 Tca-8113细胞的增殖活性明显低于空载体组(P<0.01),表明miR-145能够明显抑制口腔鳞状细胞癌Tca-8113细胞的增殖。
2.3 miR-145能够靶向下调CDK6的表达
通过Targetscan预测miR-145与CDK6间存在良好的碱基互补配对,在此基础上成功构建CDK6野生型(WT-CDK6)及突变型(MT-CDK6)真核表达载体(图3),与miR-145和Neg-miR共转染Tca-8113细胞。双荧光素酶报告基因检测显示共同转染miR-145+WT-CDK6后,荧光素酶活性表达明显受到抑制,而转染 Neg-miR+WT-CDK6,Neg-miR+MT-CDK6,miR-145+MT-CDK6组的荧光素酶活性无明显变化。结果表明,miR-145与CDK6之间存在良好的靶向关系(P=0.002,见图4)。
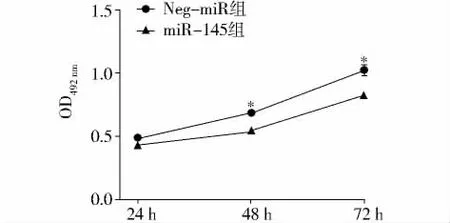
图2 MTT法检测Neg-miR组与miR-145组的细胞增殖情况Figure 2 Cell proliferation in Neg-miR group and miR-145 group by MTT
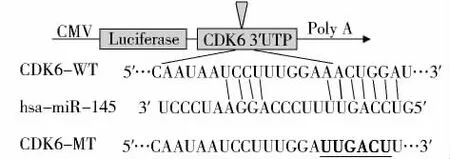
图3 Targetscan预测miR-145与CDK6碱基互补情况及突变位点Figure 3 Predicted miR-145 and CDK6 complementary base and mutations in Targetscan
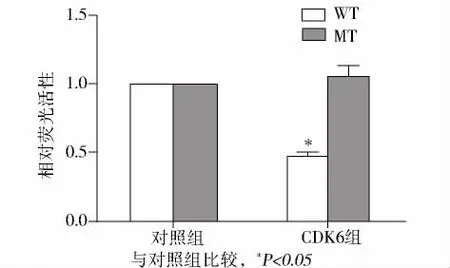
图4 双荧光素酶报告基因分析结果Figure 4 Dual-Luciferase reporter assay results
2.4 miR-145能够抑制内源性CDK6蛋白的表达
Western blot检测结果显示,转染 pcDNATM 6.2-GW-pre-miR-145的Tca-8113细胞其下游CDK6的蛋白表达水平显著低于转染pcDNATM 6.2-GW空载体的 Tca-8113细胞,表明miR-145能够抑制Tca-8113细胞中CDK6的蛋白表达水平(见图5)。
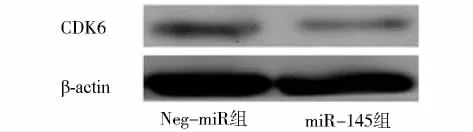
图5 Western blot检测miR-145对CDK6蛋白表达的调控Figure 5 The regulation of miR-145 to CDK6 protein expression by Western blot
3 讨论
2003年世界口腔健康统计数据显示口腔鳞状细胞癌占口腔恶性肿瘤的90%以上,口腔鳞状细胞癌的发病率在26种主要恶性癌症中位居第八位,尽管随着手术技术和基础研究的进步,包括手术为主,放疗和化疗在内的综合治疗,使其5年死亡率已经明显下降,但是仍然是癌症死亡的主要疾病之一。因此,寻找新的生物标志物和探索新的治疗靶点,对口腔鳞状细胞癌的诊断和治疗具有重要意义。
近年来,microRNA是一个研究热点,其广泛存在于生物体内,是一类长度在19-25 bp、高度保守的非编码小RNA,是具有茎环状结构的单链RNA分子。miRNA以序列特异性的方式调节基因表达,在动植物发育、细胞凋亡、代谢以及疾病发生等方面都起着重要作用,从而受到广泛关注。生物信息学研究发现microRNA只有人类基因总数的2%,却调节着人类全基因组中30%以上的基因表达[11],因此,其可以成为一个比较稳定的抗癌靶点。
Kozaki等[12]检测了 148 个 miRNAs在 18 个口腔鳞状细胞癌细胞系中的表达,结果发现其中有54个miRNAs表达下调,11个miRNAs表达上调。原癌基因miRNAs常在肿瘤组织中的表达上调,促进肿瘤的发生和发展;相反,抑癌基因miRNAs常表达下调,减少或消除对肿瘤发展的抑制作用。miR-145定位于染色体5q32-33,被发现在多种肿瘤中低表达,如直肠癌、膀胱癌、乳腺癌、前列腺癌、肺癌、胃癌、食管癌、鼻咽癌、卵巢癌、骨肉瘤、宫颈癌、胰腺癌、尤文氏肉瘤等,且通过作用于多个靶基因来抑制细胞增殖、促进细胞凋亡,发挥类似于抑癌基因的作用。如Chiyomaru等[13]研究发现在膀胱癌中miR-145可以作为抑癌基因下调FSCN1的mRNA和蛋白表达。Wang等[14]发现在乳腺癌MCF-7细胞中过表达的miR-145可以抑制RTKN蛋白表达以及其mRNA水平,并且miR-145过表达质粒可以抑制MCF-7细胞生长并诱导其凋亡。miR-145能抑制前列腺癌PC-3细胞的增殖,促进其凋亡,促使细胞周期阻滞并抑制其侵袭转移,起到抑癌基因的作用。但是miR-145在口腔鳞状细胞癌中的相关研究目前报道较少。
为了研究miR-145在口腔鳞状细胞癌发生发展的作用机制,本研究通过构建miR-145真核表达载体,将构建成功的表达载体转染Tca-8113细胞系,并采用荧光实时定量PCR检测miR-145的含量,结果显示miR-145组中miR-145的表达显著高于未作处理的Tca-8113组。为了进一步研究miR-145的过表达对Tca-8113细胞增殖活性的影响,我们采用MTT法进行了检测,将 pcDNATM6.2-GW-pre-miR-145和pcDNATM6.2-GW空载体分别转染口腔鳞状细胞癌 Tca-8113,结果发现转染 miR-145的 Tca-8113细胞的增殖活性明显低于空载体组(P<0.01),表明miR-145能够抑制口腔鳞状细胞癌Tca-8113细胞的增殖。
我们对miR-145抑制Tca-8113细胞增殖的机制进行了初步探讨,生物信息学软件是预测miRNAs靶基因的重要方法之一。目前被证实的miRNA靶基因均是以生物信息学的预测为基础的。首先,通过生物信息学的方法预测miR-145可能作用的靶基因,结果发现,CDK6可能是miR-145的候选靶基因。为了对其进行验证,本研究采用双荧光素酶报告基因系统进行验证,结果表明共同转染miR-145和WT-CDK6后,荧光素酶活性表达明显受到抑制,说明miR-145能够对Tca-8113细胞中的CDK6基因起到抑制性的调控作用。Western blot结果表明miR-145能够抑制Tca-8113细胞中CDK6的蛋白表达水平,进一步验证了二者之间的靶向关系。
综上所述,在口腔鳞状细胞癌中,miR-145的过表达可以显著抑制Tca-8113细胞的增殖活性,同时可以靶向CDK6引起其蛋白表达水平的下调,而CDK6作为一个周期蛋白,又与细胞的增殖密切相关,因此,本研究初步推测miR-145可能通过靶向CDK6引起口腔鳞状细胞癌Tca-8113细胞的增殖活性,这也为我们后期进一步的机制研究奠定了一定的理论基础。
[1]Ambros V.The functions of animal microRNAs[J].Nature,2004,431:350-355.
[2]Lagos-Quintana M,Rauhut R,Lendeckel W,etal.Identification of novel genes coding for small expressed RNAs[J].Science,2001,294(5543):853-858.
[3]Huang Y,Shen XJ,Zou Q,etal.Biological functions of microRNAs[J].Russ J Bioorg Chem,2010,36(6):684-689.
[4]Grady WM,Tewari M.The next thing in prognostic molecular markers:microRNA signatures of cancer[J].Gut,2010,59(6):706-708.
[5]贾勇圣.Oct4对肿瘤干细胞成瘤能力和多向分化潜能的影响[D].北京:北京协和医学院,2011.
[6]杨波.MicroRNA-145在间充质干细胞成软骨分化中的作用及机制研究[D].重庆:第三军医大学,2011.
[7]龚文容,卢晓明,陈志松,等.miR-145在结直肠癌组织的表达及临床意义[J].中华实验外科杂志,2011,28(1):35-36.
[8]梁铸林.hsa-miR-145对前列腺癌PC-3细胞系的作用[D].武汉:华中科技大学,2011.
[9]张晴,吴正升,张瑰红,等.miR-145在乳腺癌中表达及意义[J].临床与实验病理学杂志,2009,25(1):9-11.
[10]师婕,张林燕.宫颈鳞癌患者组织中 miR-145的表达及意义[J].疑难病杂志,2013,12(5):359-361.
[11]Carninci P,Kasukawa T,Katayama S,etal.The transcriptional landscape of the mammalian genome[J].Science,2005,309(5740):1559-1563.
[12]Kozaki K,Imoto I,Moqi S,etal.Exploration of tumor-suppressive microRNAs silenced by DNA hypermethylation in oral cancer[J].Cancer Res,2008,68(7):2094-2105.
[13]Chiyomaru T,Enokida H,Tatarano S,etal.miR-145 and miR-133a function as tumour suppressors and directly regulate FSCN1 expression in bladder cancer[J].Br J Cancer,2010,102(5):883-891.
[14]Wang S,Bian C,Yang Z,etal.miR-145 inhibits breast cancer cell growth through RTKN[J].Int JOncol,2009,34(5):1461-1466.
