UPLC-MS/MS法与分光光度法测定乳及乳制品中左旋肉碱的比较*
2014-11-20单艺王象欣赵秋莲陈美君梁杰姜毓君
单艺,王象欣,赵秋莲,陈美君,梁杰,姜毓君
(东北农业大学黑龙江省乳品工业技术开发中心,黑龙江哈尔滨,150028)
肉碱(L-carnitine)是一种人体中天然存在的类维生素营养物质。其主要功能是转运脂肪进入线粒体,促进脂肪酸燃烧,为机体提供能量[1-2]。肉碱有 L型、D型和DL型3种光学旋光体,其中只有L-肉碱具有生理活性,D-肉碱为合成物质,不存在于生物系统中,而D-肉碱和DL-肉碱则会竞争性地抑制肉碱乙酰转移酶(CAT)和肉碱脂肪酰转移酶(PTC)的活性,阻碍细胞的脂肪代谢。因此国内外只允许左旋肉碱(L-carnitine)作为食用肉碱添加到食物中。正常机体的L-肉碱来源有2种:一种通过肝脏和肾脏进行内源性合成,二是从膳食主要是动物性食品中摄取[3]。L-肉碱缺乏将干扰脂肪酸的代谢而导致能量合成不足,出现易疲劳,肌肉无力,心慌等症状,严重者会出现代谢紊乱,昏迷甚至死亡。随着人们对L-肉碱营养价值的关注及认可,它已经被越来越多的用于减肥食品,婴幼儿食品,饮料,营养补充剂,临床等方面[4]。因为婴幼儿不能通过其不成熟的合成系统合成L-肉碱,所以L-肉碱对婴幼儿来说是一种重要的营养物质[5]。国家标准 GB 10765-2010《食品安全国家标准婴儿配方食品》规定,L-肉碱为可选择性加入成分,规定最小添加量为0.3 mg/100kJ。
婴儿配方食品中的L-肉碱含量测定尚没有国标方法,文献报道有高效液相色谱法[6-8]、离子色谱法[9-10]、质谱法[11-12]、酶显色法[13-15]等。由于肉碱的极性大、没有生色团等特点,一般的检测手段都需借助于衍生反应,这样就使分析方法变得复杂,而且检出限较高,并且不适合具有复杂基质的食品中肉碱的分析。
本文针对乳制品这一复杂基质,开发了超高压液相色谱─质谱联用法与分光光度法,在已有的标准与文献基础上,优化了提取方法,并对2种方法进行了比较。结果表明2种方法检测数据差异不显著,但超高压液相色谱-质谱联用法前处理简单、分析速度快、灵敏度高,适用于实验室常规大批量的集中检测。
1 仪器与试剂
1.1 仪器与设备
美国Waters ACQUITY超高压液相色谱仪;Waters Xevo TQ质谱仪;Waters MassLynxTM色谱工作站;QGC-12T干热式氮吹仪(上海泉岛科贸有限公司);BS210S型电子天平(北京赛多利斯天平有限公司);超纯水仪(美国 MILLIPORE);固相萃取装置(美国Mediwax);5430/5430R离心机(德国 Eppendorf);PB-10/C酸度计(赛多利斯);B-260恒温水浴锅(上海亚荣);T6新悦型可见分光光度计(北京普析通用仪器有限责任公司);超声波清洗器(上海安普科学仪器有限公司);磁力搅拌器(上海安普科学仪器有限公司)。
1.2 材料与试剂
HClO4,70%,Sigma-Aldrich;HCl,37%,Sigma-Aldrich;NaOH,98%,Sigma-Aldrich;KOH ,86%,Sigma-Aldrich;2-硝基苯甲酸(2-Nitrobenzoic acid,94%,Vetec);N-(2-羟乙基)哌嗪-N'-(2-乙磺酸)(HEPES,99.5%,Sigma);乙二胺四乙酸二钠(EDTA-Na2,99.0%,Sigma);乙酰辅酶 A三锂盐(acetyl-CoA,93%,Sigma);肉碱乙酰转移酶(EC:2.3.1.7,70 units/mg,Sigma);甲 醇 (MeOH,99%,Burdick&Jackson);七氟丁酸(HFBA,99%,Sigma-Aldrich);L-肉碱内盐[(CH3)3N+CH2CH(OH)CH2COO-,USP标准品,Fluka];L-肉毒碱-(甲基-d3)盐酸盐(13CD3(CH3)2N+CH2CH(OH)CH2CO2H Cl-,99 atom%13C,98 atom%D,97%(CP),Aldrich)。
1.3 试剂与标样的配制
1.3.1 HClO4溶液(13%)
13 mL高氯酸稀释至100 mL。
1.3.2 NaOH溶液(10 mol/L)
称取40 g NaOH用水溶解,冷却后稀释至100 mL。
1.3.3 KOH溶液(4.0 mol/L)
称取22.4 g KOH用水溶解,冷却后定容至100 mL。
1.3.4 显色储备液
分别称取50 mg 2-硝基苯甲酸、5.96 gN-(2-羟乙基)哌嗪-N'-(2-乙磺酸)、185 mg乙二胺四乙酸二钠溶于30 mL去离子水中,用10 mol/L NaOH溶液调pH值至7.4~7.6,然后用水定容至50 mL。此液置于4℃冰箱中可保存3个月。
1.3.5 显色工作液
吸取5.0 mL显色储备液用水定容至25 mL。
1.3.6 乙酰辅酶A(acetyl-CoA)溶液
称取20.0 mg乙酰辅酶A溶于2.0 mL水中。临用时配制。
1.3.7 乙酰肉碱转移酶溶液
吸取100 μL乙酰肉碱转移酶悬浮液,经1 500 r/min离心10 min,弃去上层清液,沉淀用2 mL水溶解。临用时配制。
1.3.8 KOH溶液(2.0 mol/L)
称取56.1 g KOH用水溶解,冷却后用水定容至500 mL。
1.3.9 HCl溶液(1.6 mol/L)
吸取67.5 mL HCl于500 mL容量瓶中,定容摇匀。
1.3.10 内标溶液的配制(30 μg/mL)
快速称取(因其吸湿性)L-肉毒碱-(甲基-d3)盐酸盐7.5 mg于50 mL烧杯中,用去离子水转移到250 mL容量瓶中,定容,摇匀。配制好的溶液于-20℃冰箱中可保存1年。
1.3.11 L-肉碱标准储备液的配制(50 μg/mL)
准确称取0.075 g(精确至0.000 1 g)L-肉碱标准品于500 mL容量瓶中,用超纯水溶解后定容。
1.3.12 L-肉碱标准中间液的配制(0.15 μg/mL)
取1 mLL-肉碱标准储备液(1.3.11)于1 000 mL容量瓶中,用超纯水溶解后定容。
2 样品测定方法
2.1 分光光度法分析步骤
2.1.1 试样处理
(1)准确称取5 g(精确到0.000 1 g)混合均匀的固体样品于烧杯中,用30 mL 40℃温水溶解,转入100 mL容量瓶中。(2)准确称取 30 g(精确到0.000 1 g)混合均匀的液体样品100 mL容量瓶中。
将上述样品加入10 mL 13%HClO4溶液,混合均匀后静止20 min。用蒸馏水定容至刻度,混匀,用定量滤纸过滤。取滤液20 mL,用4 mol/L KOH溶液调pH值为12.5~13.0后,40℃水浴60 min。冷却后用13%HClO4调pH值为7.0~7.5。将样液转入50 mL容量瓶中,用蒸馏水定容。混匀后置于4℃冰箱中12 h。将试样处理液从冰箱中取出放置至室温,取上清液用0.45 μm滤膜过滤后备用。
2.1.2 标准曲线的绘制
吸取左旋肉碱标准工作液2.0 mL于1 cm比色皿中,加入0.8 mL显色工作液(1.3.5)和100 μL乙酰辅酶A溶液(1.3.6),盖上比色皿盖,混合均匀后放入分光光度计中,分光光度计的波长调为412 nm,反应5 min后归零。迅速加入100 μL乙酰肉碱转移酶溶液(1.3.7),混合均匀后放入分光光度计中,反应10 min后记录吸光值。以左旋肉碱标准工作液的浓度为横坐标,以吸光值为纵坐标,制作标准曲线。
2.2 UPLC-MS/MS法分析步骤
2.2.1 试样处理
准确称取12 g(精确到0.000 1 g)混合均匀的样品于150 mL三角瓶中,加入3 mL 2 mol/L的KOH溶液,再加入44 mL超纯水,混匀。用封口膜封住瓶口并把其置于水浴锅中于(50±2)℃条件下水浴30 min。取出后冷却至室温。再加入3 mL 1.6 mol/L的HCL溶液,然后用去离子水转移至100 mL容量瓶中,定容,混匀。根据被测样品中L-肉碱的大概含量,吸取15 mL上述处理液于500 mL容量瓶中(根据样品中L-肉碱的含量可吸取上述处理溶液0.3~15 mL于500 mL容量瓶中,使其L-肉碱的浓度定容后在20-40 ng/mL之间),加入250 μL的内标溶液(1.3.10),用超纯水定容至刻度。然后用0.22 μm PTFE膜过滤,上机。
2.2.2 仪器分析条件
色谱柱:WatersSymmetry C8柱(3.5 μm,2.1 mm×30 mm);
流动相:A,0.1%HFBA的水溶液,吸取0.5 mL HFBA于500 mL容量瓶中,用超纯水定容,混匀;
B,0.1%HFBA的甲醇溶液,吸取0.5 mL HFBA于500 mL容量瓶中,用甲醇定容,混匀。
质谱操作参数见表1;梯度洗脱条件详见表2;L-肉碱质谱检测条件见表3。

表1 质谱操作参数Table 1 UPLC-MS/MS operating conditions
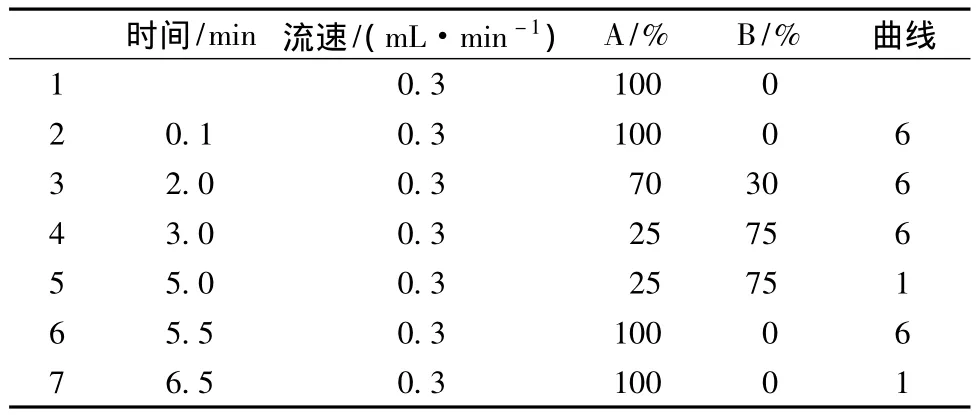
表2 UPLC-MS/MS梯度洗脱条件Table 2 The lineargradientcondition of UPLC-MS/MS
2.3 试样测定
取2.0 mL试样处理液按2.2.2的步骤测定其吸光值,在标准曲线上查得试样待测液的浓度。

表3 L-肉碱质谱检测条件Table 3 MS determine conditions ofL-Carnitine
3 结果与讨论
3.1 酶的专一性
分光光度法是由Marquis等[16]于1964年首次建立的,经进一步完善成为现在的方法。该方法是以乙酰转移酶为催化剂,生成乙酰-L-肉碱后再与显色剂进行反应生成黄色物质,以此定量。其反应机理如下:

辅酶 A+5,5-二硫代双-2-硝基苯甲酸→5-硫-2-硝基苯甲酸根(黄色)+CoA-S-NB+H+
L-肉碱有2种光学异构体,即左旋肉碱(L-型)和右旋肉碱(D型)。但只有L-型具有生命活性,具有一定的生理功能。通过用左旋肉碱(L-carnitine)和右旋肉碱(D-carnitine)的标准品配制相同浓度的标准溶液,使用上述分光光度法测定其412nm处吸光值,结果显示右旋肉碱本身无论浓度多少经与酶反应,紫外412nm处均没有紫外吸收。通过实验证明,乙酰辅酶A和乙酰肉碱转移酶具有高度专一性,只作用于左旋肉碱,对右旋肉碱有没有作用。
3.2 前处理的选择
采用分光光度法测定样品,其样品处理的研究开始主要针对游离态L-肉碱。根据有关资料,采用高氯酸沉淀蛋白质后,滤液用氢氧化钠调节pH至中性进行测定。此种方式处理的样品测定的是游离态的L-肉碱。之后根据国外查找的资料,认为L-肉碱在婴幼儿配方乳粉中约有30%为结合态[17],并且其生理作用与游离态等同,所以要改进样品处理。根据样品的特点及L-肉碱的性质,对样品处理技术重新进行实验研究。经多次实验后,确定样品前处理方法为,用高氯酸沉淀蛋白质后,吸取一定量的滤液用KOH皂化,使结合态L-肉碱变成游离态,然后再用HClO4调pH至中性,效果较好。
由于UPLC-MS/MS仪器的高灵敏度,必须使样品稀释500倍以上,使处理液中L-肉碱的含量在仪器的最佳线性范围内。稀释还可以是样品基质潜在的干扰减小,使仪器的信噪比降低。同时,反相色谱和多反应监测(MRM)的高选择性使得样品在进样前不需要通常的固相萃取净化,这可以从样品按照前述方法处理后在MRM色谱条件下只有单一峰(详见图1)得到验证。当然为了测得肉碱的总量,需要皂化使样品中天然的乙酰肉碱转化为游离肉碱。
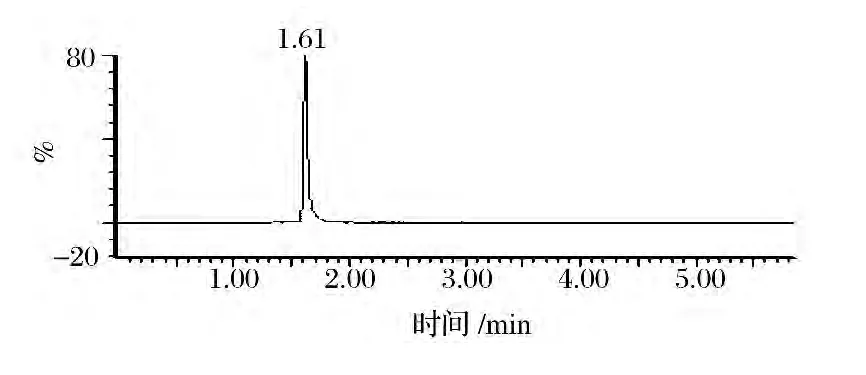
图1 L-肉碱标准品的多反应检测色谱图Fig.1 MRM chromatograms of L-carnitein standards
3.3 色谱条件的选择
L-肉碱是一种小分子强极性化合物,所以用传统的反相色谱柱很难得到满意的分析结果。先前的研究都是通过衍生化反应来减小L-肉碱的极性,使其带有生色团的同时更适合于在反相条件的保留。本实验不需衍生,在流动相中加入挥发性酸——七氟丁酸(HFBA),通过HFBA与L-肉碱的离子对作用,L-肉碱上氮原子所带的正电荷被掩蔽,从而减小了L-肉碱的极性。采用弱极性C8色谱柱,通过在流动相中加入0.1%HFBA,使L-肉碱与内标L-肉碱-d3均得到了很好的分离。
3.4 质谱条件的选择
L-肉碱标准品在MRM反相色谱条件下出峰时间为1.61(图1)。2 min以后的柱后流出液建议切换到废液管路,避免因离子源被污染而导致信号抑制、信噪比减小。内标化合物L-carnitine-d3的出峰时间与L-肉碱相同(详见图2)。L-肉碱分子结构中含有季胺碱性基团,适合用电喷雾离子源,正离子检测方式,L-肉碱和内标化合物L-carnitine-d3的准分子离子[M+H]+质核比m/z分别为162和165。二级质谱显示信号最强烈的碎片离子质核比m/z为60,85和103。机理为L-肉碱先发生C—N键的断裂,产生质核比m/z分别为60和103的2个离子碎片分别为+NH(CH3)3和+CH2—CH(OH)—CH2—COOH。碎片离子m/z 103再脱去一分子H2O,生成碎片离子m/z 85,其结构为+CH2—CHCH—COOH。内标化合物L-carnitine-d3与L-肉碱机理相同。最终由于m/z 85和103的信号最强烈的,分别作为定性离子和定量离子。样品L-肉碱的信号值由于基质影响被抑制大约20~30%,通过内标可以被校正。

图2 L-肉碱-d3标准品的多反应检测色谱图Fig.2 MRM chromatograms of L-carnitine-d3
3.5 方法验证
3.5.1 分光光度法的线性范围和检出限
准确称取0.020 g(精确至0.000 1 g)L-肉碱标准品,用水定容至250 mL容量瓶中。左旋肉碱标准工作液:分别吸取左旋肉碱标准储备液0.5、1、2、3、5 mL于25 mL容量瓶中,用水定容至刻度,混匀。该方法的标准曲线、回归方程以及回归方程相关系数见表4,由此可见在0~16.072 μg/mL内符合比尔定律。根据GB/T5009.1-2003中A2.2吸光法和荧光法的计算方法,确认该方法的检出限为2.0 mg/100 g。

表4 分光光度法测定L-肉碱的标准曲线及吸光值回归方程与相关系数Table 4 The standard curve,regression equation,correlation coefficient of L-carnitinebyspectrophotometry
3.5.2 超高压液相色谱-质谱联用法(UPLC-MS/MS)线性范围和检出限
分别吸取 L-肉碱标准中间液(1.3.12)0.25、0.5、1、2、4 mL 于10 mL 容量瓶中,再加入5 μL 的内标溶液(1.3.10),用水定容至刻度,混匀。
使用Masslynx软件中Targetlynx进行数据处理,UPLC-MS/MS法L-肉碱的标准曲线,回归方程以及回归方程相关系数见表5,由此可见在0~60 ng/mL内线性良好。进空白样,以基线3倍噪声值在标准曲线查得结果计算,该方法的检出限为2 ng/100 g。UPLC-MS/MS法的检出限比分光光度法低100万倍,线性范围低260倍。

表5 UPLC-MS/MS法L-肉碱标准曲线及吸光值回归方程与相关系数Table 5 The standard curve,regression equation,correlation coefficient of L-carnitinebyUPLC-MS/MS
3.5.3 分光光度法与UPLC-MS/MS法回收率和精密度的计算
在液态奶、奶粉基质中添加L-肉碱浓度分别添加3种浓度的标准物质。采用2种方法分别进行测定,对其回收率和精密度进行比较。
2种方法样品加标回收率见表6。由此可见2种方法回收率很好。根据JJF 1059.1-2012《测量不确定度评定与表示》,精密度为在规定条件下,对同一或类似被测对象重复测量所得示值或测得值间的一致程度。按照试验方法,取一份样品重复测定6次,所得结果,分光光度法的回收率在96.2%~104.7%,相对标准偏差 RSD在1.34%~3.69%。UPLC-MS/MS法的回收率在97.8%~109%之间,相对标准偏差RSD为1.77%~5.65%。

表6 两种方法的回收率与精密度(n=6)Table 6 Recoveries and precisions of the two methods(n=6)
3.5.4 L-肉碱溶液稳定性
L-肉碱溶液的长期稳定性经过研究已经证明,在-20℃条件下保存1年没有衰减。内标化合物L-carnitine-d3的长期稳定性没有在本次试验中被证实。但是由于L-carnitine-d3与L-肉碱相似的化学结构,唯一的不同就是L-肉碱与L-carnitine-d3的惰性基团+NH(CH3)3和13CD3(CH3)2N+的不同,因此可以推断出L-肉碱与L-carnitine-d3在-20℃条件下有相同的稳定性。样品处理溶液的短期稳定性见表7,由此可以得出结论样品处理溶液在室温放置两天,其中的L-肉碱不会衰减。
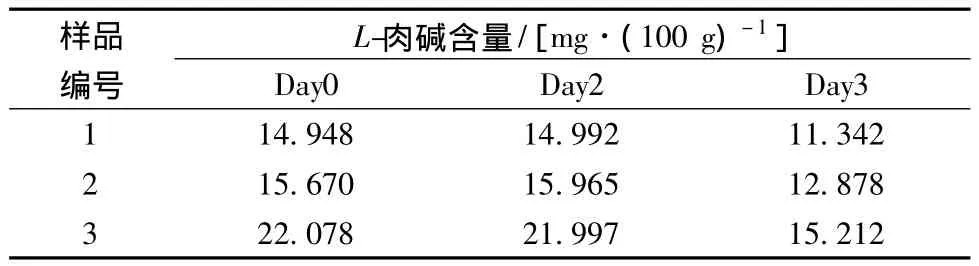
表7 L-肉碱短期稳定性的评估Table 7 Evaluation of short-term L-carnitine stability
3.6 分光光度法与UPLC-MS/MS法测定L-肉碱数据的对比
在市场上购买3种不同品牌的婴幼儿配方奶粉,分别用分光光度法以及UPLC-MS/MS法测定样品中L-肉碱的含量,3种品牌样品,连续测定3 d,每天每个样品做2个平行,结果见表8。
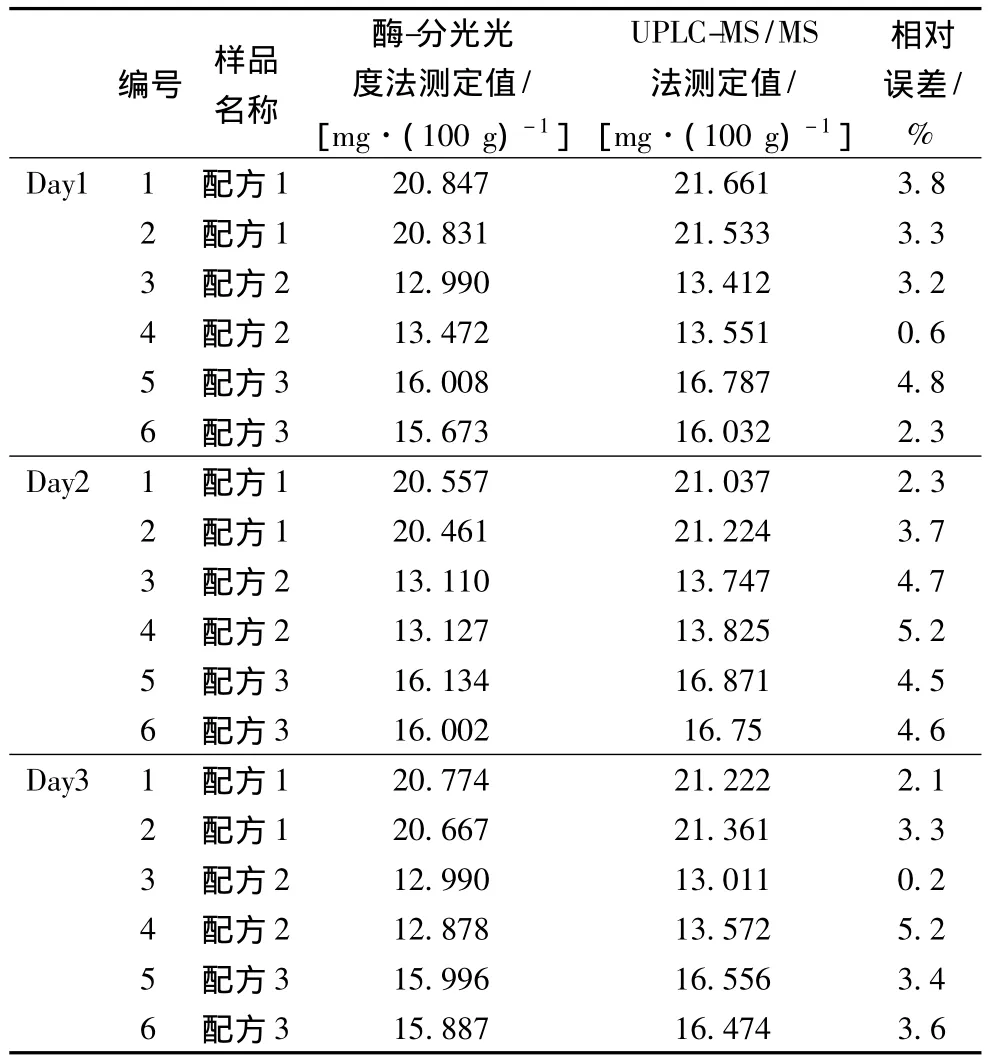
表8 分光光度法与UPLC-MS/MS法测定L-肉碱数据的对比Table 8 The comparison of UPLC-MS/MS
2种测定方法的相对误差在0.2%~5.2%,可以分析出2种方法差异性不大。但UPLC-MS/MS法的测定结果略高于分光光度法,分析其原因或为分光光度法其核心为酶反应和显色反应,众所周知化学反应的效率并非100%,但UPLC-MS/MS法不涉及到化学反应,只是单纯的色谱分离质谱检测,所以分光光度法的结果略低于UPLC-MS/MS法。
4 结论
本研究建立了2种测定乳及乳制品中左旋肉碱的方法,即分光光度法和UPLC-MS/MS法。分光光度法是间接测定L-肉碱的方法,UPLC-MS/MS法是直接测定L-肉碱的方法。2种方法的检出限分别为2.0 mg/100 g,2 ng/100 g。UPLC-MS/MS 的检出限低于分光光度法。分光光度法的回收率在96.2%~104.7%之间,相对标准偏差 RSD在1.34%~3.69%。UPLC-MS/MS法的回收率在97.8%~109%之间,相对标准偏差RSD为1.77%~5.65%。两种方法的稳定性强、重现性好,均适用于乳及乳制品中L-肉碱的测定。
分光光度法是检测L-肉碱的传统方法,分光光度计价格便宜,便于普及,而且此法对L-肉碱有高度的专一性。但是其检出限远远高于UPLC-MS/MS法,而且,在酶反应过程中,样品制备复杂,操作时间长,可控性差,不适合大量样品的快速检测。
UPLC-MS/MS法测定乳及乳制品中L-肉碱,其样品制备相对直接快速,仪器分析速度快,并且是直接测定L-肉碱的方法,可控性强,适用于大量样品的快速检测,但是仪器设备价格昂贵。此外,本研究对市售乳制品进行检测,比较了UPLC-MS/MS法和分光光度法的数据,得出两者检测数据差异不显著。
随着今后技术的发展,液质联用仪已经不仅仅局限于痕量物质的定性和定量分析,目前也应用于常量物质的测定中。此外,由于UPLC-MS/MS具有高效、快速、高通量等特点,更加适用于多种物质的同时测定,大大提高检测效率、降低检测成本。
[1]Vaz F M,Wanders R J.Carnitine biosynthesis inmammals.Biochemistry Journal,361,361(1):417 -429.
[2]Lahjouji K,Mitchell G A,Qureshi I A.Carnitinetransport by organic cation transporters and systemic carnitinedeficiency[J].Molecular Genetics and Metabolism,2001,73(4):287-297.
[3]Goudriaan J R,Den Boer M A,Rensen P C,et al.CD 36 deficiencyin mice impairs lipoprotein lipase-mediated triglyceride clearance[J].Journal of Lipid Research,2005,46(6):2 175-2 181.
[4]周书凤.左旋肉碱-种人体特定条件下的必需营养素[J].国外医学卫生学分册,1996,23(1):33-35.
[5]竺琴,苏流坤,郑家概,等.高效液相色谱-质谱联用测定婴幼儿配方奶粉中的左旋肉碱[J].分析则试学报,2002,31(3):355 -358.
[6]祝伟霞,杨冀州,刘亚风,等.保健品中左旋肉碱的反相高效液相色谱法测定[J].分析测试学报,2008(10):1 124-1 127.
[7]赵榕,孙开奇,罗仁才.离子对反相高效液相色谱法测定保健食品中肉碱[J].中国食品卫生杂志,2002,14(4):25-26.
[8]甘宾宾,黎少豪.HPLC法测定保健食品中左旋肉碱含量的研究[J].中国卫生检验杂志,2010(7):1 688-1 689.
[9]AikateriniKakou,Nikolaos C.Megoulas,Michael A.Koupparis.Determination of L-carnitine in food supplement formulations usingion-pair chromatography with indirect conductimetric detection[J].Journal of Chromatography A,2005,1 069(2):209 -215.
[10]邹晓莉,周艳阳,乔蓉,黎源倩,李岩.高效阴离子色谱法快速分析保健食品中的左旋肉碱[J].卫生研究.2011,40(3):358 -364.
[11]黄芳,黄晓兰,吴惠勤,邓欣,罗辉泰,朱志鑫,林晓珊.液相色谱-质谱法快速测定婴幼儿配方食品中L-肉碱的亲水相互作用[J].分析试验室.2011,30(10):111-114.
[12]Monika Dabrowska,MalgorzataStarek.Analytical approaches to determination of carnitine in biologicalmaterials,foods and dietary supplements[J]. Food Chemistry.2014,142(1):220 -232.
[13]Jean Demarquoy,Beatrice Georges,Caroline Rigault,Marie-Charlotte Royer,Am_elieClairet,Maud Soty,Serge Lekounoungou,Francoise Le Borgne.Radioisotopic determination of L-carnitine content infoods commonly eaten in Western countries[J].Food Chemistry.2004,86(1):137-142.
[14]Knuttel-GustavsenSeline.The determination of L-carnitine in several food samples[J].Food Chemistry,2007,105(2):793-804.
[15]王天西,熊文明,林梦勇.分光光度法测定乳粉中左旋肉碱含量[J].福建分析测试,2012,21(1):52-56.
[16]Marquis NRP and Fritz IB.Enzymological determination of free carnitineconcentrations in rat tissues[J].Journal of Lipid Research 1964,5(3):184 -187.
[17]黄权,王桂芹,周景祥,张东鸣.L-肉碱在动物营养方面的研究进展及应用[J].北华大学学报:自然科学版,2001,2(2):158-162.
