化学法改性溶菌酶抑菌性及其结构研究
2014-11-20杨曼利曹栋史苏佳
杨曼利,曹栋,史苏佳
1(江南大学食品学院,江苏 无锡,214122)2(江南大学理学院,江苏无锡,214122)
蛋清溶菌酶(lysozyme)是一种由129个氨基酸组成的单体蛋白,是一种糖苷水解酶,分子质量14 400左右,等电点11左右[1-2]。化学性质十分稳定,pH值在1.2~11.3范围内剧烈变动时,结构几乎不变,在酸性环境中对热的稳定性也很强。溶菌酶具有抗菌,抗病毒,清除坏死组织,加快创口修复再生等功能,在食品和医药工业具有广泛应用[3]。溶菌酶广泛存在于鸟、家禽的蛋清、哺乳动物的泪液、唾液、血浆、尿、乳汁和组织细胞中,以蛋清中含量最为丰富,占蛋清总蛋白的 3.4%~3.5%[4-6]。
溶菌酶是一种非广谱抗菌剂,主要作用于革兰氏阳性细菌[7-9],其作用机理为能够水解细胞壁的主要成分肽聚糖,而革兰氏阴性菌细胞壁中肽聚糖含量很少,且被一层较厚的脂多糖类物质所覆盖,所以对革兰氏阴性细菌几乎没有作用,极大限制了溶菌酶作为天然防腐剂的推广。为了改变这种局限性,Ibrahim[10]等用紫苏醛对溶菌酶进行修饰,合成了对Staphylococcus aureus和 Escherichia coli.k12有抑制能力的Periliaedhyed-lysozyme1聚合物,Visalsok Touch[11]等利用2 mmol/L 二硫苏糖醇在 pH 8.0,30℃条件下处理溶菌酶0.5~4 h,增强了溶菌酶对革兰氏阴性菌的杀菌效果。庞莉[7]等研究了阿魏酸改性溶菌酶的抑菌特性。本研究重点考察了肉桂酸、咖啡酸及对香豆酸改性溶菌酶对革兰氏阴性菌的抑制作用及改性前后酶的结构变化情况。
1 材料与方法
1.1 材料与仪器
溶壁微球菌冻干粉,上海复祥生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus CMCC26003)、大肠杆菌(Escherichia coli CMCC44102)、铜绿假单胞菌(Pseudomonas aeruginosa CMCC10104),江南大学食品学院粮食油脂及植物蛋白工程实验室提供;咖啡酸、肉桂酸、对香豆酸 EDAC,吉尔生化(上海)有限公司;蛋白胨、牛肉膏、琼脂粉、考马斯亮蓝G-250,国药集团化学试剂有限公司。
SW-CJ-IF型超净工作台,苏州安泰技术公司;杀菌锅,上海申安医疗器械厂;SP-250A型恒温培养箱,南京实验仪器总厂;HH-2型恒温水浴锅,金坛杰瑞尔电器有限公司;Free Zone 2.5型冷冻干燥机,LABCONCO公司;Nicolet iS10型傅里叶变换红外光谱仪,美国赛默飞公司。
1.2 实验方法
1.2.1 改性溶菌酶的制备
取40 mg肉桂酸、咖啡酸和对香豆酸溶解于3 mL 5 mol/L的NaOH溶液中,用5 mol/L HCl调pH至7.5左右,然后加入杀菌去离子水至8 mL;再向该溶液中加入160 mg的EDAC,完全溶解后,于室温下静止1 h;再加入40 mg溶菌酶,得到质量比为1∶1的混合物,混合物在30℃恒温水浴中搅拌24 h,反应结束后,不溶的部分离心(6 000 r/min,20 min)除去,可溶部分进行后续试验。
1.2.2 Sephadex G-25柱层析
取10 mL上述样品液上Sephadex G-25柱(2.6 cm×21 cm),用50 mmol/L pH 7.4的磷酸盐缓冲液洗脱,流速1 mL/min,记录仪纸速为3 cm/min,检测波长280 nm。收集具有溶菌酶活性的峰,冷冻干燥,去除未参加反应的游离肉桂酸、咖啡酸和对香豆酸分子。
1.2.3 溶菌酶活性测定[6]
将待测酶液和底物悬液分别置于25℃水浴中保温20 min,吸取底物悬液2.8 mL,置1 cm比色杯中比色测定450 nm下的OD值,此为零时读数,然后加入酶液0.2 mL,迅速摇匀,从加入酶液起计时,每隔1 min测定1次450 nm下的OD值,共测定3次。本试验的酶活力单位定义为:每分钟OD值下降0.001为1个活力单位(25℃、pH值6.2),即每毫克酶活力单位(U/mg)=(△OD450/min)×103/样品的质量(mg)。
1.2.4 抑菌能力的测定
1.2.4.1 菌悬液的制备
在超净台上,用接种环分别挑取少量大肠杆菌、金黄色葡萄球菌、溶壁微球菌和铜绿假单胞菌分别接种于若干个已灭菌的斜面,37℃恒温培养24 h。然后用接种环分别挑取少量各个菌体,接种到已灭菌的液体培养基中,37℃恒温水浴摇床,培养24 h。所得菌液按照10倍稀释法[12-13]稀释,得到一定浓度梯度的不同菌悬液。分别取稀释度为 10-6、10-7和10-8的菌液平板培养,37℃,24 h,计菌落数,然后用灭菌去离子水稀释原菌悬液至106~107CFU/mL。
1.2.4.2 抑菌圈的测定
采用杯碟法[14]。取20 mL熔化的固体培养基于培养皿中,凝固后,取0.2 mL浓度为106~107CFU/mL的各菌悬液均匀涂布于固体培养基中,10 min后,将牛津杯放置于培养皿表面,加入样品液,盖好培养皿,置37℃恒温培养24 h,测抑菌圈直径。每个样品液实验重复3次,取平均值。
1.2.4.3 最小抑菌浓度的测定
称取一定量的天然酶、改性酶及所用的3种酸,用50 mmol/L pH 7.0磷酸盐缓冲液溶解,配制质量浓度分别为 1.50、1.25、l.00、0.75、0.50、0.25、0.125 mg/mL的样品液,每一系列分别接种金黄色葡萄球菌、溶壁微球菌、大肠杆菌和铜绿假单胞菌,每个浓度重复3次,置37℃生化培养箱中恒温培养24h,计菌落数。以50 mmol/L pH7.0磷酸盐缓冲液代替样品液,作空白对照。观察平板上菌落生长情况,以无菌落生长的平板中样品的浓度为MIC。
1.2.5 结构测定[18-19]
固体样品与KBr混匀,研磨,压片,选用Nicolet iS10型傅立叶变换红外光谱仪,对压片进行红外光谱扫描。实验条件:光谱分辨率4 cm-1,波数扫描范围4 000~400 cm-1,扫描次数32。
2 结果与讨论
2.1 Sephadex G-25柱层析
按照1.2.2的方法测定,结果如图1、图2和图3所示。洗脱峰1、1'、1″先流出,对应的组分是大分子物质,洗脱峰2、2'、2″后流出,对应的是小分子物质,分别收集相关组分,测酶活力,可得洗脱峰1、1'、1″具有酶活力,为含有溶菌酶的混合物,洗脱峰2、2'、2″不具有酶活力,是未参加反应的游离小分子物质,主要是未参加反应的游离肉桂酸、咖啡酸、对香豆酸分子,收集具有酶活力的峰1、1'、1″组分冷冻干燥。

图1 肉桂酸改性酶的凝胶层析谱图Fig.1 The gel chromatography spectra of cinnamic acid modified enzyme

图2 咖啡酸改性酶的凝胶层析谱图Fig.2 The gel chromatography spectra of caffeic acid modified enzyme
2.2 活性测定
以溶壁微球菌为底物,按照1.2.3的方法测定酶活力,结果如图4所示。由图4可知,与天然酶相比,改性酶的活力有所下降,经计算可得,肉桂酸改性酶、咖啡酸改性酶和对香豆酸改性酶的活力分别为天然酶的64.2%、70.1%和65.8%,由后续结构试验可知,改性前后,酶的各二级结构含量均发生变化,酶结构的变化可能是导致其活力下降的主要原因。
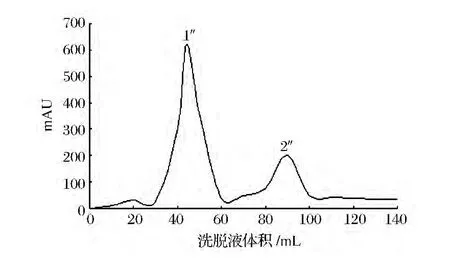
图3 对香豆酸改性酶的凝胶层析谱图Fig.3 The gel chromatography spectra of p-coumaric acid modified enzyme
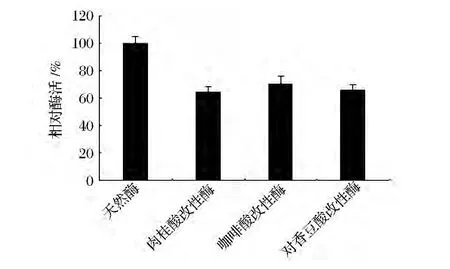
图4 天然酶与改性酶的酶活力Fig.4 The relative enzyme activity of natural and modified enzyme
2.3 抑菌圈的测定
按照1.2.4.2的方法测定天然酶与改性酶对不同实验菌的抑菌圈直径,每个样品重复3次,测抑菌圈直径,求平均值,结果见图5。
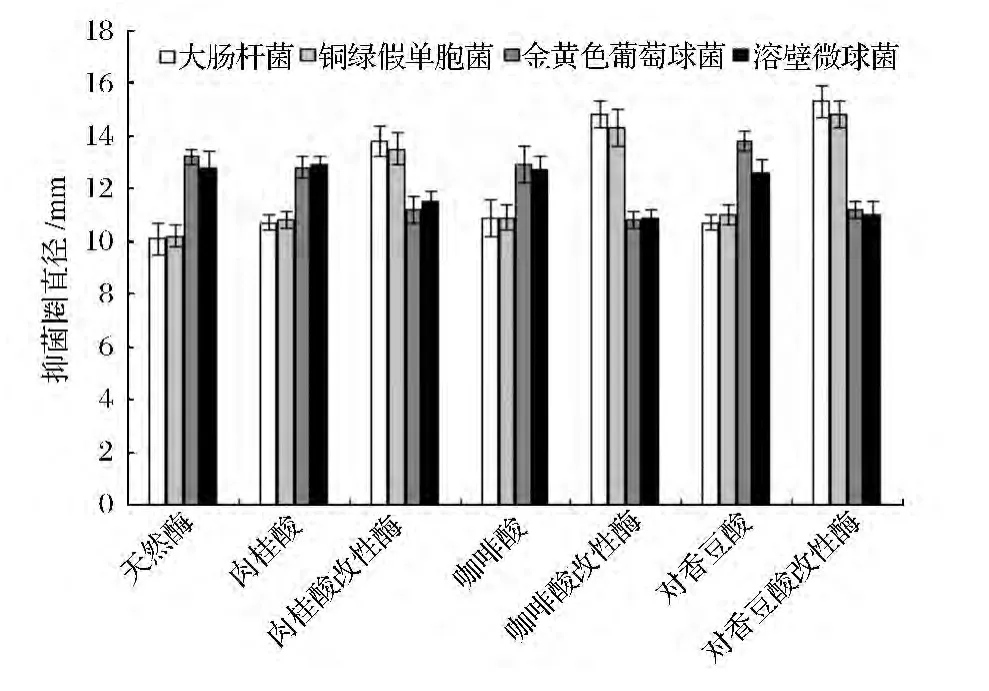
图5 不同样品液对各个菌的抑菌圈直径Fig.5 The bacteriostatic circle diameter of different liquid samples to different bacteria
由图5可知,改性酶对革兰氏阴性菌的抑菌作用明显增强,抑菌圈直径大于14 mm,但是不同改性酶之间的差别又有所不同,咖啡酸和对香豆酸改性酶对革兰氏阴性菌的抑制作用大于肉桂酸改性酶;但改性酶对阴性菌抑制作用增强的同时对阳性菌的抑制作用减弱,改性酶对阳性菌的抑菌圈直径均小于天然酶,故为了同时达到对阴性菌和阳性菌的抑菌效果,可将天然酶和改性酶混合使用。
2.4 最小抑菌浓度(MIC)的测定
按照1.2.4.3的方法测定不同浓度样品液对不同实验菌的最小抑菌浓度,结果如表1所示。由表1可知,天然酶共价结合不同的芳香族酸以后,对革兰氏阴性菌的抑制作用增强,强于单独使用酸和天然酶的效果,咖啡酸和对香豆酸共价结合溶菌酶以后,对大肠杆菌和铜绿假单胞菌的最小抑菌浓度均为0.5 mg/mL,而肉桂酸共价结合溶菌酶以后,对大肠杆菌和铜绿假单胞菌的最小抑菌浓度则为0.75 mg/mL,明显低于天然酶对二者的最小抑菌浓度1.50 mg/mL;但是对革兰氏阳性菌的抑制作用却有所减弱,肉桂酸改性酶对金黄色葡萄球菌和溶壁微球菌的最小抑菌浓度分别为1.25和1.50 mg/mL,而咖啡酸和对香豆酸改性酶对二者的最小抑菌浓度则为1.25 mg/mL,大于天然酶的1.00 mg/mL,改性酶对阴性菌的抑制作用明显增强,而对阳性菌的抑制作用略微下降,可见该改性具有一定的实用价值。

表1 各样品液对不同细菌的最小抑菌浓度mg/mLTable 1 The minimal inhibition concentration of liquid samples to different bacteria mg/mL
2.5 结构测定
按照1.2.5的方法测定各样品的红外光谱图,用Peak Fit v4.12软件分析红外光谱图中属于酰胺I带特征峰的l 600~1 700 cm-1波段。先校正基线,然后用Gaussian法去卷积,再利用二阶导数法拟合,进行多次拟合,拟合至与原谱图重合,拟合完成之后可得到各构象的特征峰位置及各特征峰面积与总面积的比值,计算出各构像在蛋白质二级结构中所占的比例。实验结果见表2。由表2可知,改性后的酶与天然酶相比,各二级结构的含量均发生了变化,与天然酶相比,不同的酸改性后,β-折叠的含量均呈上升趋势,且变化较大,分别从 6.83%变为 34.18%、32.37%和17.50%;而无规则卷曲的含量,咖啡酸改性酶略低于天然酶,肉桂酸和对香豆酸改性酶均大于天然酶,但肉桂酸改性酶的变化幅度小于对香豆酸改性酶;天然酶的α-螺旋含量最高,3种改性酶的含量均低于天然酶,咖啡酸与肉桂酸改性酶的变化比较相似,而对香豆酸的变化最大;而与天然酶相比,β-转角的含量均呈下降的趋势,肉桂酸改性酶与咖啡酸改性酶最为明显,从26.73%分别降至为5.70%和11.80%,对香豆酸改性酶降至20.78%,改性酶结构的变化可能是导致酶活力及抑菌性改变的原因。
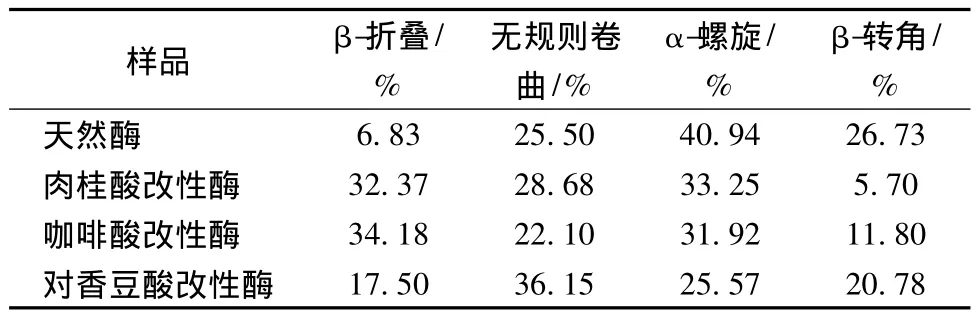
表2 天然酶与改性酶各二级结构的含量Table 2 The secondary structure content of natural and modified enzyme
3 结论
与天然酶相比,改性处理后的溶菌酶,活力有所下降,但是对革兰氏阴性菌的抑制作用增强,肉桂酸、咖啡酸和对香豆酸改性酶对大肠杆菌和铜绿假单胞菌的最小抑菌浓度分别为0.75、0.5 mg/mL和0.5 mg/mL,对革兰氏阳性菌的抑制作用却有所减弱,3种改性酶对金黄色葡萄球菌和溶壁微球菌的最小抑菌浓度均大于天然酶;改性酶与天然酶相比,各二级结构的含量均发生一定的变化,α-螺旋和β-转角的含量均呈下降趋势,而β-折叠的含量则呈上升趋势,咖啡酸改性酶的无规则卷曲含量下降,而肉桂酸和对香豆酸的含量增加。
[1]张文会,王艳辉,马润宇.离子交换法提取鸡蛋清溶菌酶[J].食品工业科技,2003,24(6):57-59.
[2]ZHANG Xiu,WANG Yue-jun,SUN Mi,et al.Purification and properties of lysozyme from a marine strain[J].Annals of Microbiology,2008,58(1):89-94.
[3]Grzegorz Lesnierowski,Renata Cegielska-Radzie Jewska.Potential possibilities of production,modification and practical application of lysozyme[J].Acta Sci Pol,Technol Aliment,2012,11(3):223 -230.
[4]Débora da Silva Freitas,Jose Abrahao-Neto.Batch purification of high-purity lysozyme from egg white and characterization of the enzyme modified by PEGylation [J].Pharmaceutical Biology,2010,48(5):554-562.
[5]Andreas Bernkop-Schnurch,Sabine Krist,Midhat Vehabovic,et al.Synthesis and evaluation of lysozyme derivatives exhibiting an enhanced antimicrobial action[J].European Journal of Pharmaceutical Sciences,1998,6(4):301 -306.
[6]施特尔马赫.酶的测定方法[M].北京:中国轻工业出版社,1992:237.
[7]庞莉,陆建安,王淼,等.阿魏酸化学修饰溶菌酶及扩展抑菌谱的研究[J].食品工业科技,2009,30(11):184-187.
[8]赵电波,白艳红,张小燕,等.天然生物防腐剂溶菌酶的改性研究进展[J].中国食品添加剂,2010,18(5):200-2004.
[9]Serap Evran,ihsan Yasa,Azmi Telefoncu.Modification of lysozyme with oleoyl chloride for broadening the antimicrobial specificity[J].Preparative Biochemistry& Biotechnology,2010,40(13):316-325.
[10]Ibrahim H R,Hatta H,Fujiki M,et al.Enhanced antimicrobial action of lysozyme against Gram-negative and Gram-positive Bacteria due to modification with perillaldehyed[J].Food Chemistry,1994,42(24):1 813 -1 817.
[11]Visalsok Touch,Shigeru Hayakawa,Koichi Saitoh.Relationships between conformational changes and antimicrobial activity of lysozyme upon reduction of its disulfide bonds[J].Food Chemistry,2004,84(3):421 -428.
[12]Claudia Valenta,Elfriede Schwarz,Andreas Bernkop-Schnurch.Lysozyme-caffeic acid conjugates:possible novel preservatives for dermal formulations[J].International Journal of Pharmaceutics,1998,174(5):125 -132.
[13]罗泰来,申亮亮,柏银兰.分支杆菌计数方法的比较研究[J].第四军医大学学报,2007,28(7):73 -375.
[14]吴迪,蔡伟民.壳聚糖对细菌细胞壁的影响[J].黑龙江大学自然科学学报,2003,20(3):1-4.
[15]蔡宏亚,何宁先,王泽平.连续稀释法研究红腺忍东体外抑菌作用[J].中华实用中西医杂志,2007,20(5):448-449.
[16]李淑梅,杨帆.中草药提取物对大肠杆菌的体外抑菌实验[J].安徽农业科学,2006,34(23):6 212 -6 222.
[17]LIU Shu-tao,Taisuke Sugimoto.Lipophilization of lysozyme by short and middle chain fatty acids[J].Agric Food Chem,2000,48(22):265-269.
[18]罗霄,车春玲,王国和.基于红外光谱法的古代丝织品蛋白质二级结构变化分析[J].现代丝绸科学与技术,2011,5(12):161 -163.
[19]吴黎明,周群,周骁,等.蜂王浆不同贮存条件下蛋白质二级结构的Fourier变换红外光谱研究[J].光谱学与光谱分析,2009,29(1):82 -87.
