固定化Colletotrichum lini ST-1转化去氢表雄酮为三羟基雄甾烯酮*
2014-11-20刘梅珍李恒杨春霞吴保承李会龚劲松史劲松许正宏
刘梅珍,李恒,,杨春霞,吴保承,李会,龚劲松,史劲松,许正宏
1(江南大学 药学院,江苏 无锡,214122)
2(江苏省生物活性制品加工工程技术研究中心,江苏无锡,214122)
三羟基雄甾烯酮(3β,7α,15α-三羟基雄甾-5-烯-17-酮,7α,15α-diOH-DHEA)可合成多种甾体类激素,在医药工业中常作为重要的医药中间体[1]。但采用生物转化法羟化去氢表雄酮(DHEA)合成三羟基雄甾烯酮的工艺,存在底物水溶性差问题,从而导致产物得率较低[2-3]。这是甾体类药物微生物转化生产遇到的一个关键问题。在生产和研究中,已有大量方法被用于减少底物不溶解所引起的传质阻力。如在发酵液中直接加入表面活性剂、亲水性有机溶剂或将甾体底物预溶于有机溶剂后再投入发酵液。然而,无论选择哪种适用的溶剂,它们对微生物细胞的毒害作用都不可避免,这在很大程度上制约了底物投料量的增加[4-5]。如何减小溶剂对细胞的毒害作用是甾体生物转化急需解决的难题。
固定化技术是工业生物催化领域的一项重要技术,具有提高催化剂的稳定性、增加重复利用批次、并有利于提高细胞对底物和有机溶剂的耐受性以及便于产物的分离纯化等优势。另外,固定化细胞容易回收重复利用,提高了单位利用率,降低了生产成本[6-7]。鉴于这些技术优势,尽管固定化操作过程会使酶活有所降低,但该技术在医药、化工、食品等领域仍然备受关注。因此,选择合适的方法和材料制备固定化细胞,以提高生物酶的保留活性、操作稳定性以及重复利用性,并将其用于DHEA的生物转化具有广泛的应用前景。据已有文献资料,迄今为止,未见任何有关固定化亚麻刺盘孢霉(Colletotrichum lini)ST-1并用于生物转化DHEA生成7α,15α-diOHDHEA的相关文献报道。此文通过C.lini ST-1固定化方法和材料的选择,进行了 C.lini ST-1转化DHEA生成7α,15α-diOH-DHEA的固定化条件和转化条件优化以及批次转化应用。
1 实验部分
1.1 材料和设备
1.1.1 菌株与培养基
Colletotrichum lini ST-1,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.6051。
种子培养基(g/L):酵母粉15,葡萄糖15,玉米浆3,豆饼粉10,pH自然。
发酵培养基(g/L):葡萄糖15,酵母膏15,玉米浆3,pH自然。
1.1.2 试剂
DHEA与7α,15α-diOH-DHEA 由浙江仙居药业提供;琼脂、琼脂糖、卡拉胶、明胶、聚乙烯醇(PVC)、SA、CaCl2、NaCl、NaH2PO4、乙酸乙酯等均为分析或化学纯,乙腈为色谱级,均购自国药集团化学试剂有限公司。
1.1.3 主要设备
硅胶层析板、层析缸、恒流泵等;恒温混匀仪MS-100,杭州奥盛仪器有限公司;85-2数显恒温磁力搅拌器,江苏省金坛市荣华仪器制造有限公司;日立冷冻高速离心机CR22GⅡ;戴安Ultimate3000液相色谱仪。
1.2 实验方法
1.2.1 菌体的制备与收集
菌球制备与收集:调配不同的发酵培养基初始pH值,以及添加不同浓度的吐温-80,灭菌后按不同的接种量接种 C.lini ST-1种子液,于30℃、220 r/min摇床上培养24 h。得到的菌球直径均一的菌液,洗涤过滤便得干净菌球。
菌液制备与收集:通过控制接种量、摇床转速、培养基初始pH及添加玻璃珠等方法培养菌体,获得在0.5 mm尺度内均一的菌液后,洗涤并离心收集得到湿菌体。
1.2.2 固定化C.lini ST-1的制备
交联:干净菌球分别用体积分数为0.01%的戊二醛和京尼平固定1 min后过滤洗涤,备用。
琼脂、琼脂糖、卡拉胶、PVC包埋:按参考文献[8]制备,其中琼脂、琼脂糖、卡拉胶、KCl浓度均为40 g/L,PVC 浓度为140 g/L。
明胶包埋:湿菌体与等体积的40 g/L明胶溶液混合均匀后,倒在平板中。4℃冷却凝固后,切成边长2 mm的小块,于1%的戊二醛溶液中浸泡30 min,倾去戊二醛,洗涤数次后4℃储存备用[9]。
SA包埋:SA溶液与湿菌体等体积混合均匀,用恒流泵使混合物通过针头挤压制得固定化小球(d=3 mm)于缓慢搅拌的冰浴CaCl2溶液中。4℃固定3 h后,洗涤并过滤小球,于4℃储存在PBS溶液(10 mmol/L,pH 6.5)中备用[10-12]。
1.2.3 固定化C.lini ST-1的DHEA转化
C.lini ST-1的固定化条件优化:取一定量不同浓度SA(或CaCl2)制备得到的固定化C.lini ST-1于250 mL摇瓶中,加入20 mL缓冲液,投入8 g/L(研究底物浓度与批次转化对固定化细胞的影响时另定)DHEA,于摇床上转化。
固定化C.lini ST-1转化条件的优化:采用单因素优化方法,保持其他转化条件不变,仅改变摇床转速、转化温度、缓冲液pH或浓度、固定化细胞量,以及添加合适浓度金属离子、助溶剂和不同浓度的DHEA,考察其对固定化细胞转化 DHEA生成7α,15α-diOH-DHEA的影响。
固定化C.lini ST-1的批次转化:分别投加不同浓度DHEA的转化体系,于最适条件下分别转化最佳时长后,过滤分离固定化细胞与转化液。转化液用于检测产物的含量,固定化细胞则投入新的转化体系中转化。如此让固定化细胞转化5~7个批次。
底物、产物的含量检测:按照参考文献[13]制备HPLC样品。HPLC条件与参考文献[14]相同。
2 结果与分析
2.1 菌球与菌液的制备
本研究初步考虑采用交联法和包埋法2种方法来考察其对C.lini ST-1的固定情况。C.lini ST-1在普通液体培养条件下,菌体自成球,最终形成含有大量颗粒的菌液(图1-a)。而本实验结果发现,在初始pH为4,添加10 g/L吐温-80的条件下,可获得直径合适(d=2 mm)的菌球(图1-b),且菌球表面为毛绒状,生理状态良好。而添加适量玻璃珠可培养得到分散均匀的菌液(图1-c)。
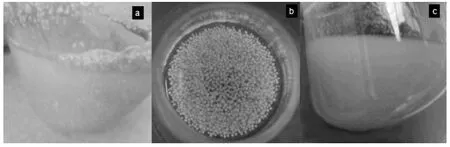
图1 不同培养条件下的菌体形态Fig.1 Mycelial morphology under different culture conditions
2.2 交联法
交联剂戊二醛和京尼平交后的菌球,产物7α,15α-diOH-DHEA的得率分别为23.8%,6.2%,均低于对照(27.0%)。其中以京尼平为交联剂时,固定的菌体产物得率大幅度下降。
随后对戊二醛的浓度进行了优化。发现交联固定后的菌体,产物的得率随着戊二醛浓度(0,0.01%,0.04%,0.07%,0.1%)的增加而迅速下降,且在第2批次转化时菌体已基本无转化能力。推测这可能是由于交联剂对菌丝体的毒害作用较大。因此随后考虑选用其他固定化方法,如包埋法。
2.3 包埋法
2.3.1 包埋材料对产物得率的影响
不同包埋材料制得的固定化C.lini ST-1,转化DHEA生成7α,15α-diOH-DHEA的结果如图2所示。琼脂糖和SA包埋的C.lini ST-1,产物得率明显高于其他几种材料,且与游离细胞转化能力基本持平。但考虑到琼脂糖价格贵、制得的固定化细胞机械强度不高,而SA无此缺点。因此,最终选取SA作为包埋材料。
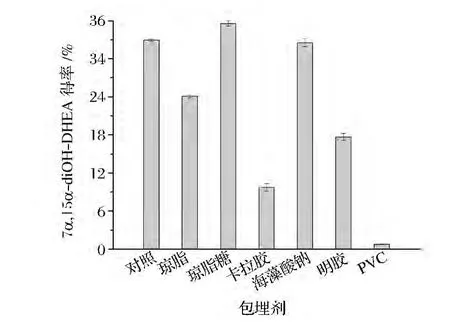
图2 不同包埋材料固定化细胞的产物得率比较Fig.2 The product yield of immobilized cells embedded in different materials
2.3.2 SA浓度对产物得率的影响
包埋剂SA的浓度是影响固定化细胞活力的重要因素之一。从图3-a可以看出,随SA浓度的提高,7α,15α-diOH-DHEA的产率有一定的提高;但当 SA浓度过高时,产率有一定下降,这可能是SA浓度越高,虽然固定化细胞的机械强度增加,但传质受到相应阻碍。最终,选取30 g/L的SA作为后续研究。
2.3.3 CaCl2浓度对产物得率的影响
固定剂浓度是影响固定化细胞性能的另一个重要因素。在SA浓度为30 g/L的条件下,分别用不同浓度的 CaCl2溶液固化细胞,并将其用于转化DHEA。实验结果如图3-b,CaCl2浓度对产物的得率影响较大,当CaCl2浓度为50 g/L时效果最佳。

图3 SA和CaCl2浓度对产物得率的影响Fig.3 Effects of SA and CaCl2concentration onproduct yield
2.4 转化温度、转速对产物得率的影响
用上述优化的固定化条件制备得到的固定化C.lini ST-1,考察了转化温度和摇床转速对其转化DHEA生成7α,15α-diOH-DHEA的影响。由图4可以看出,27℃时产物得率达到最高水平,因此转化温度选为27℃。对于转速,产物得率在180 r/min(38.9%)时较 160 r/min(29.0%)和 220 r/min(26.0%)时高,因此最终选择180 r/min作为后续转化的转速。

图4 转化温度对产物得率的影响Fig.4 Effect of conversion temperature on product yield
2.5 缓冲液pH和浓度对产物得率的影响
从图5可以看出,在pH 5~8的范围内,pH对固定化细胞的产物得率无显著影响,为此,后续实验将pH选为6.5。随后本研究还测定了不同浓度磷酸钠缓冲液对转化的影响。结果表明,缓冲液浓度为20 mmol/L时,固定化细胞的产物得率相对较高。
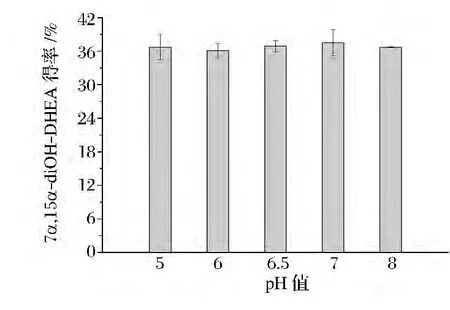
图5 缓冲液pH对产物得率的影响Fig.5 Effect of buffer pH on product yield
2.6 固定化细胞量的优化
转化过程中所采用的固定化细胞量,影响整个体系对DHEA的转化能力。本实验考查了20 mL缓冲液体系中,固定化细胞添加量对产物得率的影响。由图6可以看出,当固定化细胞质量为12 g时,产物得率达到最大值,约为52%。
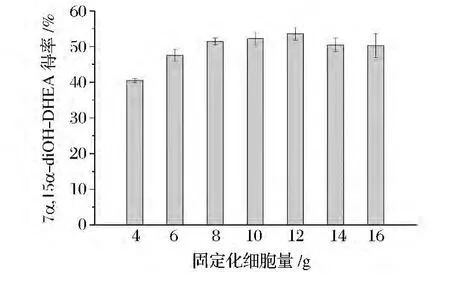
图6 固定化细胞量对产物得率的影响Fig.6 Effect of immobilized cell amount on the product yield
2.7 金属离子对固定化C.lini ST-1转化DHEA的影响
考虑到甾体化合物的生物羟化反应需要Fe2+与Fe3+的循环参与[15],所以本实验研究了几种常用的金属离子对固定化C.lini ST-1转化DHEA的影响。结果显示,Fe2+对转化产率表现出显著的促进作用,其次是Zn2+,而Fe3+则具有一定的抑制效果(图7-a)。据文献报道,Fe2+生物利用性要高于Fe3+,而且还可与超氧阴离子、过氧化氢等氧化因子反应生成反应性更强的羟基自由基,而Fe3+对菌体活力有显著的抑制作用[16]。另外发现,Fe2+在11 mmol/L时,产物得率达到最高值57.5%(图7-b)。

图7 金属离子对产物得率的影响Fig.7 Effect of metal ion on product yield
2.8 助溶剂对固定化C.lini ST-1转化DHEA的影响
亲水性的醇类以及其他有机溶剂和表面活性剂,有利于增加甾体化合物的溶解性和改变生物催化剂的选择性[4]。在本实验考察的几种溶剂中,丙三醇对固定化细胞的产物得率最为有利(图8-a)。其后继续考察了不同丙三醇浓度对固定化细胞转化DHEA的影响,如图8-b所示,在添加量为90 g/L时,产物得率为66.0%,较对照提高幅度为14.9%。
2.9 PEG对固定化C.lini ST-1转化DHEA的影响
溶质排出法[17]是一种有效的通过造孔而增加传质的方法。聚乙二醇(PEG)具有两亲性,可以作为SA固定化小球的致孔剂,且不同分子质量的PEG可以制得不同直径的小孔[18]。因此,在本实验中我们选取了PEG作为制孔剂以考察其对固定化细胞产物得率的影响。
由图9-a可知,PEG400制孔的固定化细胞在转化得率上表现一定优势,而其他分子质量的PEG化合物并无显著影响;尤其分子质量超过400时产率开始逐步下降。分析原因可能为PEG400的分子质量比底物DHEA(分子质量288)和产物7α,15α-diOHDHEA(分子质量320)的分子质量大且最为接近,因
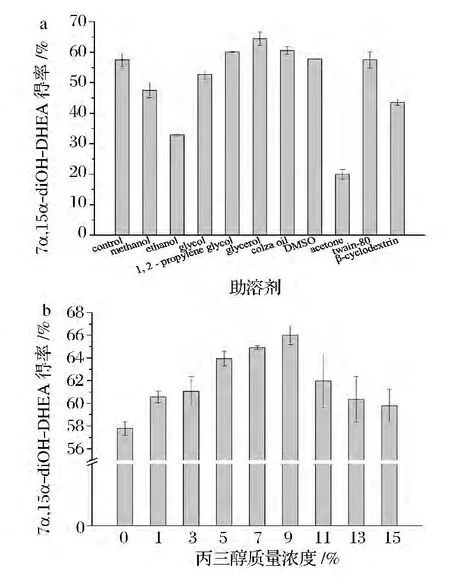
图8 助溶剂对产物得率的影响Fig.8 Effect of co-solvent on product yield

图9 PEG对产物得率的影响Fig.9 Effect of PEG on product yield
2.10 不同底物添加量下转化时间对产物得率的影响
底物对菌体有一定的毒害作用,如何选取合适的底物浓度以获得最大产物得率是实际生产中需要考虑的重要问题。另外,底物的浓度不同,转化体系的得率与生产强度达到最大值所需的时长不同。所以接下来考察了不同底物添加量下转化时间对产物得率的影响。由图10-a可以看出,不同的底物浓度下,得率均随时间的增加而增加,最后基本趋于平稳,但达到最高值所需时间不同。DHEA质量浓度为6、8、10、12、14 g/L时固定化细胞得率达到最高值所需时间分别为:80 h(63.7%)、88 h(71.2%)、88 h(73.1%)、80 h(68.5%)和 80 h(61.1%)。而游离细胞在DHEA质量浓度为8、10 g/L时,均为64 h(48.3%,42.3%)。同时可以看出,DHEA在10 g/L内,随着浓度的增加,固定化细胞的最大得率逐渐增加。但继续加大底物浓度,菌体转化DHEA生成目标产物的能力达到极限,且底物浓度越高,对菌体的毒害越大,从而最大得率降低[18]。
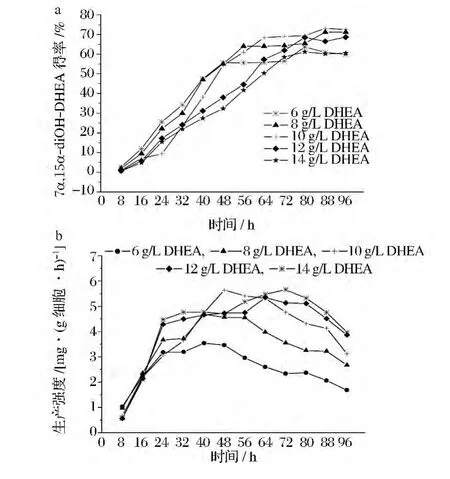
图10 不同底物投料浓度下转化时间对产物得率的影响Fig.10 Effects of time on product yield at different DHEA concentration
而体系的生产强度,则都是先增加,在达到一个极值后开始下降。因为在转化初期,固定化细胞存在传质阻力,所以生产强度偏低。随着时间的延长,这种限制逐渐减除,生产强度也相应升高;后期则因产物的反馈抑制而下降。不同的底物投料浓度,所得极值不同,取得极值的时间点也不同。其中,底物为6、8 g/L时,生产强度均在40 h达到最高值,10 g/L为48 h,12 g/L 为64 h,14 g/L 为72 h(图10-b)。
2.11 批次转化
为此,本研究又进行了不同底物浓度下的批次转化实验,每批次的转化时长为相应底物浓度下体系的生产强度取得最高值时的时长。由表1可知,随着固定化细胞转化批次的增加,产物的得率先增加后下降,第2批次时最高。固定化细胞经过适应期后,以及第1批次转化时残留在SA小球中的产物的释放,使得第2批次的产物得率增加。而随后则因为固定化细胞的衰亡和营养物质的缺失,得率随之下降。固定化细胞转化4个批次,底物浓度在10 g/L时最佳,其产能为1.09(g产物/g细胞),是游离细胞0.37(g产物/g细胞)的3倍,且每批次得率均在42%以上,产量为24.1 g/L。该数据为Romanoa等人所报道产量的 4 倍[19]。
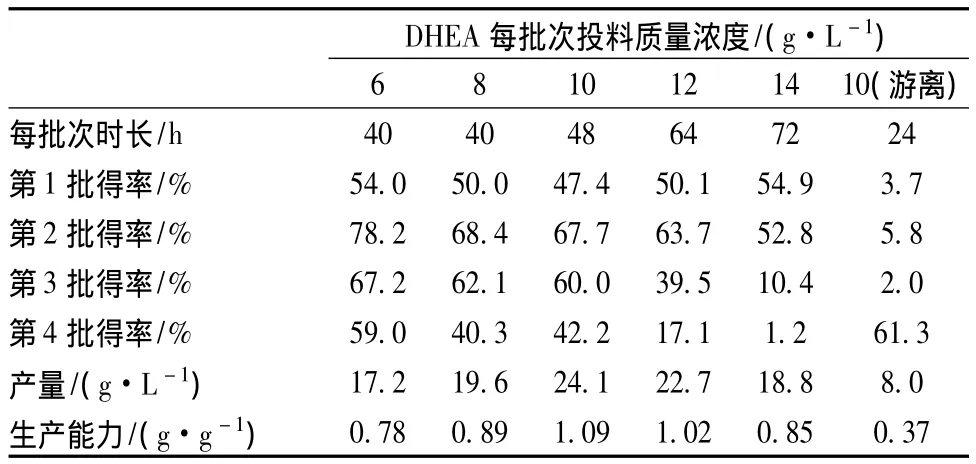
表1 不同底物投料浓度下的批次转化Table 1 Batch conversion at different substrate feeding concentration
3 结论
经过方法和材料的筛选,选择了适用、易操作的SA包埋法。通过固定化条件和固定化C.lini ST-1转化 DHEA生成 7α,15α-diOH-DHEA的条件的优化,得到最适的转化条件。投加8 g/L DHEA,在最适条件下转化65 h,产物得率为68.7%,较游离细胞(51.2%)提高34.2%。而在DHEA浓度为10 g/L时,产物得率高达73.1%,较游离细胞(42.3%)高72.8%。说明固定化细胞在一定程度上可以有效保护菌体,提高细胞对底物的耐受性。而且固定化细胞可重复利用4个批次,生产力为游离细胞的3倍。
[1]Lobastova T G,Gulevskaya S A,Sukhodolskaya G V,et al.Dihydroxylation of dehydroepiandrosterone in Positions 7α and 15α by Mycelial Fungi[J].Applied Biochemistry and Microbiology,2009,45(6):617-622.
[2]Donova M V,Egorova O V.Microbial steroid transformations:current state and prospects[J].Applied Microbiology and Biotechnology,2012,94(6):1 423-1 447.
[3]Mahato S B,Garai S.Advances in microbial steroid biotransformation[J].Steroids,1997,62(3):32 -45.
[4]Holland H L,Poddar S,Tripet B.Effect of cell immobilization and organic solvents on sulfoxidation and steroid hydroxylation by Mortierella isabellina[J].Journal of Industrial Microbiology,1992,10(3-4):195-197.
[5]许正宏,吴燕,李会,等.甾体生物转化技术研究的现状与进展[J].生物加工过程,2013,2(5):30-36.
[6]蒋中华,张津辉.生物分子固定化技术及应用[M].北京:化学工业出版社,1998:215.
[7]朱启忠.生物固定化技术及应用[M].北京:化学工业出版社,2009:15.
[8]Arabi H,Yazdi M T,Faramarzi M A.Influence of whole microalgal cell immobilization and organic solvent on the bioconversion of androst-4-en-3,17-dione to testosterone by Nostoc muscorum[J].Journal of Molecular Catalysis B:enzymatic,2010,62(3 -4):213 -217.
[9]梁足培,冯亚青,孟舒献,等.明胶膜固定化脲酶的制备及性质[J].精细化工,2004,21(7):512-515.
[10]Peart P C,Chen A R M,Reynolds W F,et al.Entrapment of mycelial fragments in calcium alginate:A general technique for the use of immobilized filamentous fungi in biocatalysis[J].Steroids,2012,77(1 -2):85 -90.
[11]Maritz J,Krieg H M,Yeates C A,et al.Calcium alginate entrapment of the yeast Rhodosporidium toruloides for the kinetic resolution of 1,2-epoxyoctane[J].Biotechnology Letters,2003,25(20):1 775-1 781.
[12]曹艳辉,方慧英,诸葛斌,等.固定化Amycolatopsis sp.ST2710分段发酵无锡他汀[J].食品与发酵工业,2012,38(2):6-10.
[13]尚珂,胡海峰,朱宝泉.微生物转化法合成7α,15α-二羟基雄烯醇酮[J].中国医学生物技术应用杂志,2004(2):30-34.
[14]李会,张明杰,张晓梅,等.三羟基雄甾烯酮高转化菌株的选育及工艺优化[J].生物工程学报,2013,29(11):1-5.
[15]玉彬.生物催化的手性合成[M].北京:化学工业出版社,2002:204-206.
[16]孙红启.铁载体和铁离子对细菌生长过程的影响[D].山东:山东大学,2008.
[17]Lin J K,Ladisch M R,Patterson J A,et al.Determining pore size distribution in wet cellulose by measuring solute exclusion using a differential refractometer[J].Biotechnology and Bioengineering,1987,29(8):976-981.
[18]ZHANG Y,LIN Y.Improvement of permeability of poly(vinyl alcohol)hydrogel by using poly(ethylene glycol)as porogen[J].Polymer-Plastics Technology and Engineering,2011,50(8):776-782.
[19]Romanoa A,Romanoa D,Raggb E,et al.Steroid hydroxylations with Botryodiplodia malorum and Colletotrichum lini[J].Steroids,2006,71(6):429 -434.
