扶正抗癌方联合吉非替尼治疗PS≤2分晚期NSCLC的疗效与安全性研究
2014-11-18柴小姝吴万垠李柳宁何春霞李福瑞
柴小姝,吴万垠,李柳宁,何春霞,李福瑞
(1.广东省中医院大学城分院,广东 广州510006;2.广东省中医院,广东 广州510120;3.广州中医药大学第二临床医学院,广东广州510120)
分子靶向药物治疗晚期EGFR基因突变型非小细胞肺癌(NSCLC)疗效与标准的化疗方案相当[1],其代表药物吉非替尼在IPASS研究及First-SIGNAL研究中均显示了体力状况评分(PS)≤2分、EGFR基因突变型的患者无进展生存时间(PFS)及客观缓解率(ORR)较化疗组有明显优势[2]。但由于吉非替尼治疗亦存在耐药性问题及毒副反应,而既往初步临床观察显示扶正抗癌方对于吉非替尼具有提高疗效、减轻毒副作用等效果。笔者对扶正抗癌方联合吉非替尼治疗NSCLC进行了随机对照研究,现将结果报道如下。
1 临床资料
1.1 一般资料 选择2011年10月—2013年4月广东省中医院肿瘤科住院部及门诊的经病理学诊断为NSCLC患者51例,EGFR基因检测为突变型,临床分期为ⅢB/Ⅳ期,PS≤2分,无脑转移或脑转移无症状,骨髓、心、肝、肾功能正常。将患者随机分为治疗组25例和对照组26例。2组基线资料如性别、年龄、吸烟情况、病理分类、疾病分期、PS评分等比较均无显著性差异(P均>0.05),分布均衡。见表1。

表1 2组患者主要临床特征比较 例
1.2 诊断标准 依据《新编常见恶性肿瘤诊治规范》的诊断标准,经CT、X线片、纤支镜活检、肺穿刺、手术探查活检确诊为原发性支气管NSCLC。病理学诊断:①肺手术标本经病理、组织学证实;②行开胸探查,肺穿刺或经纤维支气管镜检查采得肺或支气管活检组织,标本经组织学诊断为原发性支气管NSCLC;③颈和腋下淋巴结、胸壁、胸膜或皮下结节等转移灶活检,组织学表现符合原发性支气管NSCLC,且肺或支气管壁内疑有肺痛存在,临床上又能排除其他器官原发癌。细胞学诊断:痰液、纤维支气管镜毛刷、抽吸、冲洗等获得细胞学标本,镜下所见符合NSCLC细胞学标准,诊断可以确立。临床分期标准:按2009IASLC新肺癌分期标准。
1.3 纳入标准 病理诊断属NSCLC;临床分期为ⅢB或Ⅳ期的患者;EGFR-PCR检测为突变型;年龄18~80岁;PS(ECOG)评分0~2分;局部病灶和/或远处转移病灶可测量或可评估;骨髓、肝、肾、心、肺功能正常;知情同意参加本研究,签署知情同意书,依从性好,可随访。
1.4 排除标准 有症状脑转移未得到控制者;有活动性的重复癌者;患精神障碍疾病者;合并活动性结核及其他严重的感染性疾病者。
1.5 治疗方法 治疗组:扶正抗癌方1剂/d+吉非替尼250 mg/d早餐后1 h服用,连续使用直至出现病情进展。扶正抗癌方方药组成:太子参30 g、白术15 g、黄芪30 g、白花蛇舌草30 g、龙葵 30 g、石见穿 30 g、山慈菇 30 g、炒薏仁 30 g、八月札30 g、蛇泡勒30 g、莪术30 g、甘草10 g;痰中带血者加藕节、白茅根、旱莲草、三七粉、白芨粉、云南白药等,高热不退者加大青叶、生石膏、水牛角、安宫牛黄丸、柴胡针、清开灵注射液等,胸痛背痛者加延胡索、没药、川乌头、白芷等,悬饮胸胁满闷者加葶苈子、大枣、商陆、车前草等。对照组:吉非替尼250 mg/d早餐后1 h温开水送服,长期治疗直至出现病情进展。6周后评价近期疗效,无病情进展者此后每3个月评价疗效1次,直至死亡。
1.6 评价指标与评估方法 参照RECIST实体瘤疗效评价体系[3],计算疾病 PFS、总生存时间(OS)、ORR(其中完全缓解CR、部分缓解PR、稳定SD、进展PD)、疾病控制率(DCR)。
1.7 统计学处理 应用SPSS 11.5统计分析软件。组间特征均衡性采用Chi-Square检验;2组PFS、OS比较采用Kaplan-Meier分析;安全性评价采用描述性统计方法。P<0.05为差异有统计学意义。
2 结 果
2.1 PFS 至2013年4月底止,治疗组与对照组的平均PFS分别为12.0个月和7.9个月,2组比较有显著性差异(P<0.01)。见图1。
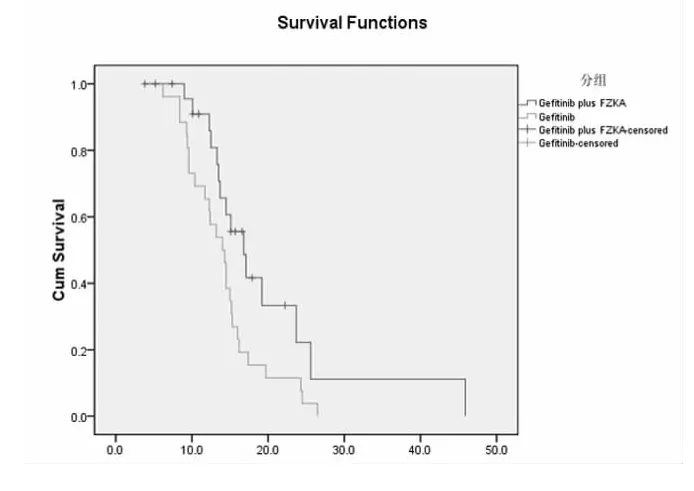
图1 2组PFS曲线
2.2 OS 至2013年4月底止,治疗组与对照组的平均OS分别为16.8个月和14.0个月,2组比较治疗有显著性差异(P<0.05)。见图2。

图2 2组OS曲线
2.3 ORR 治疗后6周复查,2组ORR(CR+PR)比较无显著性差异(P>0.05)。见表2。
2.4 DCR 治疗6周后复查评价,2组的DCR(CR+PR+SD)比较无显著性差异(P>0.05)。见表3。

表2 2组ORR比较 例

表3 2组DCR比较 例
2.5 安全性评价 参照WHO《实体瘤疗效评定标准》和《急性和亚急性毒副反应评定标准》,2组毒副反应均较轻,治疗组出现11例皮疹,4例腹泻,均为Ⅰ~Ⅱ度,无口腔溃疡出现;对照组出现15例皮疹,10例腹泻及1例口腔溃疡,均为Ⅰ~Ⅱ度。2组毒副反应发生情况比较无显著性差异(P>0.05)。
3 讨 论
以铂类为基础的两药联合化疗被认为是PS≤2分的ⅢB/Ⅳ期NSCLC的标准治疗方案,晚期中位生存时间多在6.9~11.3个月[4],且化疗后各种毒副反应如骨髓抑制、恶心呕吐等症状出现频率较高。尽管很多临床研究将不同的单药、两药或三药的各种化疗方案运用到NSCLC的治疗中,但临床仍难以使患者获得更大的益处。而如通过增加化疗药物的剂量或疗程的治疗方案却进一步导致化疗后的毒性增加,生活质量下降,生存时间仍未获得改善[5]。
随着生物科技的发展,21世纪已成为分子靶向药物治疗肿瘤的新时代,尤其对于约占肺癌80%的NSCLC来说,靶向治疗已成为EGFR基因突变型患者的一种必不可少的治疗策略。40%~80%的NSCLC中,EGFR基因过度表达[6],EGFR在肺癌的发生发展过程承担重要作用,与肿瘤的生长、增殖、运动、黏附、侵袭、凋亡和转移等密切相关[7]。
靶向治疗的代表药物吉非替尼的问世为晚期NSCLC提供了一条新的出路,在IPASS研究中,EGFR突变率可达59.7%[8],疗效较化疗提高。研究证实在PS 0~2分、EGFR突变型NSCLC患者中一线使用吉非替尼的疗效优于传统的含铂两药化疗方案[1]。一项关于吉非替尼治疗晚期NSCLC的 Meta分析对 1978—2008年关于 IDEAL、INTACT1、INTACT2等全球8个全球大型随机对照研究及我国36个无对照的临床研究结果进行综合评价,结果显示吉非替尼作为NSCLC的联合一线治疗、三线治疗方案均未提高客观缓解率、延长生存期;吉非替尼作为二线治疗方案时,相比安慰剂有较高的客观缓解率和稍高长的1 a生存率,但未能延长患者的总生存时间,同时毒副反应高于安慰剂组[9]。IPASS试验中吉非替尼与多烯紫杉醇比较的随机临床研究结果表明,吉非替尼作为NSCLC二线治疗可以取得与多烯紫杉醇相似的疗效,且提高生存质量[8]。
虽然吉非替尼在治疗中突现出使用方便、易耐受等多种优势,但在大部分临床研究中的疗效仅与标准化疗方案相当,且吉非替尼在治疗一段时间后,会出现对EGFR抑制剂耐药现象,从而导致疾病进展。同时,虽然吉非替尼较化疗而言避免了骨髓抑制等毒副反应,但仍存在以皮疹、腹泻等为主的不良反应,严重时同样影响到患者的生活质量。因此,如何延缓吉非替尼出现耐药的时间从而提高疗效以及如何减轻皮疹、腹泻等毒副反应成为一个亟待解决的难题。
中医药治疗正在作为一种极有特色的全身治疗方法被全球所关注。扶正抗癌方是广东省中医院吴万垠教授根据中医对肺癌病因病机的认识,结合长期的临床经验及肺癌的发病特点总结出来的经验方。中医认为,肺癌多由于机体正气亏虚,脏腑阴阳失调,外邪毒气乘虚入肺,邪毒滞于肺,致肺失宣肃,气机郁滞,血行受阻,津液失于输布,聚而为痰,痰凝气滞,血瘀毒邪胶结,日久形成肺部积块。因此,肺癌是因虚得病,因虚致实,是全身属虚,局部属实的全身性疾病,治疗应以扶正抑瘤为基本治疗原则,扶正抗癌方即是在此基础上而得。
本研究采用随机对照的研究方法,将扶正抗癌方联合吉非替尼治疗PS≤2分且EGFR基因突变型晚期NSCLC与较单药吉非替尼相比,联合用药可延长PFS和OS,而在毒副反应方面联合用药组较单药治疗组减少,但由于病例数较少,未见到统计上的显著性差异。笔者认为,本研究结果验证了扶正抗癌方联合吉非替尼治疗PS≤2分且EGFR基因突变型晚期NSCLC患者能起到增效减毒的作用,值得进一步扩大临床研究及机制探讨。
[1] Louis RA,Rajendranath R,Ganesan P,et al.First report of upfront treatment with Gefitinib in comparison with chemotherapy in advanced non-small cell lung cancer patients from south India:Analysis of 120 patients[J].Indian J Med Paediatr Oncol,2012,33(3):146-154
[2] Han JY,Park K,Kim SW,et al.First-SIGNAL:first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung[J].J Clin Oncol,2012,30(10):1122-1128
[3] Thrasse P,Arbuck SG.New guidelines to evaluate the response to treatment in solid tumors[J].Nat Cancer Inse,2000,92(3):205
[4] Fossella F,Pereira JR,Von-Pawel J,et al.Randomized,multinational,phase III study of docetaxel plus platinum combinations versus vinorelbine plus cisplatin for advanced non-small-cell lung cancer:the TAX 326 Study Group[J].J Clin Oncol,2003,21:3016 -3024
[5] Salomon DS,Brandt R,Ciardiello FR.Epidermal growthfactor-related peptides and their receptors in human malignancies[J].Crit Rev Oncol Hematol,1995,19(3):183 -232
[6] Woodburn JR.The epidermal growth factor receptor and its inhibition in cancer therapy[J].Pharmacol Ther,1995,19(3):183 -232
[7] 徐风华,郭荣荣,孙华燕.吉非替尼治疗晚期非小细胞肺癌的系统评价[J].中国循证医学杂志,2009,9(2):218-229
[8] Choi H.Critical issues in response evaluation on computed tomography:lessons from the gastrointestinal stromal tumor model[J].Curt Oncol Rep,2005,7(4):307 -311
[9] Choi H,Charnsangavej C,Faria SC,et al.Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate:proposal of new computed tomography response criteria[J].J Clin Oncol,2007,25(13):1753 - 1759
