人ENO1基因的克隆及其重组逆病毒载体ENO1-pBABE-Puro 的构建
2014-11-15李海红王秋香王海琳刘会玲祝秉东王千千朱晓艳
李海红 王秋香 王海琳 刘会玲 祝秉东 王千千 朱晓艳
近些年研究,ENO1基因在宫颈炎、CIN和宫颈癌中表达依次增强,经紫杉醇联合卡铂新辅助化疗后比较化疗前后的蛋白表达差异,发现化疗ENO1下调。这些提示ENO1可能参与了宫颈癌的发生、发展过程,可能会成为一个治疗宫颈癌的分子靶点。本实验拟构建一个真核表达载体ENO1-pBABE-Puro为后期干扰宫颈癌细胞ENO1基因表达,以及表达后与化疗药物相关性研究及ENO1基因表达调控方式及作用做准备,为研发宫颈癌抗肿瘤药物提供新思路。
1 材料与方法
1.1 材料
E.coli DH 5α 大肠杆菌、pBABE-Puro质粒为本实验室保存。人癌细胞由本实验室保存,Trizol购自TAKARA公司,DEPC水、cDNA合成试剂盒购自上海生工生物工程技术服务有限公司,DNA聚合酶购自大连宝生物工程有限公司,限制性内切酶salⅠ和BamHⅠ购自Ferments公司,DNA连接酶购自大连宝生物工程有限公司,小提质粒提取试剂盒购自大连宝生物工程有限公司,产物纯化试剂盒、DNA胶回收试剂盒购自上海生工生物工程技术服务有限公司。引物合成及基因测序由北京华大基因科技股份有限公司完成。
1.2 方法
1.2.1 人总RNA的提取及cDNA的合成 提取RNA前将所用材料用DEPC水浸泡过夜处理,100 ml的PBS加100 μl DEPC水搅拌处理,目的是防止RNA酶的干扰。将长满整瓶的人癌细胞约1×106个细胞收集到离心管中,然后按照Trizol操作说明提取细胞总RNA,应用紫外分光光度计测定浓度;取提取的RNA 5 μl按cDNA合成试剂盒说明书操作,反转录成cDNA用于后续PCR的模版。
1.2.2 PCR引物设计及合成 根据 GenBank中的烯醇化酶ENO1基因序列设计引物如下:上游5'CGC GGA TCC ATG TCT ATT CTC AAG3',下游 5'TGT CGA CTG CCC ACA GCT TAC TTG3'。引物中含有相应酶切位点的序列,引物由上海生工生物工程技术有限公司合成。
1.2.3 目的基因的扩增 以上述反转录而成的cDNA为模版,应用上述合成的引物进行PCR扩增目的基因ENO1。反应体系为:cDNA模版1 μl,上游引物1 μl,下游引物 1 μl,5 × PCR Buffer 10 μl,dNTP 5 μl,ddH2O 31 μl,总体系为 50 μl。反应条件是:95℃变性15 s,57℃退火 20 s,72℃延伸30 s,共 40 个循环,72℃延伸10 min。取100 μl PCR产物按照DNA纯化试剂盒说明书操作进行 DNA纯化。纯化后用 salⅠ和BamHⅠ进行双酶切,酶切后按照DNA胶回收试剂盒说明书进行胶回收,然后测DNA密度。
1.2.4 pBABE-Puro 逆转录病毒载体的线性化 用salⅠ和BamHⅠ各自单酶切验证质粒线性化后进行双酶切,双酶切后按照胶回收试剂盒说明书胶回收salⅠ和BamHⅠ双酶切后的 pBABE-Puro质粒,然后检测DNA浓度。胶回收产物用于后期连接使用。
1.2.5 重组逆转录病毒的构建 将胶回收后的ENO1目的基因和pBABE-Puro质粒按分子量3∶1~5∶1的体系,用T4DNA连接酶在16℃水浴锅中过夜连接。将连接好的重组质粒转化到感受态细胞E.coli DH 5α大肠杆菌中,涂在含有氨苄抗生素的琼脂LB固体培养基上,37℃过夜培养。挑取含有氨苄抗生素生长的阳性克隆菌落,置于液体LB培养基中扩增,提取质粒。
1.2.6 重组载体的酶切鉴定及序列分析 将提取好的重组质粒进行salⅠ和BamHⅠ酶切初步鉴定。然后将带有重组质粒的菌液送北京华大基因公司测序。
2 结果
2.1 目的基因的扩增、克隆及鉴定
以上述反转录合成的cDNA为模版和上海生工生物工程技术有限公司合成的引物进行PCR基因克隆。1%琼脂糖电泳结果显示,在约1 305 bp的位置出现目的条带,与预期目的条带一致,见图1。

图1 PCR产物琼脂糖电泳图
2.2 重组逆转录病毒载体的构建及鉴定
将构建好的重组质粒转化到感受态细胞E.coli DH 5α大肠杆菌中,经氨苄抗生素筛选阳性克隆扩增提取 ENO1-pBABE-Puro 重组质粒,经 salⅠ和 BamHⅠ双酶切鉴定。1%琼脂糖电泳结果显示,ENO1-pBABE-Puro重组质粒经salⅠ和BamHⅠ双酶切后出现两条条带,一条与PCR产物大小一致,一条与pBABEPuro质粒一致。说明ENO1已成功插入pBABE-Puro载体中,见图2。

图2 重组质粒 ENO1-pBABE-Puro经salⅠ和BamHⅠ双酶切电泳图
2.3 序列测定
将经salⅠ和BamHⅠ双酶切鉴定为阳性的菌液送往北京华大基因公司测序。测序结果与GenBank中公布的人ENO1基因序列完全一致,见图3。
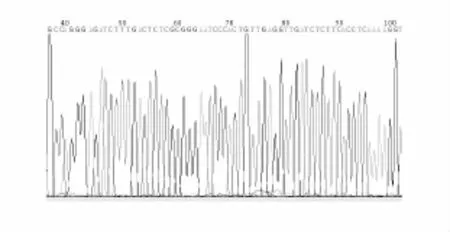
图3 重组质粒ENO1-pBABE-Puro部分测序图
3 讨论
德国生理学家Otto.Warburg早在1924年就提出了Warburg效应的观点,即恶性肿瘤细胞即使在氧气充足的条件下,恶性肿瘤细胞仍有活跃的糖酵解代谢过程。Warburg效应的提出,是糖酵解代谢过程一度成为肿瘤研究的热点。特别是近年认为Warburg效应是肿瘤的重要特征之一[1],而且由于在临床上正电子发射断层显影(PET)技术利用Warburg效应来诊断、发现恶性肿瘤的应用,使糖酵解代谢过程在肿瘤中的研究更受瞩目。近些年研究探索,通过靶向糖代谢途径中的一个或多个关键酶或其他分子来治疗恶性肿瘤的策略备受关注。ENO1是糖酵解途径的关健酶,它的基因的表达及在细胞中的定位对肿瘤的影响非常重要,因此对它的研究就显得非常必要。
ENO1 又称 α-烯醇化酶(α-enolase)、非神经烯醇化 酶 (non-neural enolase),基 因 位 于 1q36.3-1q 36.2[2],此基因编码 α 亚基,还有 2个烯醇化酶基因ENO2(enolase-2)、ENO3(enolase-3)分别编码 γ、β 2个亚基。α、γ、β这3种亚基以非共价键结合形成αα、αβ、αγ、ββ、γγ 5种结构形式,一般 αα 型即 ENO1 存在于绝大多数组织中;ββ 型即 β-烯醇化酶(β-enolase)几乎只存在肌肉组织中;γγ型特异性存在于神经元和神经内分泌细胞中,成为神经母细胞瘤及具有神经内分泌作用的小细胞肺癌的肿瘤标志物[3-4]。ENO1基因转录物含有2个编码起始位点翻译2种蛋白即37 ku 的蛋白 c-myc 启动子结合蛋白(c-myc promoter binding protein,MBP-1)和48 ku 的 ENO1。ENO1 含有433个氨基酸,这两个相同的αα亚基每个亚基的相对分子量约47 000;镁离子是维持ENO1二聚体结构稳定性和最大活性的重要辅因子。
长期以来认为ENO1是一个古老、保守、功能单一的蛋白,但最近十几年的研究发现ENO1不仅只是一个糖酵解过程中的关健酶催化磷酸甘油酸向磷酸烯醇式丙酮酸的转化,还是一个参与多种生理、病理过程的蛋白[5],随细胞的生理、病理、代谢和发育状况的不同ENO1基因的表达有明显差异。而且在细胞的胞核、胞质及包膜中都有表达[6]。ENO1在细胞中不同位置的定位有相对主要的功能。主要定位于胞核中的是ENO1 基因编码的 MBP-1[7],它虽然不具有糖酵解酶的活性,但能与c-myc p2启动子结合,负向调控c-myc的表达[8]。原癌基因 c-myc是控制细胞周期、调节细胞增殖与分化的一个重要基因,在多种肿瘤的发生、发展过程中c-myc基因产物表达异常促进肿瘤细胞的发生。Ghosh等[9]通过腺病毒将 MBP-1导入前列腺癌后,可诱导细胞凋亡。MBP-1可抑制胃癌细胞的增值[9];Ejeskär[10]将 ENO1 转染 1q 缺失的成神经细胞后,瘤细胞生长明显被抑制;Ghosh[11]、Chang 等[12]学者发现,在非小细胞肺癌中ENO1表达普遍下调,且表达下调者预后差。这些研究证实定位于胞核的MBP-1具有抑制肿瘤细胞生长的作用,如宫颈癌、乳腺癌。但近年研究结果却与之相反,主要因为定位于胞质中ENO1是作为糖酵解的关健酶存在的,肿瘤细胞由于生长速度快,血供相对不足,肿瘤细胞长期处在缺氧的环境中,而且由于生长过快,细胞合成、生长所需能量增多。因此定位于胞质中的ENO1在肺癌、结肠癌、胃癌、乙肝病毒相关的肝癌、鼻咽癌、甲状腺嗜酸细胞瘤和黑色素细胞瘤等肿瘤中表达增高[13-18],且 ENO1与肿瘤的大小、分化程度、预后差有相关性。其在慢性宫颈炎、CIN和宫颈癌ENO1表达逐渐增强[19]。定位于细胞膜表面的ENO1起着纤溶酶原受体的作用,参与结合、活化、稳定纤溶酶原以及肿瘤细胞的侵袭和转移[20-21]。而且细胞膜上表达的ENO1增高可以增强单核巨噬细胞的侵润能力,提高穿透基质的能力,还可能通过Notch信号通路控制c-myc癌蛋白的表达,参与肿瘤的形成过程[21]。有相关报道证实,细胞膜上的ENO1基因的表达与恶性肿瘤细胞的转移呈正相关。
ENO1与宫颈癌的研究国内外极少见,然而仍有相关报道提示,ENO1在宫颈癌中不仅在慢性宫颈炎、CIN、宫颈癌3组病变中ENO1蛋白的表达逐渐增强,且ENO1的表达与患者年龄、肿瘤病理分级及有无淋巴结转移等临床病理学特征无明显差异。但在肿瘤分化中,分化越低,核表达越少,其差异有显著性。这提示在宫颈癌中分化越低,能调控抑制 c-myc蛋白的MBP-1可能减少了[19]。可见 ENO1基因的表达对宫颈癌有重要作用。但由于ENO1与宫颈癌相关性的研究国内外极少见,因此在宫颈癌中肿瘤细胞是如何调控ENO1在细胞中的分布、作用使正常细胞胞核中多抑癌作用的MBP-1向肿瘤细胞胞核外的ENO1转化,以及ENO1表达对宫颈癌细胞化疗的影响,有待进一步研究。综上所述,构建一个含有ENO1基因的真核表达载体非常有必要。pBABE-Puro载体是来源于莫洛尼鼠类白血病病毒,性质稳定,对细胞毒性小,能够稳定的表达外源目的基因及不影响其正常的功能,而且pBABE-Puro载体有很高的转染效率,因此广泛应用于某些蛋白功能的研究。本实验经过酶切初步鉴定及测序的最终鉴定证实,成功构建了ENO1的真核表达载体ENO1-pBABE-Puro。为研究ENO1在肿瘤中作用和与宫颈癌细胞化疗之间的相关性做好准备。ENO1可能成为宫颈癌分子靶向治疗的一个靶点。
[1]Hanahan D,Weinberg RA.Hallmarks of Cancer:The Next Generation〔J〕.Cell,2011,144(5):646-674.
[2]Onyango P,Lubyova B,gardellin P,et al.Molecular cloning and expression analysis of five novel genes in chromosome 1 p36〔J〕.Genomics,1998,50(2):187-198.
[3]Bogusz Trojanowicz,Cuong Hoang-Vu,Carsten Sekulla,etal.ENO1(Enolase 1,(alpha))〔J〕.Atlas Genet Cytogenet Oncol Haematol,2010,14(7):635-640.
[4]韩娜娜,孙长岗,武 君.血清肿瘤标志物检测在肺癌中的临床价值〔J〕.实用癌症杂志,2012,27(2):141-143.
[5]Pancholi V.Multifunctional alpha-enolase:its role in diseases〔J〕.Cell Mol Life Sci,2001,58(7):902-920.
[6]Sousa LP,Brasil BS,Silva Bde M,et al.Characterization of alpha-enolase as an interferon-alpha 2 alpha 1 regulated gene〔J〕.Front Biosci,2005,10:2534-2547.
[7]Wang W,Wang L,Endoh A,et al.Identification of alphaenolase as a nuclear DNA-binding protein in the zona fasciculate but not the zona reticularis of the human adrenal cortex〔J〕.J Endocrinol,2005,184(1):85-94.
[8]Hsu KW,Hsieh RH,Wu CW,et al.MBP-1 Suppresses G-rowth and metastasis of Gastric Cancer Cell through COX-2〔J〕.Mol Biol Cell,2009,20(24):5127-5137.
[9]Ghosh AK,Steele R,Ray RB.C-myc promoter-bingding protein1(MBP-1)regulates prostate cancer cell growth by inhibiting MAPK pathway〔J〕.J Bio Chem,2005,280(14):14325-14330.
[10]Ejeskär K,Krona C,Carén H,et al.Introduction of in vitro transcribed ENO1 mRNA into neuroblastoma cells induces cell death〔J〕.BMC Cancer,2005,5:161.
[11]Ghosh A,Steele R,Ryerse J,et al.Tumor-suppressive effects of MBP-1 in non-small cell lung cancer cells〔J〕.Cancer Res,2006,66(24):11907-11912.
[12]Chang YS,Wu W,Walsh G,et al.Enolase-a is frequently down-regulated in non-small cell lung cancer and predicts aggressive biological behavior〔J〕.Clin Cancer Res,2003,9(10):3641-3644.
[13]Chang GC,Liu K J,Hsien CL,et al.Identification of alphaenolase as an antoantigen in lung cancer.Its overexpression is associated with clinical outcomes〔J〕.Clin Cancer Res,2006,12(19):5746-5754.
[14]张 莹,李 敏,刘 宇,等.非小细胞肺癌患者肿瘤组织和外周血血浆中ENO1蛋白水平分析〔J〕.中国肺癌杂志,2010,13(12):1089-1093.
[15]Baris O,Savagner F,Nasser V,et al.Transcriptional profiling revrals coordinated up-regulation of oxidative metabolism genes in thyroid oncocytic tumors〔J〕.J Clin Endocrinol Metab,2004,89(2):994-1005.
[16]SuzukiA,Iizuka A,Komiyama M,et al.Identification of melanoma antigens using a Serological Proteome Approach(SERPA)〔J〕.Cancer Genomics Proteomics,2010,7(1):17-23.
[17]Bai Z,Ye Y,Liang B,et al.Proteomics-based identification of a group of apoptosis-related proteins and biomarkers in gastric cancer〔J〕.International Journal of Oncology,2010,38(2):375-383.
[18]程 超,龙孝斌,李 欣,等.α-烯醇化酶在鼻咽癌中的表达〔J〕.临床耳鼻咽喉头颈外科杂志,2011,25(12):554-556.
[19]赵时梅,罗殿中,党裔武,等.α-enolase在宫颈癌中的表达及其意义〔J〕.右江名族医学院学报,2011,33(6):749-752.
[20]Liu KJ,Shih NY.The role of enolase in tissue invasion and metastasis of pathogens and tumor cells〔J〕.J Cancer Mol,2007,3(2):45.
[21]Hsu KW,Hsieh RH,Lee YH,et al.The activated notch 1 receptor cooperates with alpha-enolase and mbp-1 in modulating c-myc activity〔J〕.Mol Cell Biol,2008,28(15):4829-4842.
