脑转移癌螺旋断层放疗剂量学特点和近期疗效分析
2014-11-15王雅棣陈点点刘清智
路 娜 王雅棣 姚 波 陈点点 刘清智
北京军区总医院放疗科 北京 100007
随着MRI的广泛应用和肿瘤患者生存期的延长,脑转移癌发生率不断升高,25%~40%的颅外恶性肿瘤在病程中将发生脑转移。全脑放疗(WBRT)是脑转移癌最有效的治疗方法之一,有效率60%~80%,中位生存期可由单纯对症处理的1~2个月提高到4~6个月[1]。但 WBRT的放疗总量对控制肿瘤病灶而言偏小,放疗后约有1/3以上的病变未达到局部控制。WBRT同步病灶局部推量与单纯WBRT相比,能否提高生存率尚有争议,但可改善脑转移癌患者的局控率、中位生存期及生存质量[2-5]。HT将直线加速器和螺旋CT整合起来,治疗时机头发出的扇形束随机架旋转对人体360°旋转照射,单次照射多达2万个子野数目使靶区的均匀性和适形度更高,并最大限度保护周围危及器官[6-7]。本文采用Tomotherapy行全脑放疗联合局部同步推量技术治疗20例脑转移癌患者,观察Tomotherapy的剂量学特征及疗效,探讨此项技术的可行性。
1 材料和方法
1.1一般资料20例经MRI证实的脑转移患者,男16例,女4例;年龄31~68岁,平均55.6岁;KPS评分60~90分,平均(65.1±6.35)分;预计生存期>3个月。全组肺癌18例(90%),乳腺癌2例(10%);肺癌中鳞癌8例,腺癌7例,小细胞癌3例。20例患者放疗前均经头颅MRI检查证实脑转移,转移灶个数1~4个,其中单发转移癌5例(25%),2个转移灶9例(45%),3个转移灶5例(25%),4个转移灶1例(5%),平均转移灶(2.1±0.85)个。脑转移灶体积1.91~29.02cm3,中位数6.53cm3。转移灶的部位于主要位于大脑半球,其次是小脑。
1.2 CT模拟定位及靶区勾画所有患者均采用仰卧位,双臂置于身体两侧,用热塑头模固定,激光定位,于Philips Brilliance CT定位机下行CT扫描,扫描范围为全脑,层厚为3mm。扫描图像经DICOMRT网络传输至ADAC Pinancle 7.6c治疗计划系统,进行靶区及危机器官的勾画。由笔者逐层勾画出脑干、垂体、眼球、晶体、视神经、内耳、颞颌关节等危及器官(OAR)。GTV为颅内可见转移灶,融合和(或)参照患者MRI增强扫描图像进行勾画,GTV均匀外扩3mm为转移灶靶区pGTV,PTVwb为全脑。
1.3治疗计划设计将所有勾画好靶区及正常器官的CT图像经DICOM RT分别传输至Hi Art Tomotherapy 3.1.2.9治疗计划系统,物理师完成Tomotherapy治疗计划后经过副主任医师审核通过后患者开始放疗。所有剂量计算均进行了组织不均匀性校正。
1.4处方剂量全脑PTVwb照射剂量为40Gy,每次2 Gy,转移灶pGTV照射剂量为60Gy,3Gy/次,5次/周。要求处方剂量覆盖95%的靶体积。依据RTOG的标准限制OAR剂量:眼球Dmax≤55Gy,晶体Dmax≤8Gy,视神经Dmax≤54Gy,垂体Dmax≤54Gy,脑干Dmax≤60Gy,内耳Dmax≤50Gy,颞颌关节Dmax≤50Gy。
1.5治疗计划评估(1)照射靶区:对全脑PTVwb和转移灶pGTV分别观察以下指标:①等剂量曲线分布;②HI:HI=D5%/D95%,即5%和95%靶区体积所受到的照射剂量之比,HI值越大表示靶区实际接受的剂量超过处方剂量越多,即剂量的均匀性越差[8-9];③UI:UI=Dmax/DRx,即靶区内的最大剂量与处方剂量之比,越接近“1”说明均匀性越好[10];④靶区的体积参数(%)V95:代表接受95%处方剂量的相应靶体积的百分数;⑤靶区的最大剂量(Dmax)、最小剂量(Dmin)和平均剂量(Dmean)。(2)危及器官:比较眼球、晶体、视神经、垂体、脑干、内耳、颞颌关节的最大剂量(Dmax)和平均剂量(Dmin)。
1.6近期疗效评价标准参照RECIST 1.0版实体瘤评价标准评价疗效:完全缓解(CR)指CT或MRI检查增强病灶完全消失;部分缓解(PR)指病灶体积缩小>50%;疾病稳定(stable disease,SD)指病灶体积缩小<50%,扩大<25%;疾病进展(PD)指病灶体积扩大>25%。生存时间从脑转移癌确诊时间到患者死亡或末次随访时间,局部控制指CT或MRI检查颅脑病灶无进展。另外观察患者的神经系统症状并进行卡氏评分,再依据RTOG/EORTC标准来评价患者的急性放射反应状况。
1.7统计学方法采用SPSS 13.0统计软件对结果进行分析,以P<0.05为差异有统计学意义,各项参数数据结果用均数(最小值~最大值)表示。
2 结果
2.1等剂量曲线分布和DVH图所有患者等剂量曲线分布满意,靶区PTVwb和pGTV剂量覆盖较完整,等剂量分布曲线能很好地包绕靶区。DVH图显示95%以上的计划靶区体积接受处方剂量,接受110%的处方剂量的体积不超过靶区体积的5%,且靶区曲线剂量梯度较为陡直,剂量梯度下降较快。见图1。
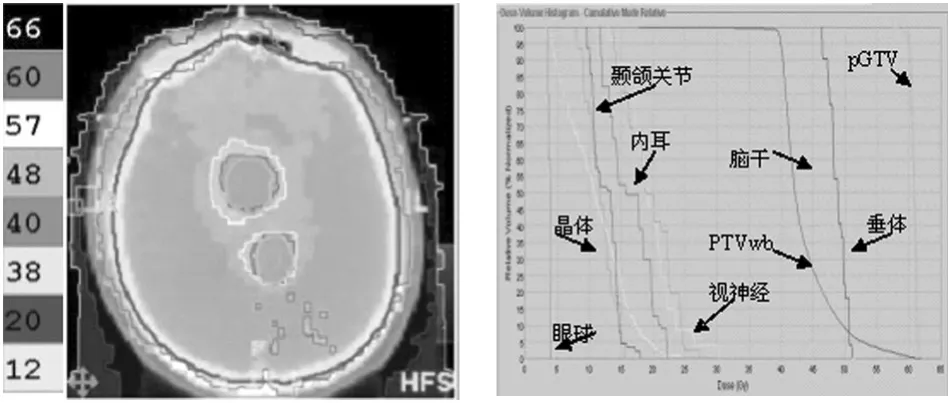
图1 治疗计划的等剂量曲线分布图和DVH图
2.2照射靶区各参数比较表1列出了照射靶区全脑PTVwb和转移灶pGTV各参数指标的均数及最小值和最大值。全脑PTVwb和转移灶pGTV的HI值分别为1.23、1.04,UI值 分 别 为 1.56、1.041,V95 值 分 别 为 99.50%、99.94%,Dmax分别为 62.84Gy、62.49Gy,Dmin分 别 为23.66Gy、60.25Gy,Dmean分别为42.96Gy、61.46Gy。
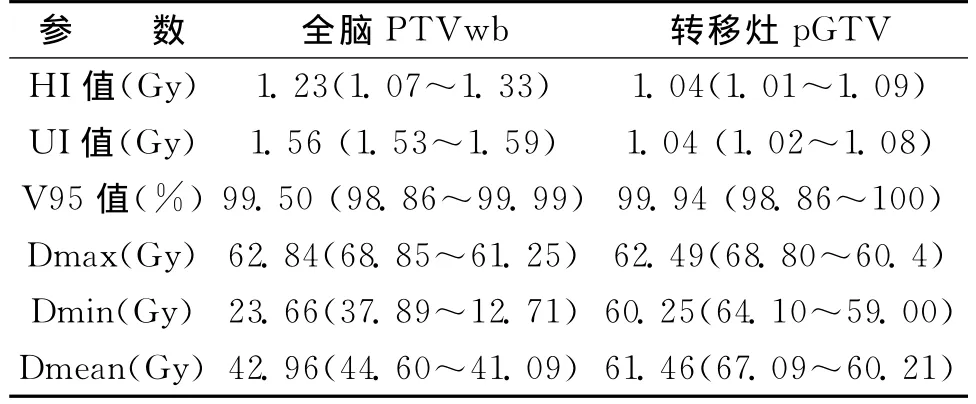
表1 靶区参数指标均数比较
2.3危及器官参数指标20例患者的治疗计划中危及器官受照射剂量均达到了处方剂量的要求。危及器官Dmax和Dmean的均数及最小值和最大值。见表2
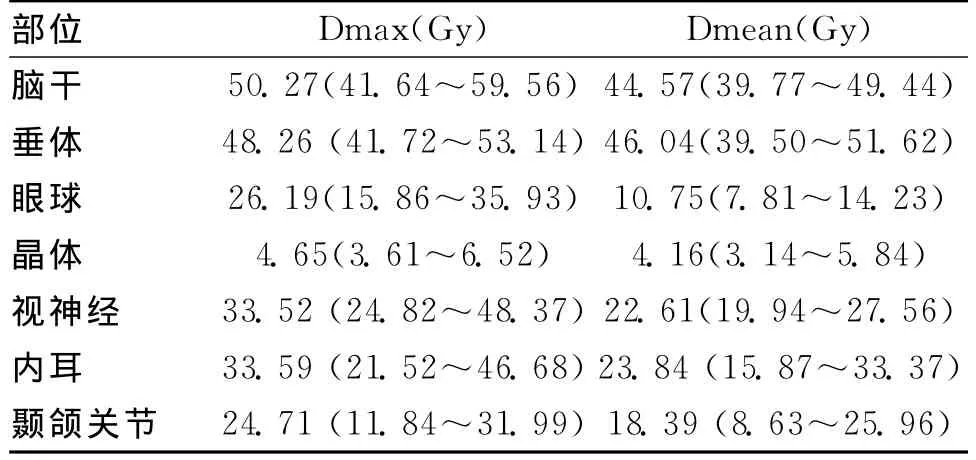
表2 危及器官参数指标均数比较
2.4近期疗效和急性放疗反应所有患者均顺利完成放疗,放疗结束时患者 KPS评分为(78.31±6.28)分,显著高于较放疗前的KPS评分(P<0.01),表明患者在治疗后生活质量有了明显提高。CR 1例(5%),PR 8例(40%),SD 10例(50%),PD 1例(5%)。总有效率(CR+PR)9例(45%),局部控制率19例(95%)。随访3~17个月,中位随访时间13个月。1a生存率60%(12例)。急性不良反应主要为Ⅰ~Ⅱ级反应,其中脑水肿16例(80%),乏力17例(85%),脱发20例(100%),听力下降13例(65%),记忆力轻度减退9例(45%),1例患者出现Ⅲ~Ⅳ级神经系统不良反应,应用甘露醇和激素等治疗后好转。
3 讨论
在脑转移癌的放疗中,常用的局部肿瘤加量的方法有立体定向放射治疗(SRT)、三维适形放疗(3DCRT)和调强放疗(IMRT)。HT是一种使用兆伏级CT图像实时引导的调强放射治疗技术,将一个6MV直线加速器安装在环形机架上,在加速器围绕治疗床360°旋转照射靶区的同时,治疗床沿轴向同步前进穿过机架[11],其临床应用日益增加。WBRT+SRT的治疗模式需按一定顺序进行,分别制定放疗计划,多发病灶患者需设计多个中心,并且SRT的剂量分割方式因病灶数目、体积、周围脏器等情况存在较大差异[12]。而采用Tomotherapy全脑放疗联合同步推量技术,可将多个靶区的治疗整合在一个计划中完成,提高转移灶的分次剂量以减少照射次数,缩短治疗时间,同时考虑不同剂量处方的相互影响,使之得到优化。Yartsev[13]和Cozzi等[14]将Tomotherapy与多种现行的放射外科进行比较,发现Tomotherapy有最好的靶区均匀性和适形指数,且不受转移灶个数及体积的限制。Alonson等[15]对10例脑转移癌患者实施全脑放疗同时局部转移灶加量并避开海马的Tomotherapy治疗研究,结果表明Tomotherapy可以达到和γ刀立体定向放疗相似或者更好的转移灶剂量的适形度,且减小Tomotherapy的铅门宽度(1.0cm),可进一步提高转移灶的剂量均匀性和适形度以及全脑的剂量均匀性并降低眼球的Dmean。候俊等[16]对多发脑转移癌进行了Tomotherapy、静态逆向调强与三维适形计划剂量学比较,结果表明Tomotherapy具有更好的靶区适形度、剂量梯度和剂量均匀性,且对3个以上转移灶患者的晶体保护更佳。Bauman等[17]对脑转移癌患者行Tomotherapy,全脑30Gy/10F,脑转移灶同步推量至60Gy/10F,治疗结束3个月后未增加中枢神经系统毒性。Kinova等[18]研究表明,用Tomotherapy行全脑放疗同步局部病灶立体定向放疗,可提高局控率,同时降低了不良反应。
本文Tomotherapy采用螺旋照射方式且照射子野多,可以保证靶区优异的适形度、均匀性和靶区覆盖度,且剂量梯度陡峭,能够在给予靶区高剂量照射的同时保护周围危及器官。本文对20例患者转移灶给予pGTV 60Gy的治疗剂量及全脑40Gy的预防剂量,急性放射不良反应临床可接受,Ⅲ级不良反应经对症支持治疗后可缓解。患者KPS评分得到改善,总有效率45%,局部控制率95%,1a生存率60%,与以往文献报道基本相似。
本文结果显示,Tomotherapy做为一种先进的放射治疗模式,使治疗计划、患者摆位和治疗过程融合为一体,可在颅内转移灶行无创、无框架的立体定向方式精确治疗的同时给予全脑照射,且不良反应可耐受,为脑转移癌的治疗开辟了一个新的平台。
[1]殷蔚伯,余子豪 .肿瘤放射治疗学[M].4版 .北京:中国协和医科大学出版社,2007:1 200-1 201.
[2]Paycheck R,Tibbs PA,Walsh JW,et al.A randomized trial of surgery in the treatment of surgery in the treatment of single metastases to the brain[J].N Engl J Med,1990,332(5):494-500.
[3]Noordijk EM,Vecht CJ,Haaxmeiche H,et al.The choice of treatment of single brain metastases should be based on extracranial tumor activity and age[J].Int J Radiat Oncol Biol Phys,1994,29(3):711-717.
[4]Eduardo W,Joao VS,Reynaldo AB,et al.Radiosurgery for brain metastases:who may not benefit[J].Int J Radiat Oncol Biol Phys,2001,51(5):1 320-1 327.
[5]Bruce B,Richard G,Simon K,et al.The palliation of brain metastases Final result of the first two studies by the Radiation Therapy Oncology Group[J].Int J Radiat Oncol Biol Phys,1980,6(1):129-132.
[6]Cozzi L,Clivio A,Bauman G,et al.Comparison of advanced irradiation techniques with photons for benign intracranial tumours[J].Rad Oncol,2006,80(2):268-273.
[7]Penagaricano JA,Yan Y,Shi C,et al.Dosimetric comparison of Helical Tomotherapy and Gamma Knife Stereotactic Radiosurgery for single brain metastasis[J].Rad Oncol,2006,1:26-31.
[8]Soisson ET,ToméWA,Richards GM,et al.Comparison of linac based fractionated stereotactic radiotherapy and tomotherapy treatment plans for skull-base tumors[J].Rad Oncol,2005,78(3):313-321.
[9]Sheng K,Molloy JA,Larner JM,Read PW.A dosimetric comparison of non-coplanar IMRT versus Helical Tomotherapy for nasal cavity and paranasal sinus cancer[J].Rad Oncol,2007,82(2):174-178.
[10]Wang X,Zhang X,Dong L,et al.Effectiveness of noncoplanar IMRT planning using aparallelized multiresolution beam angle optimization method for paranasal sinus carcinoma[J].Int J Radiat Oncol Biol Phys,2005,63(3):594-601.
[11]Mackie TR,Holmes T,Swerdloff S,et al.Tomotherapy:a new concept for the delivery of dynamic conformal radiotherapy[J].Med Phys,1993,20(6):1 709-1 719.
[12]Suh JH.Stereotactic radiosurgery for the management of brain metastases[J].N Engl J Med,2010,362(12):1 119-1 127.
[13]Fartsev S,Kron T,Cozzi L,et al.Tomotherapy planning of small brain tumours[J].Radiother Oncol,2005,74(1):49-52.
[14]Cozzi L,Clivio A,Bauman G,et al.Comparison of advanced irradiation techniques with photons for benign intracranial tumours[J].Radiother Oncol,2006,80(2):268-273.
[15]Alonso N.Gutiérrez,Ph.D,David C.Westerly,M.Sc,et al.W-hole Brain Radiation Therapy with Hippocampal Avoidance and Simultaneously Integrated Brain Metastases Boost:A Planning Study[J].Int J Radiat Oncol Biol Phys,2007,69(2):589-597.
[16]候俊,冯林春,蔡博宁,等 .脑转移癌螺旋断层放疗、调强及三维适形放疗计划的剂量学研究[J].军医进修学院学报,2012,33(4),342-347.
[17]Bauman G,Yartsev S.Fisher B,et al Simultaneous infield boost with helical tomotherapy for patients with 1to 3brain metastases[J].Am J Clin Oncol,2007,30(1):38-44.
[18]Kirova YM,Chargari C,Zefkili S,et al.Could helical tomotherapy do whole brain radiotherapy and radiosurgery [J].World J Radiol,2010,2(4):148-150.
