胰腺实性假乳头状瘤的MSCT和MRI表现
2014-11-13韩金花李兰涛王红霞
韩金花,李 雷,李兰涛,袁 芬,王红霞
(1.青岛大学医学院第二附属医院放射科,山东 青岛 266042;2.青岛大学医学院第二附属医院介入科,山东 青岛 266042)
胰腺实性假乳头状瘤(solid pseudopapillary tumor of pancreas,SPTP)是一种来源不明的少见低度恶性肿瘤,Frantz[1]在1959年首次提出,因此又称为Frantz肿瘤。肿瘤切除后多数患者可长期生存,但SPTP的影像表现与其他胰腺肿瘤相似,易误诊。现回顾性分析我院2009年8月至2013年8月15例确诊为SPTP患者的临床及影像资料,总结SPTP的MSCT和MRI特征,以提高对该病的诊断率。
1 资料与方法
1.1 一般资料 本组15例,均为女性;年龄18~43岁,中位年龄28.6岁。15例中,6例经常规体检超声发现;3例腹部疼痛不适;2例腹胀、恶心呕吐;4例触及上腹部肿块,无压痛。15例就诊时均无发热及黄疸表现,无腹部外伤和胰腺炎病史。实验室检查多无异常,11例行CT扫描,4例行MRI扫描。
1.2 仪器与方法 CT检查采用Philips Brilliance 16排CT机,扫描范围从膈顶至脐水平。扫描参数:120kV,150mA,螺距1,层厚、层均为5mm。患者在扫描前30min分2次口服含碘(1%~3%)水剂600mL,以充盈胃及十二指肠。患者均行平扫及增强扫描,增强扫描采用高压注射器自肘静脉团注对比剂优维显(370mgI/mL)80~100mL,速率为2~3mL/s,于注射后20~30s、50~70s、120s行动脉期、静脉期及平衡期屏气扫描。
MRI检查采用Siemens Vision Pius 1.5T超导型MR仪。扫描序列:AX T1WI序列正相位inphase TR 136ms,TE 4.8ms;反相位outphase TR 180ms,TE 2.4ms;AX及COR T2WI采用脂肪抑制FSE TR 6000ms,TE 90ms,层厚5mm,层距1mm;AX多期动态增强采用LAVA序列TR 3.0ms,TE 2.8ms,带宽64kHz,翻转角10°,FOV 40cm×40cm,矩阵288×200,层厚3mm,加速因子2.0;AX DWI序列 TR 6029ms,TE 96.2ms,矩阵256×256,FOV 40cm×40cm,b取0和800s/mm2。患者均行平扫及增强扫描,增强扫描采用高压注射器经肘静脉注入对比剂Gd-DTPA(剂量0.2mL/kg体质量),速率2~3mL/s,于注射后20、60、180s行动脉期、静脉期及延迟期扫描。
1.3 分型方法 肿瘤内囊性成分超过2/3为囊性型;实性成分超过2/3为实性型;介于二者之间为混合型。
2 结果
2.1 病变的部位及与周围结构的关系 15例均为单发,均位于胰腺边缘位置。胰头部5例,胰体部4例,胰尾部6例。位于胰头的肿块,可见门腔静脉、肠系膜血管及十二指肠受压移位。位于胰体、胰尾部的肿块多突出于胰腺轮廓之外,胃或部分小肠不同程度受压。胰尾部肿瘤中,1例伴有腹腔、腹膜后转移灶,1例伴肝左叶单发转移灶。15例均未见胰管及胆总管扩张。
2.2 病变的大小及形态 肿瘤直径为1.0~12.4cm,平均6.3cm。13例呈圆形或类圆形,边缘清楚锐利;2例呈分叶状,边缘欠清。
2.3 CT表现 11例行CT扫描,平扫均见胰腺区囊实性混杂密度的肿块(图1a),囊性型3例,局部可见分隔,实性型2例,混合型6例。实性部分密度略低于正常胰腺。2例实性部分中见小斑片样稍高密度的新鲜出血灶,无强化。3例病灶内见不规则斑片样钙化,其中2例钙化灶位于实性部分边缘,1例位于囊壁。增强扫描见肿瘤囊性部分无强化;9例可见强化的完整包膜,2例包膜不完整;实性部分在动脉期呈轻中度强化(图1b),静脉期呈明显强化(图1c),延迟期呈渐进性强化,但其强化程度低于正常胰腺(图1d)。
2.4 MRI表现 4例行MRI扫描,平扫示囊性型2例,混合型2例。肿瘤的囊性成分在T1WI上呈明显低信号,T2WI呈明显高信号;实性成分在T1WI上呈低或等信号,T2WI呈高或稍高信号。1例实性部分内见小片样T1WI高信号、T2WI低信号的出血。4例肿块周围均见到T1WI低信号、T2WI低信号的完整纤维包膜。增强扫描后见包膜强化,肿瘤的实性成分呈渐进性强化(图2),但其强化程度低于正常胰腺。
3 讨论
SPTP是一种少见的具有恶性潜能或低度恶性的肿瘤,约占胰腺外分泌肿瘤的1%~2%[2]。SPTP的组织起源尚不明确,肿瘤为导管、腺泡及血管瘤样分化,多数学者[3-4]认为其起源于胰腺胚胎多能干细胞。
SPTP发病率较低,好发于青少年、女性,老年女性和男性患者少见,有学者[5-6]统计患者的平均年龄为22~35岁,与本组患者相符。SPTP症状轻微且无特异性,大多无典型临床症状,可有上腹部不适或隐痛,可触及体积逐渐增大的腹部包块,多无触痛;本组中,6例常规体检超声发现,3例腹部疼痛不适,2例腹胀、恶心呕吐,4例触及上腹部肿块。肿块生长缓慢且质地较软,多发生于胰腺边缘位置,一般不会引起胆管或胰管扩张[7-11],本组均未见黄疸。文献报道[12],10%~15%的SPTP可出现局部浸润和转移,本组1例腹腔及腹膜后转移、1例肝脏转移,发生率为13.3%,与报道相符。周冰等[13]报道SPTP的实验室检查无特异性改变,本组患者实验室检查,如肿瘤标志物(CEA、AFP、CA199)、血常规、血糖及血、尿淀粉酶等多无异常,与报道相符。
SPTP的病理特点具有特征性。一般来说,肿瘤体积较大,多呈圆形或类圆形(本组13例),也可为分叶状(本组2例);多有完整的纤维包膜,本组13例可见完整包膜,2例包膜不完整,病理提示低度恶性。组织学上肿瘤由实性区、假乳头状区及两者过渡区按不同比例混合而成。镜下有实性和假乳头2种排列方式。实性区内,瘤细胞围绕血管呈斑片状、巢状排列;假乳头区由环绕纤维血管轴心的分枝状乳头组成,具有一定的特征性,纤维血管轴心可见明显的黏液变性、坏死与出血,多数无周围组织浸润。
SPTP的MSCT及MRI表现与其病理密切相关,取决于肿瘤囊实性成分的比例和分布,可将肿瘤的影像学表现分为囊性型(本组5例)、混合型(本组8例)和实性型(本组2例)。囊性部分由坏死、液化、陈旧性出血构成,但囊变、坏死与瘤体大小无关。囊性型和混合型多表现为实性部分呈小片状或有附壁结节,中高度强化,漂浮在低密度的囊性部分中,称为“浮云征”,具有一定的特征性。“渐进性强化”是SPTP的特征性影像表现之一,肿瘤的实质部分在动脉期呈轻中度强化,静脉期略高于动脉期,延迟期持续强化,实性成分与假乳头状成分的过渡区形成假菊形团,相对较少的肿瘤细胞呈网状排列,形成血窦,因此类似于海绵状血管瘤的强化方式[13],但强化程度均低于正常组织,本组均与此相符。肿瘤的实性成分由细胞丰富的实性瘤巢构成,含小血窦,易发生出血,本组3例;另有报道[14-15]称30%的SPTP可见钙化,本组3例。MSCT可清楚显示钙化,但对陈旧性出血显示不敏感;MRI对钙化显示不敏感,但对显示肿瘤内部不同组织结构(肿瘤内部出血、囊性变及包膜等)有一定优势。
SPTP应与以下胰腺疾病相鉴别:①无功能性胰岛细胞瘤,常见于年轻女性,可无血糖异常症状,组织学上与SPTP实性区也很相似。瘤内可见斑片状或不规则钙化。富血供肿瘤,常无包膜,动脉期明显强化,增强扫描呈持续性强化,且高于周围正常组织。②浆液性囊腺瘤,肿块呈卵圆形或分叶状,边界清楚,肿块密度从水样到肌肉样密度不等,中央可见条片状不规则钙化或特征性日光放射状钙化。血供丰富,分隔内有广泛的毛细血管网,肿瘤可明显强化呈“蜂窝状”肿物。有学者[16]报道,肿瘤中心瘢痕与蜂窝样囊肿为浆液性囊腺瘤的特征表现。③黏液性囊腺瘤或囊腺癌,多见于中老年女性,原发单个大囊或数个小囊,囊内可见线样或弧状分隔;多有囊壁,厚薄不一,可见壁结节,此为特征性表现。增强扫描后囊壁、壁结节及囊内分隔有强化。囊腺癌病变周围可有侵犯,肿瘤标志物较高。④胰腺癌囊变,发病年龄较大,多见于老年男性。乏血供肿瘤,增强扫描后肿瘤强化不明显,恶性度高、浸润性强,肿块边缘模糊,常侵犯周围结构,出现转移。位于胰头部的胰腺癌常伴有胰管扩张。⑤胰腺假性囊肿,常有胰腺炎或外伤手术病史,囊壁薄、均匀且无钙化,无壁结节。囊内少有分隔,无分叶状结构,囊内密度均匀,常可伴有胰管串珠状扩张和钙化。当假性囊肿内有出血、感染、坏死组织或囊壁增厚时,鉴别困难,需依靠活检确定诊断。
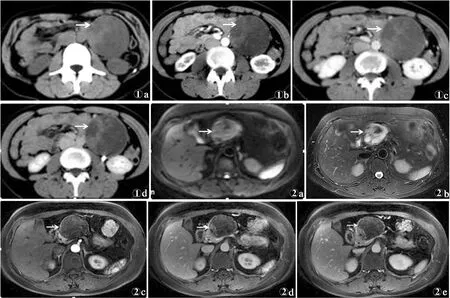
图1 女,30岁,胰尾部实性假乳头状瘤图1a CT平扫示胰腺尾部后下方囊实性肿块,边界清楚(箭头),实性部分CT值36HU,囊性部分CT值24HU图1b CT增强扫描动脉期示实性部分CT值55HU,呈“浮云征”(箭头),囊性部分CT值26HU图1c CT增强扫描静脉期示实性部分CT值65HU,囊性部分CT值25HU(箭头)图1d CT增强扫描延迟期示实性部分CT值79HU,但强化程度各期均低于正常胰腺,囊性部分CT值25HU,包膜完整,有强化(箭头) 图2 女,24岁,胰头部实性假乳头状瘤图2a DWI可见肿瘤呈高信号,病灶边缘见斑片样低信号(箭头) 图2b FS T2WI见肿瘤以高信号为主,内见斑片样、分隔样低信号,周围包膜完整、为低信号,边界清楚(箭头)图2c~2e MRI增强扫描示肿瘤实性部分呈渐进性、延迟性强化,包膜强化明显(箭头)
[1]Frantz VK.Tumor of the pancreas,in anonymous atlas of tumor pathology[M].7th ed.Washington DC:Armed Forces Institute of Pathology,1959:32-33.
[2]白人驹,张雪林,孟悛非,等.医学影像诊断学[M].3版.北京:人民卫生出版社,2012:415.
[3]刘志敏,高剑波,郭华,等.多层螺旋CT对胰腺实性假乳头状瘤的诊断价值[J].临床放射学杂志,2011,30(3):428-430.
[4]龚蓉,韩国武.胰腺实性假乳头状瘤的CT表现[J].实用医学影像杂志,2011,12(5):294-296.
[5]Mancini GJ,Dudrick PS,Grindstaff AD,et al.Solid-pseudopapillary tumour of the pancreas:two cases in male patients[J].Am Surg,2004,70:29-31.
[6]苏宇征,孙斌,薛蕴菁,等.胰腺实性假乳头状瘤的CT和MRI诊断[J].中国CT和 MRI杂志,2010,8(2):37-40.
[7]吴春华,谢道海.胰腺实性假乳头状瘤的CT表现[J].中国中西医结合影像学杂志,2013,11(1):49-50.
[8]唐钢琴.胰腺实性假乳头状瘤CT表现及鉴别诊断(附12例分析)[J].中国医师杂志,2011,13(1):119-121.
[9]王冉,周建军,陈建新.胰腺实性假乳头状瘤MSCT双期扫描的诊断价值[J].中国中西医结合影像学杂志,2011,9(1):35-37.
[10]林增如,董锵,邓春红.胰腺实性假乳头状瘤的CT诊断[J].中国CT和 MRI杂志,2011,9(3):46-48.
[11]龙威.64层螺旋CT对胰腺实性假乳头状瘤的诊断价值[J].中国中西医结合影像学杂志,2012,10(1):32-34.
[12]Sperti C,Berselli M,Pasquali C,et al.Aggressive behaviour of solid pseudopapillary tumor of the pancreas in adults:a case report and review of the literature[J].World J Gastroenterol,2008,14:960-965.
[13]周冰,王省白,陆黎明,等.胰腺实性假乳头状瘤的CT及 MRI诊断[J].医学影像学杂志,2012,22(1):94-96.
[14]Buetow PC,Buck JL,Pantongrag-Brown L,et al.Solid and papillary epithelial neoplasm of the pancreas:imaging-pathologic correlation on 56cases[J].Radiology,1996,199:707-711.
[15]胡敏霞,赵心明,罗巍.胰腺实性假乳头状瘤的多层螺旋CT表现与病理对照[J].中国医学影像技术,2010,26(7):1277-1280.
[16]詹茜,邵成伟,吕桃珍,等.胰腺浆液性囊腺瘤的 MRI特征[J].医学影像学杂志,2012,22(7):1154-1157.
