水热法制备 LiNi0.5 Mn1.5 O4 及其电化学性能的研究
2014-11-09孙才能童庆松李秀华黄行康
孙才能,童庆松,李秀华,黄行康
(福建师范大学化学与化工学院,福建福州350007)
锂离子电池广泛应用于社会各个领域,如汽车、国防、航空.锂离子电池的比容量、稳定性、导电性和安全性主要取决于正极材料,所以目前众多学者致力于研发各种正极材料.最早商业化的锂离子正极材料LiCoO2[1]具有较好的稳定性,但由于钴价格昂贵且对环境的有害性,其他正极材料正试图取而代之.LiMn2O4[2]和 LiFePO4[3]的价格相对较低,对环境危害小且资源丰富,但它们的工作电压较低.近年来广受关注的 LiNi0.5Mn1.5O4正极材料,其放电电压平台约为 4.7 V[4-6],在电动汽车的高电压应用时可以减少电池串联数量,从而降低电池单体一致性的难度,有利于提高能量密度.目前,LiNi0.5Mn1.5O4材料的制备方法主要为固相法[7].该方法操作简单,容易大批量生产,但在制备过程中容易产生镍锰氧杂相,影响材料的电化学性能.除固相法外,采用熔盐法[8]、模板方法[9]和自燃法[10]均能得到较为纯相的LiNi0.5Mn1.5O4,表现出良好的电化学性能.此外,溶胶-凝胶法[11]、共沉淀法[12]、喷雾干燥法[13]、超声辅助共沉淀法[14]、电泳沉积法[15]等方法也被应用于合成 LiNi0.5Mn1.5O4,但采用水热法合成LiNi0.5Mn1.5O4材料的报道较少.Huang[6]通过水热法合成 LiNi0.5Mn1.5O4材料,放电比容量比较低,循环性能较差.在本文通过水热法合成该材料,对材料进行热处理后,全面提高了放电容量比和循环性能,并系统地研究水热条件对 LiNi0.5Mn1.5O4电化学性能的影响.
1 实 验
1.1 材料制备
配制浓度为0.159、0.162、0.165、0.169 g·mL-1的LiOH溶液各15 mL.将溶液逐滴地加入盛有0.007 5 mol MnSO4·H2O,0.002 5 mol NiSO4·H2O,0.007 5 mol(NH4)2S2O8的反应釜内衬中,再放入鼓风干燥箱中180℃下恒温24 h.经抽滤后,把抽滤得到沉淀放于鼓风干燥箱120℃下恒温24 h得到样品.根据LiOH溶液浓度的差别,把样品命名为 SRKB1、SRKB2、SRKB3、SRKB4.然后把得到的样品放在管式炉中空气气氛下,850℃恒温热处理24 h.将热处理后的样品命名为SRYB1、SRYB2、SRYB3、SRYB4.
1.2 材料表征
采用粉末X射线衍射仪(Philips PANalytical X’Pert,荷兰)测试样品的XRD衍射数据,以Cu Kα靶衍射,采用高能探头,连续扫描方式采样,0.016 7°/步,每步停留8 s,扫描范围为10°~80°.采用7500F型扫描电子显微镜(SEM)(JEOL,日本)观测样品形貌,测试电压为5.0 kV.
1.3 扣式电池组装及电化学性能测试
按活性物质:乙炔黑:聚偏氟乙烯(PVDF)的质量比为8 1 1的比例混合,加入适量N-甲基吡咯烷酮(NMP)后,球磨混合均匀,将浆料均匀地涂覆在铝片上,制得正极片.在充满氩气手套箱中,将金属锂负极、Celgard2400聚丙烯隔膜、正极片、电池壳及电解液按文献方法组装成CR2025型扣式电池.电解液为含1.0 mol·L-1LiPF6的EC和DEC的混合溶液(EC DEC的重量比为1 1).采用新威电池测试系统(深圳)测试电池的充放电性能.温度为:30 ±1℃,电压范围:3.0 ~4.9 V,电流范围:0~10 mA.应用电化学工作站CHI660B(上海辰华仪器有限公司)测定循环伏安曲线(扫描速率为0.5 mV/s)和交流阻抗(交流电幅值5 mV,频率范围0.1~10 000 Hz).本文的样品都在1C的条件下充放电循环(140 mAh·g-1).
2 结果与讨论
2.1 XRD 分析
图1为采用水热法制备经过850℃热处理样品的X 射线衍射图.如图所示,样品 LiNi0.5Mn1.5O4具有尖晶石典型的衍射峰[6],属于立方晶系空间点群的面心立方结构.由图可见,样品SRYB1、SRYB2、SRYB3、SRYB4 的2θ 位置及衍射峰的特征与PDF标准卡片JCPDS 80-2162的2θ位置及衍射峰的特征一致.但样品锂量的变化对晶面(111)(311)和(400)衍射峰的强度有明显的影响,这表明加入的锂量对这四个样品的结晶度都有明显的影响.样品SRYB2的衍射峰与PDF标准卡片JCPDS80-2162的特征峰的相对强度最接近.表1为经过850℃热处理样品的晶胞参数,从表1中可看出,样品SRYB2的晶胞参数与JCPDS80-2162的最为接近.其他样品的晶胞参数也与标准卡片JCPDS80-2162对比差距相对较大,该样品晶胞体积越接近理论值,结构越稳定,越利于承受充放电时锂离子嵌入和脱出的影响.
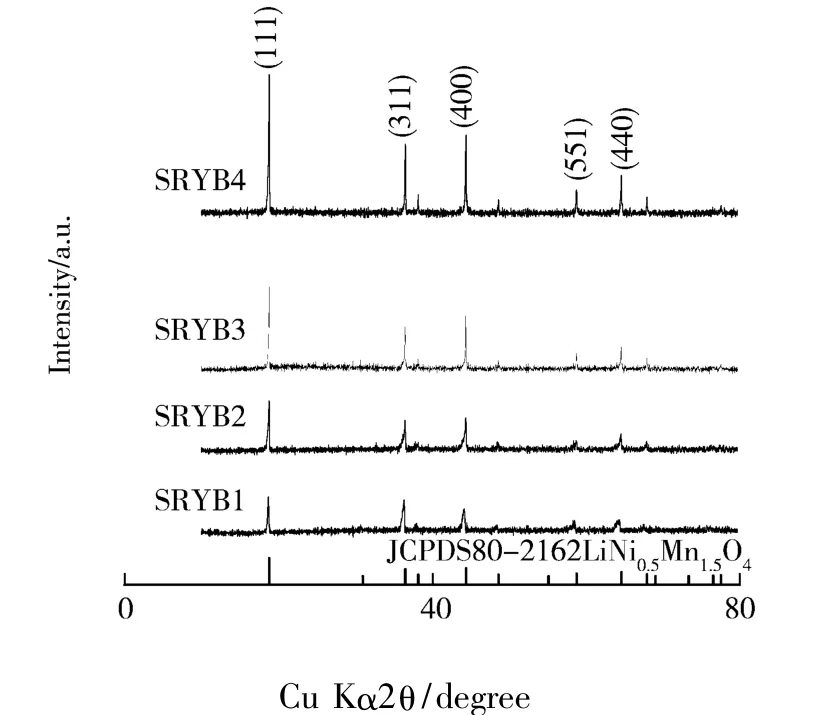
图1 经过850℃热处理X射线衍射图谱
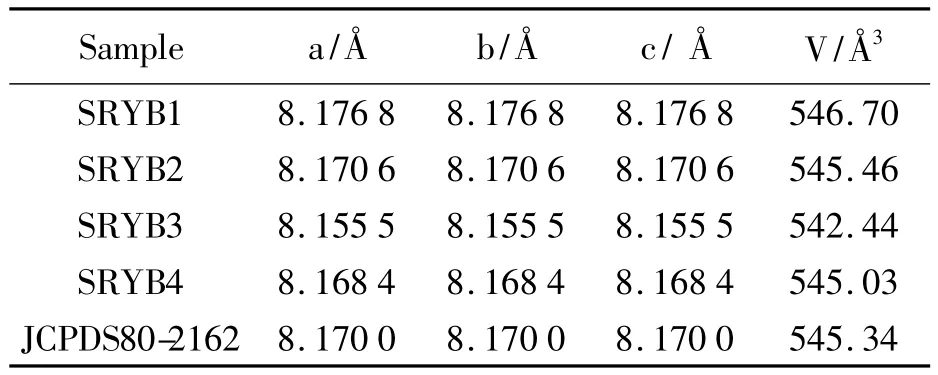
表1 经850℃热处理样品的晶胞参数
2.2 形貌观察
图2为采用水热法制备的 SRYB1、SRYB2、SRYB3、SRYB4 样品 LiNi0.5Mn1.5O4的 SEM 图.从图中可看出,样品SRYB2的粒径较小,且颗粒分布更均匀.材料粒径细小、分布均匀、比表积大有利于锂离子的迁移及嵌入.所以SRYB2样品的颗粒分布更均匀,结晶度比较好.


图2 SRYB1、SRYB2、SRYB3、SRYB4 样品的 SEM 图
2.3 电化学性能
图 3 为不同锂量的样品 LiNi0.5Mn1.5O4在不同循环周次的充放电曲线图.
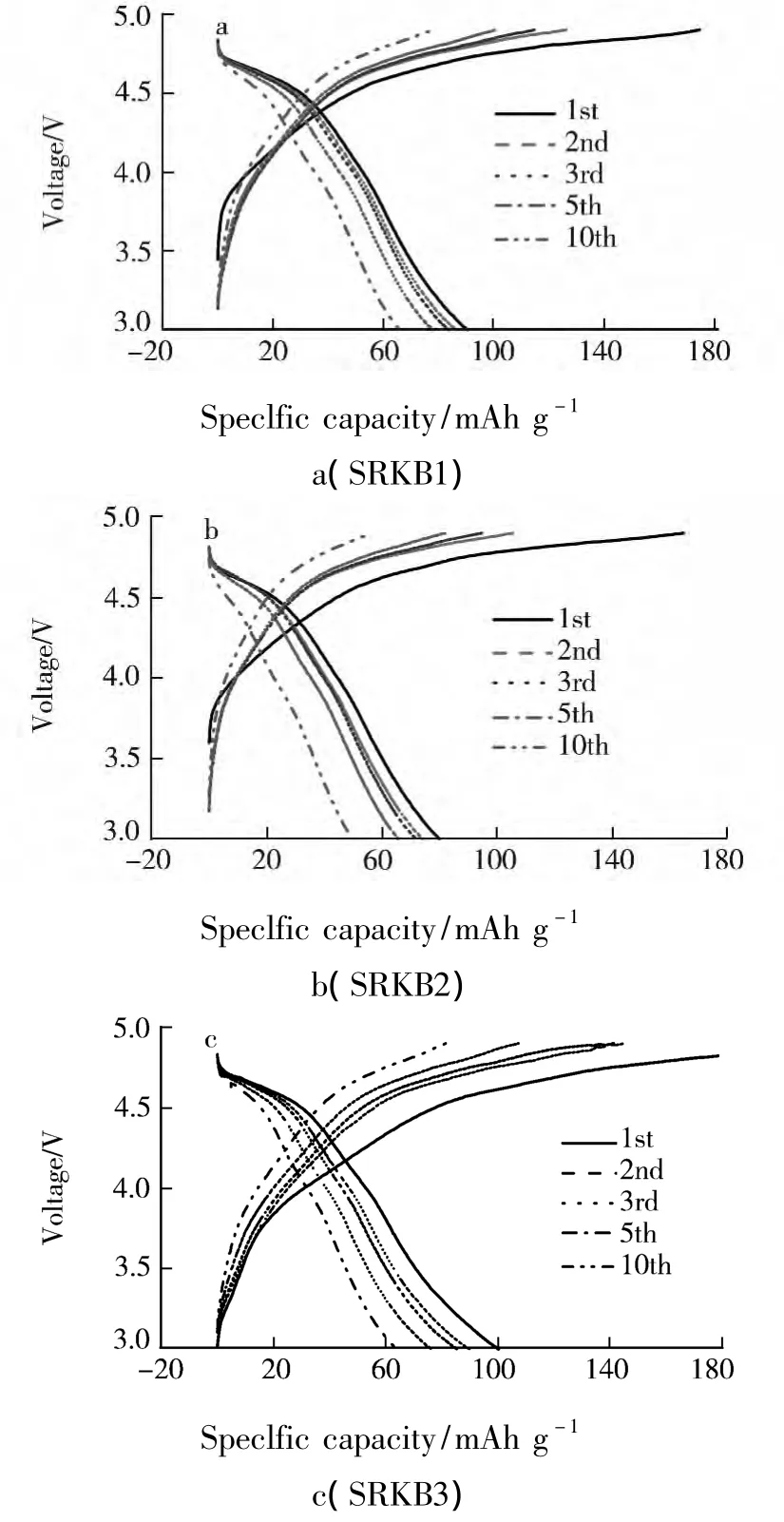
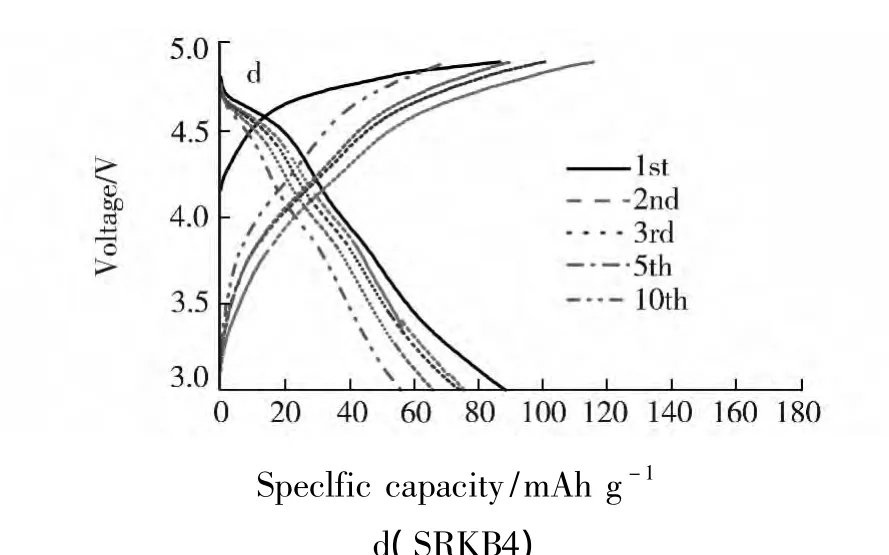
图3 LiNi0.5 Mn1.5 O4的首次及第10周的充放电曲线
图3b为当LiOH溶液为0.162 g·mL-1时,在180℃下水热反应得到样品的充放电曲线,由该曲线可知4.2 V以上放电电压平台比例较少,而且衰减较快,4.7 V放电电压平台表明有LiNi0.5Mn1.5O4相存在,但其含量不高,说明合成材料中的很多锰离子以+3方式存在.随着LiOH溶液用量增加,由图3d可发现,4.7 V放电电压平台比例在下降,说明合成材料中的大部分锰离子以+3方式存在,LiNi0.5Mn1.5O4相减少,电化学性能变差.
图4为经过850℃热处理样品LiNi0.5Mn1.5O4不同循环周次的充放电曲线图.由图4a可知,经过热处理,尖晶石 LiNi0.5Mn1.5O4的放电曲线存在4 V和4.7 V两个放电电压平台,其中,4 V放电电压平台主要源自4 V 尖晶石相[2,6].并且经过热处理后,与图3a比较可发现,4.7 V的放电电压平台比例大大增加,只有少量的4.0 V放电电压平台,说明合成材料中的大部分锰离子是以+4的形式存在,该样品的充放电性能大大提高.由图4b可知,随着LiOH溶液用量增加,样品放电比容量也随着增加.SRYB2样品首次放电比容量为111 mAh·g-1,并且4.7 V放电电压平台比例变大,说明加入 LiOH·H2O 的量对合成 LiNi0.5Mn1.5O4材料中锰离子价态影响很大,增加了Mn4+的存在,得到较纯净的 LiNi0.5Mn1.5O4材料.由图 4c 可知,随着LiOH溶液用量增加,样品放电比容量下降,首次放电比容量为101 mAh·g-1,并且4.7 V放电电压平台比例变小.由图4d可知,随着LiOH溶液用量进一步增加,该样品放电比容量进一步下降,首次放电比容量为95 mAh·g-1,说明LiOH用量已过量,产生了Mn3+,导致SRYB4样品的放电比容量下降,电化学性能变差.综上所述,随着LiOH溶液用量增加,样品的放电比容量呈现先增加后减小的规律.所以加入LiOH溶液为 0.162 g·mL-1合成 LiNi0.5Mn1.5O4材料的电化学性能最好.
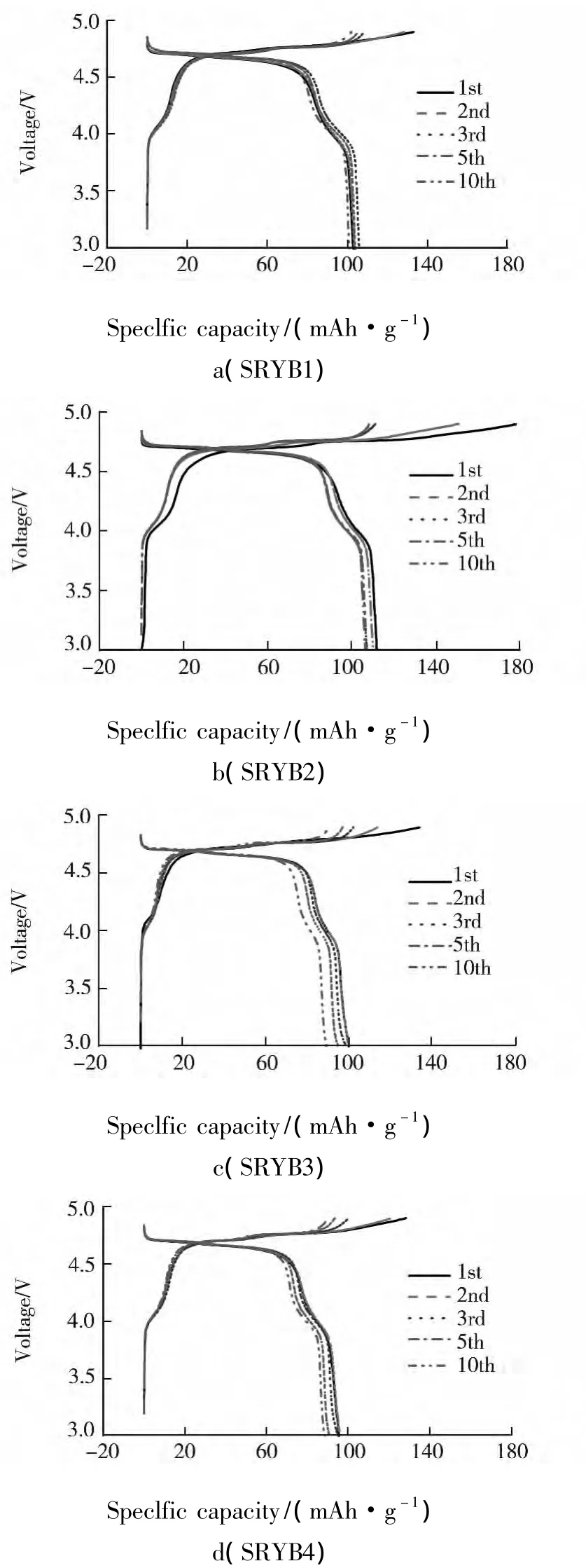
图4 LiNi0.5 Mn1.5 O4不同循环周次的充放电曲线
图 5 展 示 了 不 同 锂 量 的 LiNi0.5Mn1.5O4的150循环寿命曲线.由图可知,SRYB1、SRYB2、SRYB3、SRYB4 分别对应加入2.38、2.43、2.48 g、2.53 g LiOH·H2O的样品,经150周充放电循环后,容量衰减率分别为 5.1%、4.5%、11.9%、10.4%.可以看出SRYB2样品的首次放电比容量为111 mAhg-1,且经过了充放电150循环,SRYB2样品表现出优越的充放电循环性能,衰减率最低.
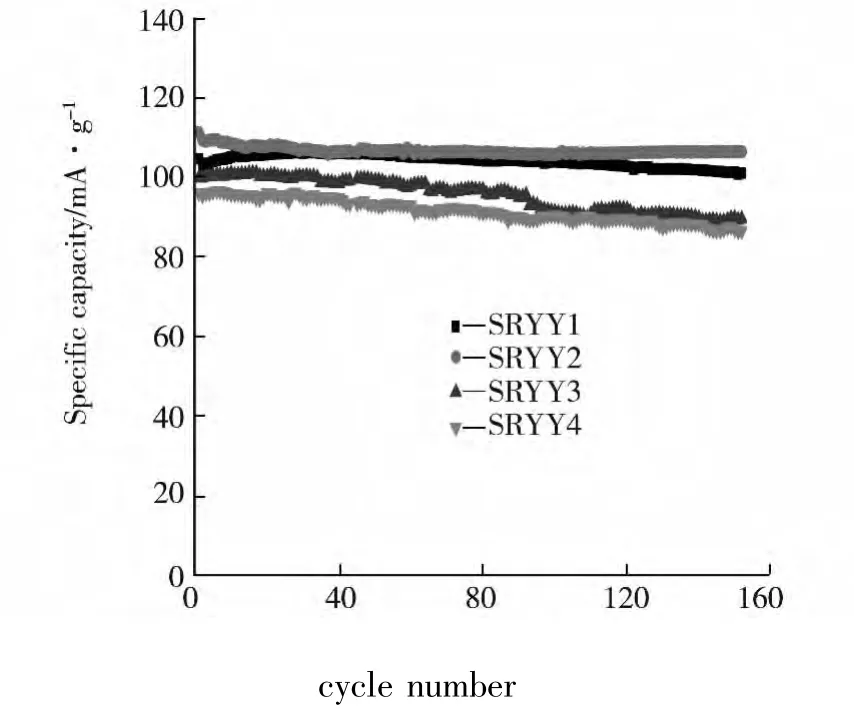
图5 样品SRYB1、SRYB2、SRYB3和SRYB4的循环寿命曲线
图 6 为所制备的 LiNi0.5Mn1.5O4循环伏安曲线,扫描电位区间 3 ~4.9 V,扫描速率 0.5 mV/s.从图可看出,尖晶石型 LiNi0.5Mn1.5O4正极材料在氧化和还原过程出现了2对电化学峰,峰型有明显差别.
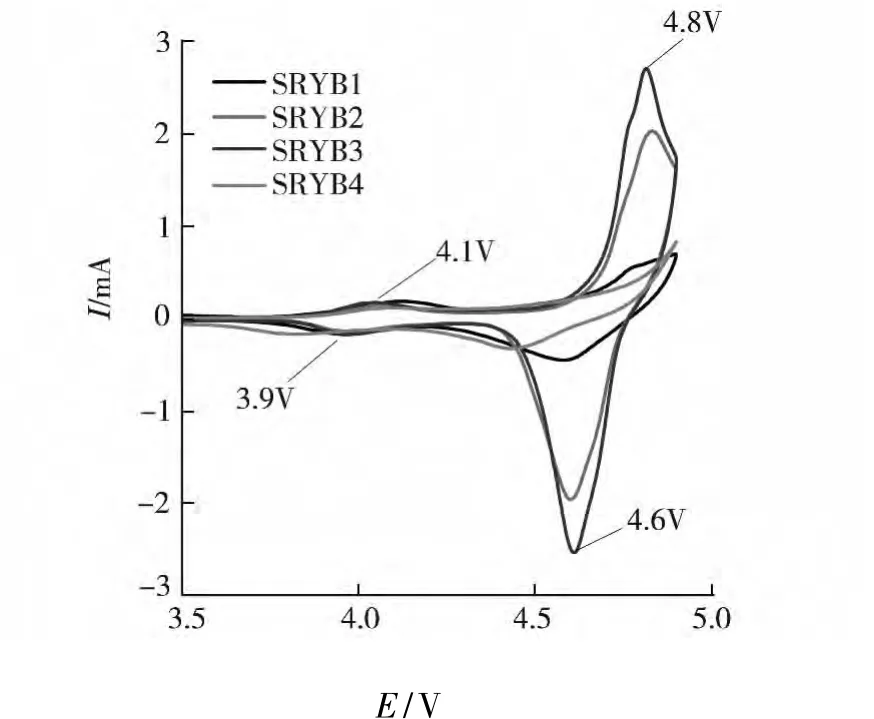
图6 样品SRYB1、SRYB2、SRYB3和SRYB4的循环伏安曲线
在循环伏安曲线中表现为2对氧化还原峰,在放电曲线上出现2个充放电电压平台.在约4.7 V附近的峰对应Ni2+/Ni4+的氧化还原反应,而在约4 V左右的峰对应Mn3+/Mn4+的氧化还原反应.他们的氧化还原峰位置与空间点群的面心立方结构的 LiNi0.5Mn1.5O4一致[6],说明四个样品均为 LiNi0.5Mn1.5O4材料.并且从表 2 可看出,样品SRKB2与其他样品的氧化还原峰的电位差相比较最小.所以样品SRKB2的尖晶石结构中锂离子的嵌入和脱出的速率最快,表现出最好的电化学性能,与前面的充放电性能一致.
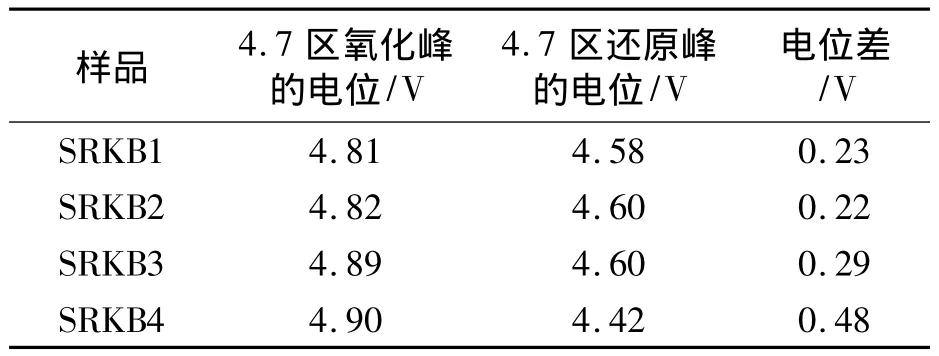
表2 在5.0 mv/s的扫描速度下的循环伏安数据
尖晶石材料电极表面的反应过程可归纳为:锂在液相中的扩散,电荷在固液两相之间的移动,锂在固相中的扩散及在固相中的嵌入或脱嵌[16].图7给出了SRYB2和SRYB4的交流阻抗谱及相应的拟合曲线,高频区的半圆反映在电极界面的电化学传荷过程阻抗,低频区的斜线反映锂离子在固体中扩散的阻抗.该电化学过程可用图中的等效电路来描述[17].图中 R1表示电解液电阻;R2和CPE1分别表示表面膜电阻和电极界面电容;R3和CPE2分别表示电荷迁移电阻和双电层电容;W1表示离子在固体活性物质中扩散阻抗.从图6可看出,实验数据与拟合曲线较为吻合.拟合结果表明:SRYB2和SRYB4的R1分别为2.08和22.95 Ohm,二者溶液电阻相差不大;但是,传荷阻抗相差明显,样品SRYB4的电荷迁移电阻为1 810 Ohm,样品SRYB2的电荷迁移电阻为540 Ohm,明显更小,所以SRYB2电化学性能更好,与前面表现出电化学性能一致.
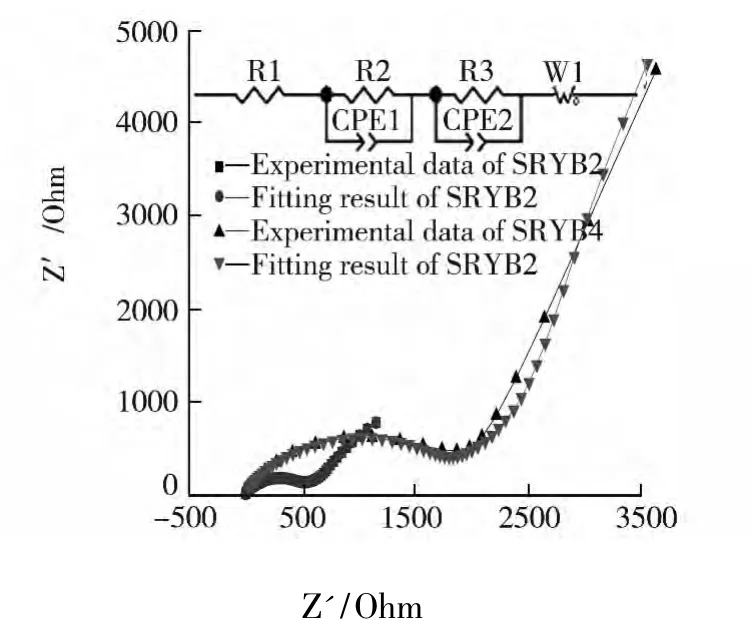
图7 样品SRYB2和样品SRYB4的EIS实验数据及拟合结果;内嵌图示出了拟合的等效电路
3 结 论
通过水热法结合热处理,制备尖晶石LiNi0.5Mn1.5O4材料,全面提高了放电比容量和循环性能.其中LiOH溶液为0.162 g·mL-1时所获得的样品性能最佳:在1C倍率电流下,首次放电比容量可达111 mAh·g-1左右,且经过150循环后,放电比容量依然为106 mAh·g-1,放电比容量衰减很小,体现出优异电化学循环性能.
不同的锂盐用量所获得的 LiNi0.5Mn1.5O4材料结构相近,但当LiOH溶液为0.162 g·mL-1时得到的样品颗粒最细小、最均匀,并且4.7 V放电电压平台容量比例最高和电荷传递阻抗最小.
[1] Teshima K.,Lee S.,et al.Environmentally friendly growth of well-developed LiCoO2crystals for lithiumion rechargeable batteries using a NaCl flux[J].Cryst.Growth Des.,2010,10(10):4471-4475.
[2] 张仁刚,赵世玺,夏君磊,等.尖晶石LiMn2O4的表面改性研究[J].电化学,2002,8(3):269-274.
[3] 宋之林,桥庆东,等.橄榄石结构LiFePO4正极材料的最新进展[J].当代化工,2014,42(4):466-469.
[4] 张先文,章正熙,杨立,等.LiNi0.49Mn1.49Y0.02O4的合成及其电化学性能研究[J].电化学,2012,18(2):140-145.
[5] Santhanam R.,Rambabu B.,et al.Research progress in high voltage spinel LiNi0.5Mn1.5O4material[J].Power Sources,2010,195(17):5442-5451.
[6] Huang X.K.,Zhang Q.S.,et al.Hydrothermal synthesis of a nanosized LiNi0.5Mn1.5O4cathode material for high power lithium-ion batteries[J].Electrochem.Soc.,2011,158(2):A139-A145.
[7] Fang H.S.,Wang Z.X.,Li X.H.,et al.Exploration of high capacity LiNi0.5Mn1.5O4cathodes having two crystallographic structures:Fd3m and P4332[J].Chem.Mater.,2004,16:906-914.
[8] Kim J.H.,Myung S.T.,Sun Y.K.Molten salt synthesis of LiNi0.5Mn1.5O4spinel for 5V class cathode material of Li-ion secondary battery[J].Electrochim.Acta,2004,49:219-227.
[9] Arrebola J.C.,Caballero A.,Cruz M.,et al.Crystal-linity control of nanostructured LiNi0.5Mn1.5O4spinet via polymer-assisted synthesis:a method for improving its rate capability and performance in 5V lithium batteries[J].Adv.Funct.Mater.,2006,16:1904-1911.
[10] Lafont U.,Locati C.,Kelder E.M.,et al.Nanosized high voltage cathode material LiMg0.05Ni0.45O4 structual,electrochemical and in situ investigation[J].Solid State Ionics,2006,177:3023-3029.
[11] Yi T.F.,Li C.Y.,Zhu Y.R.,et al.Comparison of structure and electrochemical properties for 5V LiNi0.5Mn1.5O4and LiNi0.4Cr0.2Mn1.4O4 cathode materials[J].Solid-State Electron.,2009,13:913-919.
[12] Fang Y.K.,Wang J.M.,Ye X.B.,et al.Physical properties and electrochemical performance of LiNi0.5Mn1.5O4cathode material prepared of a coprecipitation method[J].Mater.Chem.Phys.,2007,103:19-23.
[13] Wu H.M.,Tu J.P.,Chem X.T.,et al.Synthesis and characterization of abundant Ni-doped LiMn2-yNiyO4(y=0.1-0.5)powders by spray-drying method[J].Electrochim.Acta,2006,51:4148-4152.
[14] Yi T.F.,Zhu Y.R.,et al.Synthesis and electrochemistry of 5V LiNi0.4Mn1.6O4cathode materials synthesized by different methods[J].Electrochim.Acta,2008,53:3120-3126.
[15] Caballero A.,Herman L.,Melero M,et al.LiNi0.5Mn1.5O4thick-film electrodes prepared by electrophoretic deposition for use in high voltage Lithium-ion batteries[J].J.Power Sources,2006,158:583-590.
[16] Hiroo K.,Mikito N.,Hisashi T.,et al.A novel cathode Li2CoMn3O8for lithium ion batteries operating over 5 volts[J].J.Mater.Chem.,1998,8(4):837-839.
[17]林永,赵锟,王曼丽.尖晶石LiMn2O4纳米粉的合成及其交流阻抗性能研究[J].化学研究与应用,2011,23(8):975-979.
