Li1.52 Ni0.30 Mn0.78 Co0.06 O2.00正极材料的电化学性能
2014-11-09黄能贵潘国涛童庆松
蔡 斌,黄能贵,王 浪,潘国涛,童庆松
(福建师范大学化学与化工学院,福建福州350007)
移动电子产品的快速发展,对高容量电池的需要更加迫切.与其它锂离子电池的正极材料相比,Li[Li1/3Mn2/3]O2·LiMO2(M=Mn,Ni,Co 等)正极材料具有高得多的放电容量,其容量可达280 mA·g-1[1].此外,该种正极材料还具有价格低廉、安全性能佳等优点,有成为下一代锂离子电池正极材料的潜能.目前已采用共沉淀法[2]、溶胶凝胶法[3]、喷雾热解法[4]等方法研究这种材料的电化学性能.然而,共沉淀法制备时难以控制制备的中间物沉淀的溶解度(易形成胶状物),难以洗涤干净,使制备的样品性能难以重现;溶胶凝胶法制备的步骤多、工艺复杂;喷雾热解法得到样品的组成和形貌均不佳,热解得到的样品晶形不佳.虽然经过几年的研究,制备样品的理化性能有所改善.不过目前制备的样品仍然存在较大首次不可逆容量、倍率放电性能差等不足.首次充放电循环过程中,有部分的锂脱出无法重新嵌入晶格,从而造成材料首次容量不可逆的损失.通过掺杂、包覆、表面处理等手段,可改善正极材料的电化学性能.为此,基于传统的共沉淀法,本文试图通过直接共沉淀法来制备富锂锰基正极材料.前驱体形成后直接加入锂源不仅简化了制备流程,而且避免了前驱体在洗涤过程中的损失.本文采用直接沉淀法制备了富锂锰酸锂正极材料,探讨了样品组成与其电化学性能的关系.
1 实验部分
1.1 样品的制备
按照锂离子、镍离子、锰离子和钴离子的摩尔比(1.70-x)(0.21+0.5x)0.78 0.06 分别称取反应物 Li2CO3、Ni(CH3COO)2·2H2O、Mn(CH3COO)2·4H2O和Co(CH3COO)2·4H2O.将称量的反应物溶于蒸馏水中,滴入浓度为4%的Na2CO3,直至溶液酸度为11,球磨3 h后真空干燥.将干燥物洗涤除去钠离子,再次干燥制得前驱体.将干燥的前驱体置于管式炉中,在空气气氛中于500℃烧结5 h,然后升温至850℃,再次烧结16 h,制得正极材料.当锂离子、镍离子、锰离子和钴离子的摩尔比(1.70-x)(0.21+0.5x)0.78 0.06 中 x 分别 0、0.06、0.12、0.18、0.21 时,制备的样品分别为 N21、N24、N27、N30、N33.
1.2 样品物相结构的测定
采用X’Pert Pro MPD X射线粉末衍射仪(Philips)测试样品的XRD衍射数据.测试中采用Co Kα 靶(波长0.178 901 nm),测试电流30 mA,电压 40 kV,测试步长 0.02°,扫描速度 4°/min,扫描范围为5~95°.
1.3 电池的组装及充放电性能的测试
将正极材料、乙炔黑和聚偏氟乙烯按照质量比85 10 5混合,加入一定量1-甲基-2-吡咯烷酮,球磨混合制得浆料,按照文献[5]的方法制备正极片.充满氩气的手套箱中,将制备的正极片、含1.0 mol·L-1LiPF6的电解液(其中 EC DEC=1 1)、Celgard2400隔膜,金属锂片组装成CR2025型扣式电池.充放电电流为200 mA·g-1,充电的电压区间为4.6~2.5 V.
1.4 交流阻抗谱和循环伏安曲线的测试
采用CHI660C电化学工作站测试样品的交流阻抗谱和循环伏安曲线.交流阻抗谱测量的频率范围是 0.001 ~100 KHz,振幅电压为 0.005 V.循环伏安曲线测量的电压范围为2.0~4.9V,电位扫描速率分别为 0.08、0.10、0.20 mV·s-1.
1.5 样品显微形貌的观察
采用Nova Nano SEM230场发射扫描电子显微镜(SEM)观察制备样品的显微形貌,测试电压为 3.0 kV.
2 结果与讨论
2.1 样品物相结构分析
图1是制备样品的XRD衍射图.图1表明,制备的样品都具有α-NaFeO2型层状结构(空间群为 R-3m).位于 20-25°的衍射峰归属于Li2MnO3(C2/m)的特征峰,是过渡金属层中短程有序的LiMn6超晶格结构产生的.图1表明,在(006)/(012)和(018)/(110)两处有明显的劈裂峰,说明制备的样品均有良好的层状结构[1,6].
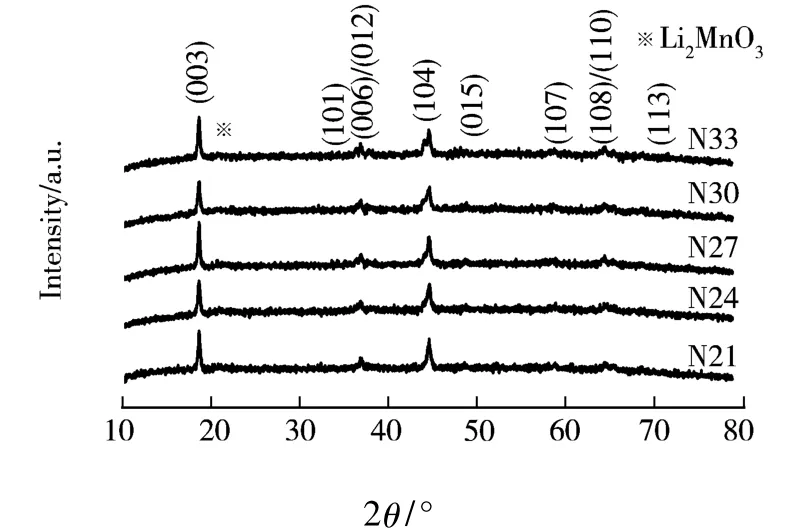
图1 样品的XRD衍射图
c/a比值常用来表征层状正极材料的结构特征,理想立方密堆积结构的c/a值为4.899.该比值越大表明层状结构的特征越明显[7].I(003)/I(104)比值可用来衡量富锂正极材料中阳离子的混排程度.I(003)/I(104)比值越大就意味着材料中阳离子混排程度越小.一般认为该比值大于1.2时,层状结构较好[4].计算表明,N30样品的 a轴、c轴分别为2.819 6Å、14.051 2Å,c/a 为 4.983 4;I(003)/I(104)的比值为1.391 3计算表明,N30样品层状结构最明显,且正极材料中阳离子混排程度小.
2.2 样品的充放电性能
图2是样品的放电容量与循环数的关系曲线.
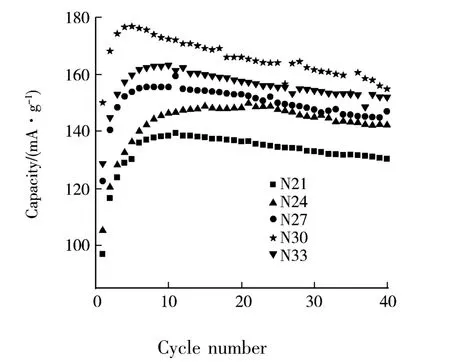
图2 样品的放电容量与循环数的关系(放电电流200 mA·g-1)
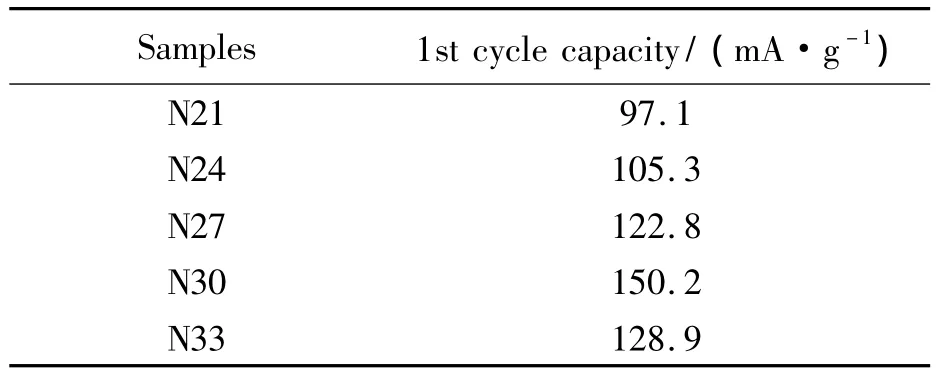
表1 样品第1循环的放电容量
由图2可知,随着循环的进行,样品的放电容量呈现先增大,后衰减的趋势.经过5至15循环后,样品的放电容量达到最大值,N21、N24、N27、N30、N33样品的最高放电容量分别为139、150、160、177、163 mAh·g-1;第40 循环样品的放电容量依次为 130、142、147、155、152 mAh·g-1.N30样品具有最高的放电容量,且在40循环内其放电容量始终是最优秀.表1是样品的第1循环的放电容量.由表 1 可知 N21、N24、N27、N30、N33 样品第1 循环放电容量分别为 97.1、105.3、122.8、150.2、128.9 mAh·g-1.由此可知,N30 样品第 1循环的放电容量最高.在40循环的充放电中,N30容量保持率为103.2%.由此可知,制备的N30样品具有最佳的充放电性能.
2.3 充电截止电压对样品放电性能的影响
图3是在不同充电截止电压下N30样品第1循环的充放电曲线.图3表明,随着充电截止电压的提高,N30样品第1循环的充放电容量明显增加.由图2和图3可知,当充电截止电压分别为4.3、4.5、4.6、4.8、4.9V 时,N30 样品第 1 循环充电容量分别为 81.8、113.0、218.9、261.4、299.8 mAh·g-1,放电容量分别为 65.4、80.8、150.2、161.0、157.0 mAh·g-1.图 2 表明,当充电截止电压为4.6 V时,N30样品在第1循环的放电曲线的电压平台平坦、充放电电流效率高.原位x射线衍射[8]以及原位微分电化学质谱[7]研究表明,提高充电截止电压时,富锂锰基固溶体样品的充放电容量增加主要是其结构中Li2MnO3组分在高电压下被激活.在3~4 V电压区间Li2MnO3是电化学惰性的.充电电压高于4.5 V时,会发生脱锂活化反应使电化学惰性的Li2MnO3转变为电化学活性的
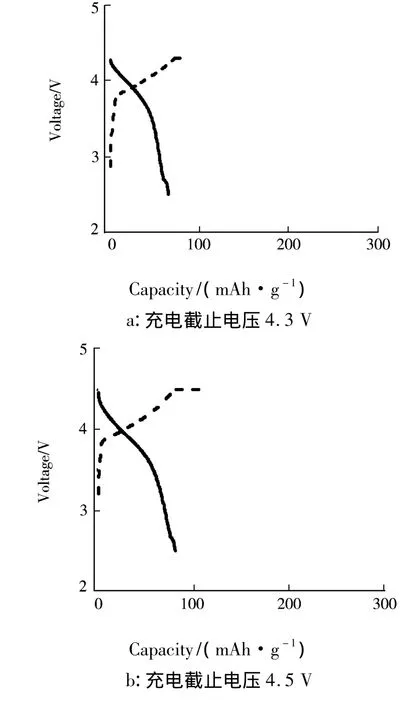
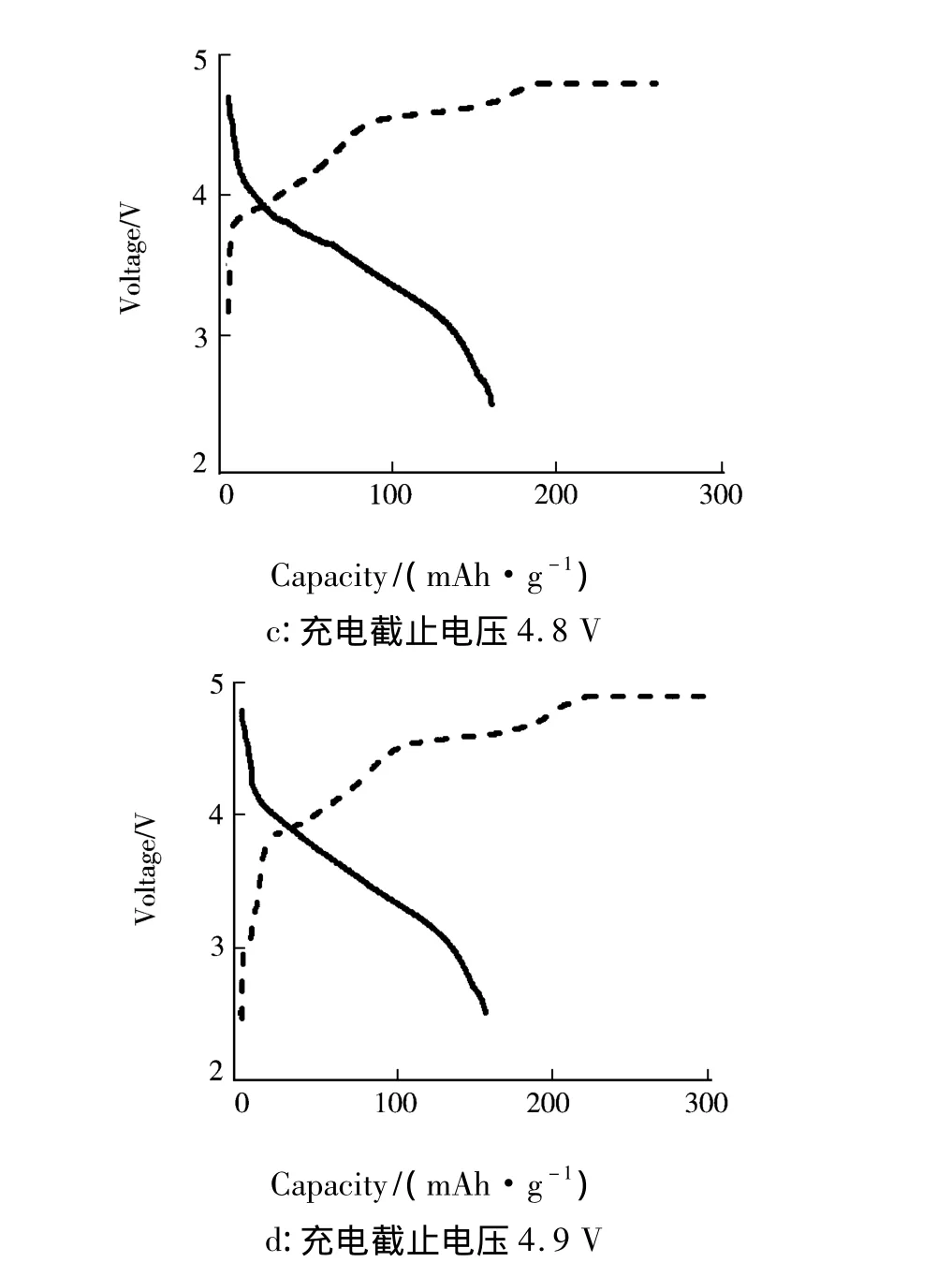
图3 在不同充电截止电压下N30样品第1循环的充放电曲线
图4是不同充电截止电压下N30样品的放电容量与循环数的关系曲线图.
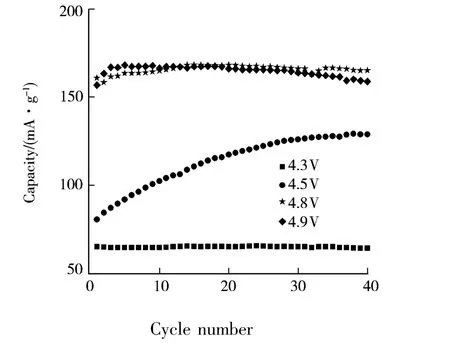
图4 不同充电截止电压下N30样品的放电容量与循环数的关系
由图4可知,充电截止电压为4.3 V时,随着循环数的增加,N30样品的放电容量并未明显增加;充电截止电压为4.5V时,随着循环数的增加,N30样品在前38循环的放电容量逐渐增加.其第1循环的放电容量为80.8 mAh·g-1,第38循环的放电容量上升到129.5 mAh·g-1.充电截止电压为4.8或4.9 V时,在前5循环中N30样品的放电容量就升到最高,显现出完全激活状态.总的来说,充电截止电压为4.6 V时,N30样品的放电容量最高、循环性能最佳.制备的正极材料的容量与文献[1]报道的还有一定差距,这可能是由于二者理论组成、截止电压的差异造成的.通过提高充电截止电压在一定程度上可提高材料的容量;但对电解液提出了更高的要求,否则可能带来安全隐患.因此,4.6 V的充电截止电压是最佳的充电条件.
2.4 不同倍率电流下样品的充放电性能
图5是在不同倍率电流下N30样品的放电容量与循环数的关系曲线图.由图4和图5可知,充电电流分别为 20、200、400、1 000 mAh·g-1时,N30样品第1循环放电容量分别为181.6、150.2、156.0、108.1 mAh·g-1,第 40 循环放电容量分别为175.2、155.0、150.7、103.9 mAh·g-1.由此可知,当充电电流从20 mA·g-1增大到1 000 mA·g-1后,N30样品在第1循环和第40循环的容量保持率分别为60%、53%.可见,大电流放电条件下样品的放电容量仍有一定衰减.
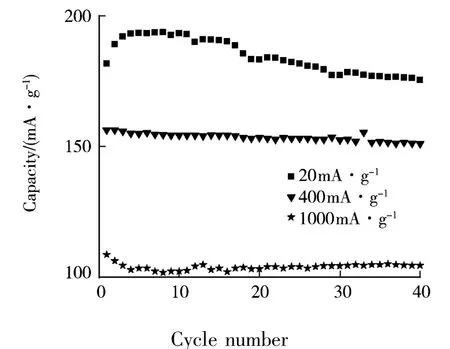
图5 在不同倍率电流下N30样品的放电容量与循环数的关系曲线图
2.5 样品的循环伏安曲线分析
图6是不同扫描速率下N30样品循环伏安曲线图.富锂锰基正极材料中Mn3+/Mn4+、Ni2+/Ni4+和Co3+/Co4+电对氧化峰分别位于 3.0 ~3.5 V、3.5~4.25 V 和 4.25 ~4.75 V;其还原峰分别位于2.75 ~3.0 V、3.0 ~3.5 V 和 4.0 ~4.5 V[9].这里以Ni2+/Ni4+的氧化还原峰作为比较.由图6可知当扫描速率为 0.08、0.10、0.20 mV·s-1时,N30样品的镍氧化峰和还原峰的电位差分别为0.004、0.009、0.011 V.随着扫描速率的加快,峰电位差值呈现上升趋势.因此,扫描速率越大,电极极化加重、锂离子的扩散受动力学控制.这与前面充放电循环实验的结果是相同的.
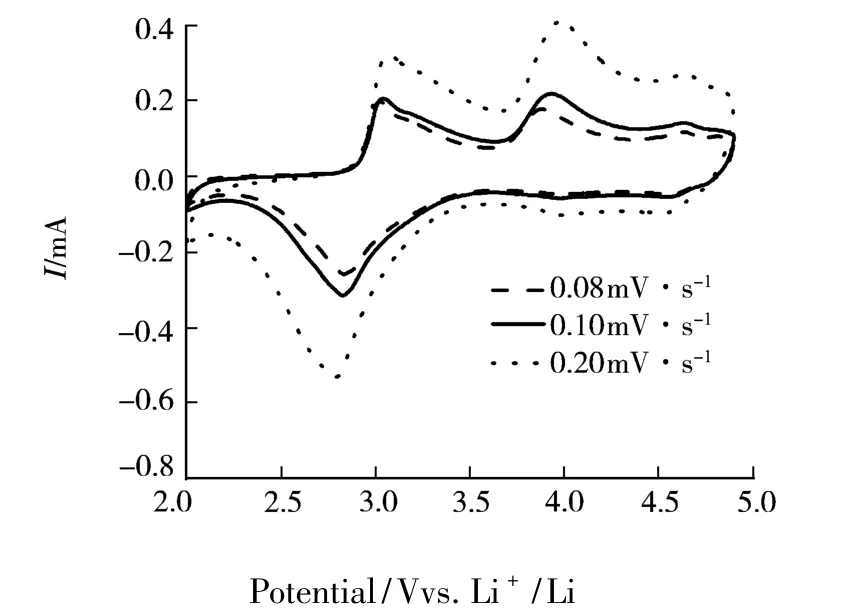
图6 不同扫描速率下N30样品的循环伏安曲线图
2.6 样品的交流阻抗分析
图7是样品交流阻抗谱的Nyquist图.图7表明样品的交流阻抗图谱(EIS)可分为两个区域.在高频区有一个小半圆弧,在低频区是一条倾斜角为45°左右的斜线.高频区的阻抗反映了电荷传递阻抗.低频区的斜线是锂离子在电极材料内部扩散引起的Warburg阻抗.因此,富锂锰基固溶体正极材料N30和N21的电化学反应受电荷传递阻抗和Li+扩散的Warburg阻抗共同控制.图7表明充放电前N30和N21样品的电荷传递阻抗分别为73Ω和194Ω.经过200 mA·g-1电流充放电40循环后,N30和N21样品的电荷传递阻抗分别为48Ω和133Ω.经过充放电循环,样品的传荷阻抗明显减小,推测在循环过程中电解液渗透到电极活性物质的颗粒中,改善了样品的电化学性能[].循环前后N30样品阻抗性能始终最优.与N21样品相比较,充放电前后N30样品的电荷传递阻抗更小,这与样品的充放电性能是一致的.
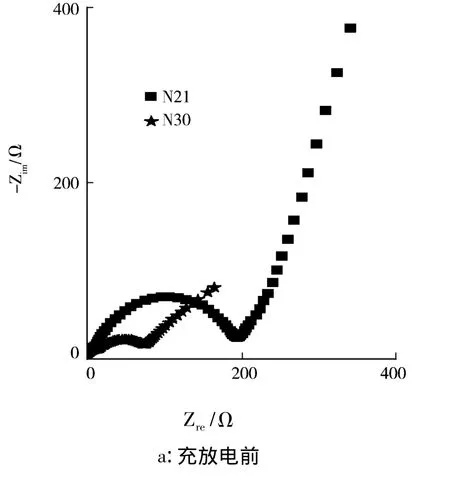
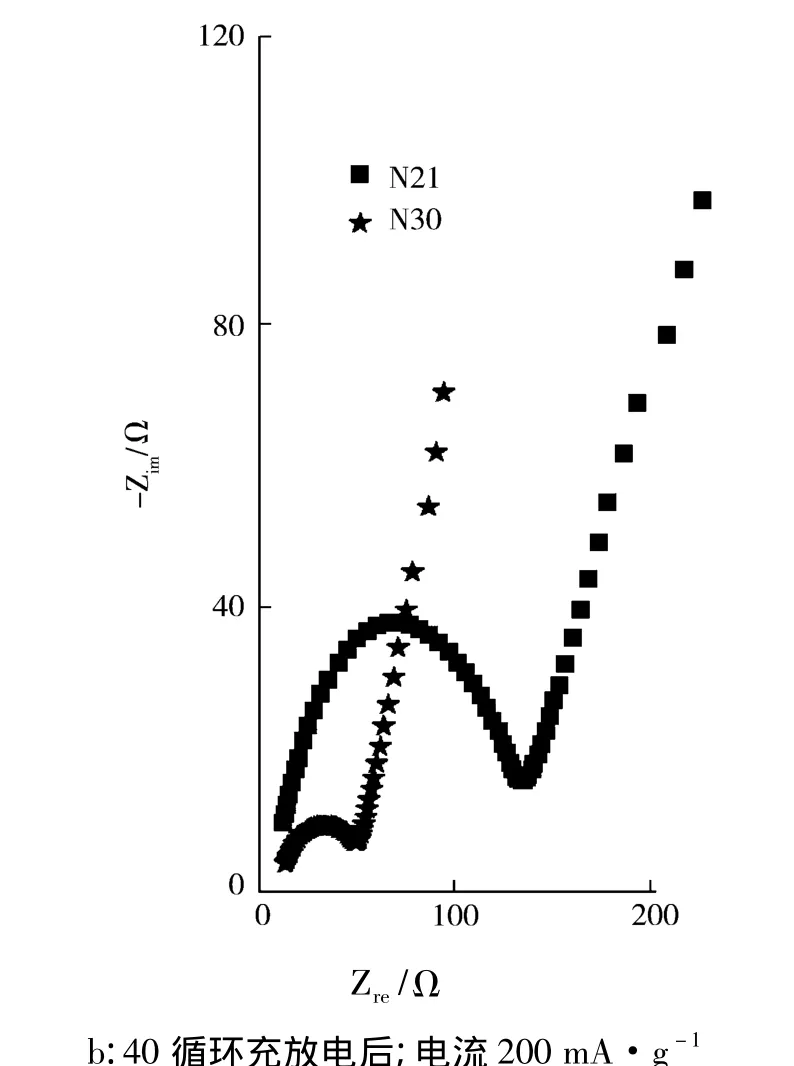
图7 样品交流阻抗谱的Nyquist图
2.7 样品的显微形貌分析
图8为N21和N30两个样品的扫描电镜图.

图8 样品的扫描形貌图
图8表明N21样品颗粒大小为0.2~1.5μm,N30样品颗粒大小为0.1~0.5μm.较小颗粒的N30样品进行充放电时有利于缩短锂离子在样品颗粒间迁移的距离,改善样品的大倍率放电性能.
3 结 论
通过直接沉淀法制得具有α-NaFeO2型层状结构的微米富锂锰基正极材料.理论组成为Li1.52Ni0.30Mn0.78Co0.06O2的 样 品 具 有 最优 的 电 化学性能.该样品在 20、200、400、1 000 mAh·g-1电流密度下,第1循环放电容量分别为 181.6、150.2、156.0、108.1 mAh·g-1,第 40 循环放电容量分别为 175.2、155.0、150.7、103.9 mAh·g-1.在4.6 V的充电截止电压下表现出最佳的充放电性能.该样品的电化学反应受电荷传递阻抗和和Li+扩散的Warburg阻抗共同控制.经过充放电循环后样品的电荷传递阻抗减小.
[1] Yu H,Zhou H.High-energy cathode materials(Li2MnO3-LiMO2)for lithium-ion batteries[J].J.Phys.Chem.Lett.,2013,4(8):1268-1280.
[2] Yang X,Wang X,Zou G,et al.Spherical lithium-rich layered Li1.13[Mn0.534Ni0.233Co0.233]0.87O2with concentration-gradient outer layer as high-performance cathodes for lithium ion batteries[J].J.Power Sources,2013,232:338-347.
[3] Song B,Lai M O,Liu Z,et al.Graphene-based surface modification on layered Li-rich cathode for high-performance Li-ion batteries[J].J.Mater.Chem.,2013,1:9954-9965.
[4] Son M Y,Hong Y J,Choi SH,et al.Effects of ratios of Li2MnO3and Li(Ni1/3Mn1/3Co1/3)O2phases on the properties of composite cathode powders in spray pyrolysis[J].Electrochim.Acta.,2013,103:110-118.
[5] Lu Y,Shi J,Guo Z,et al.Synthesis of LiFe(1-x)NixPO4/C composites and their electrochemical performance[J].J.Power Sources,2009,194(2):786-793.
[6] Toprakci O,Toprakci H A K,Li Y,et al.Synthesis and characterization of x Li2MnO3·(1-x)LiMn1/3Ni1/3Co1/3O2composite cathode materials for rechargeable lithium-ion batteries[J].J.Power Sources,2013,241:522-528.
[7] Armstrong A R,Holzapfel M,Novák P,et al.Demon-strating oxygen loss and associated structural reorganization in the lithium battery cathode Li[Ni0.2Li0.2Mn0.6]O2[J].J.Am.Chem.Soc.,2006,128(26):8694-8698.
[8] Lu Z,Dahn JR.Understanding the anomalous capacity of Li/Li[NixLi(1/3-2x/3)Mn(2/3-x/3)]O2cells using in situ X-ray diffraction and electrochemical studies[J].J.Electrochem.Soc.,2002,149(7):A815-A822.
[9] Surendra k.M.,Jagjit N.,Gabriel M.V.,et al.Electrochemical and rate performance study of high voltage lithium rich composition:Li1.2Mn0.525Ni0.175Co0.1O2[J].J.Power Sources.,2012,(199):220-226.
[10] Gao F,Tang Z.Kinetic behavior of LiFePO4/Ccathode material for lithium-ion batteries[J].Electrochim.Acta.,2008,53(15):5071-5075.
