金丝桃素提取物稳定性考察*
2014-11-08王金林李前琼王晓利何利思张俊松张德志
王金林 ,李前琼 ,,王晓利 ,何利思 ,张俊松 ,张德志
(1.深圳职业技术学院,广东 深圳 518055;2.广东药学院,广东 广州 510006)
贯叶金丝桃 Hypericum performatum L.为藤黄科金丝桃属的多年生草本,味苦、辛,性平,作为传统中药,具有清热解毒、收敛止血、利湿等功效,国外常用于多种疾病的治疗,如抑郁症、刀伤、肿瘤等。贯叶金丝桃含有多种具生物活性的化学成分,其中主要活性成分为萘骈二蒽酮类化合物金丝桃素(HY)和伪金丝桃素(PHY),具有抗病毒、抗抑郁、抗肿瘤等药理活性[1-3]。因此,萘骈二蒽酮类成分和金丝桃素含量常作为评价贯叶金丝桃药材、提取物及其制剂质量的指标[4-5]。根据贯叶金丝桃提取物行业标准,其总金丝桃素含量需大于0.3%。但HY及PHY稳定性较差,尤其在光照、高温条件下易被氧化。Karioti等[6]的研究表明,在自然条件下HY纯品4 d内损失20%。本研究中利用纳米微球材料分离纯化得到了总金丝桃素含量较高的提取物,并采用高效液相色谱法,考察光照、温度和抗坏血酸对HY提取物中HY及PHY含量的影响,考察HY,PHY在提取物中的稳定性,旨在为HY的分离提取、纯化及应用等条件的设定提供依据。
1 仪器与试药
日本岛津LC-20A型高效液相色谱仪,包括含SPD-M20A二极管阵列检测器,LC-20AT输液单元,CBM-20Alite系统控制器,岛津LC-20A配套处理软件LC-solution;KQ2200DE型超声波清洗器(昆山市超声仪器有限公司);pH计(Thermo公司);SY100型恒温式水浴锅(常州精密仪器有限公司)。HY纯品(瑞士Alexis公司,批号为L15535/a,纯度大于99%);PHY标准品(瑞士Alexis公司,批号为L21505/a,纯度大于99%);HY提取物(实验室自制,HY 含量为 0.282 g/L,PHY 含量为 0.470 g/L);L-抗坏血酸(上海化学试剂厂);甲醇为色谱纯(天津协和昊鹏色谱科技有限公司);其余试剂均为国产分析纯。
2 方法与结果
2.1 HY和PHY含量测定
采用高效液相色谱法检测HY提取物中HY和PHY的含量。色谱条件:色谱柱为 Kromasil-C18柱(250 mm ×4.6 mm,5 μm),流动相为甲醇 -0.006 mol/L Na2HPO4(7 ∶1 v/v,H3PO4调 pH 为6.5),流速为 1.0 mL/min,柱温为 30 ℃,检测波长为 590 nm。按上述色谱条件测定,HY提取物中HY的含量为0.282 g/L,PHY含量为 0.470 g/L。
2.2 HY提取物短期稳定性影响因素考察
光照:取HY提取物供试品,分别在常温光照、常温避光条件下测定 1,2,3,6,12 h及 1,2,3 d时 HY 及 PHY 的含量。结果见表1。可见,提取物中的HY及PHY含量在光照后均有升高,其中HY在光照1 h后含量最高,3 h后开始逐渐降低;而PHY在光照2 h后含量最高,3 h后也开始逐渐降低。避光条件下,HY提取物稳定性较好,HY及PHY含量无明显变化。
温度:取HY提取物供试品,分别置50,60,70,80℃恒温水浴中,避光。每隔1h测定供试品中HY及PHY的含量。结果见表2。可见,4 h内HY提取物在50℃和60℃下保持稳定,HY及PHY含量未发生明显变化(P>0.05);而在70℃和80℃下稳定性降低,HY及PHY含量明显下降(P<0.05)。
抗坏血酸:抗坏血酸能提高金丝桃素纯品的稳定性[3]。精密称取0.025 g抗坏血酸置25 mL容量瓶中,用HY提取物溶液超声溶解,定容,配制成抗坏血酸含量为0.1%的样品。分别在常温光照、常温避光条件下测定 1,2,3,6,12 h 及 1,2,3 d 时 HY,PHY的含量。加入抗坏血酸后,HY提取物的稳定性与光照后类似。结果见表3。
表1 光照对HY提取物稳定性的影响(,g/L,n=3)
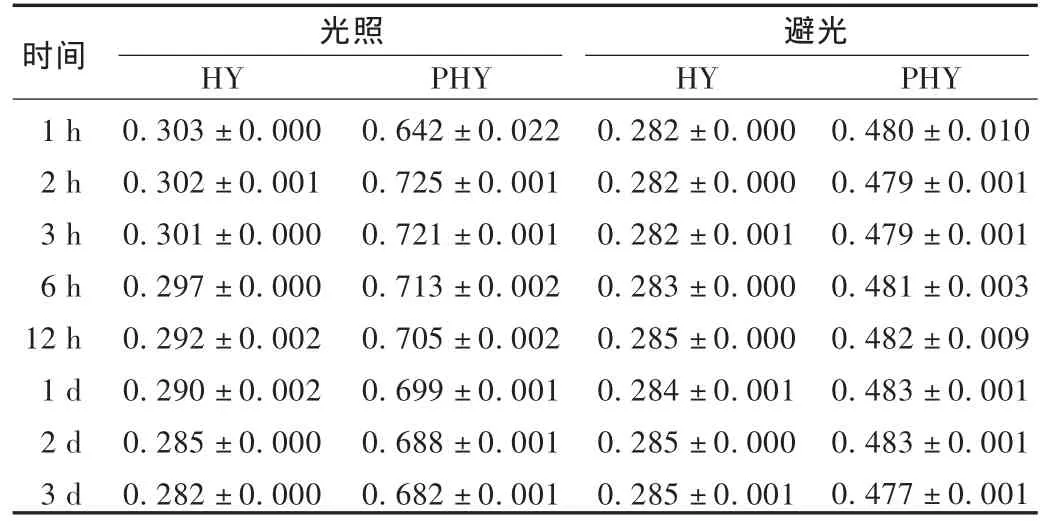
表1 光照对HY提取物稳定性的影响(,g/L,n=3)
时间1 h 2 h 3 h 6 h 12 h 1 d 2 d 3 d光照 避光HY 0.303 ± 0.000 0.302 ± 0.001 0.301 ± 0.000 0.297 ± 0.000 0.292 ± 0.002 0.290 ± 0.002 0.285 ± 0.000 0.282 ± 0.000 PHY 0.642 ± 0.022 0.725 ± 0.001 0.721 ± 0.001 0.713 ± 0.002 0.705 ± 0.002 0.699 ± 0.001 0.688 ± 0.001 0.682 ± 0.001 HY 0.282 ± 0.000 0.282 ± 0.000 0.282 ± 0.001 0.283 ± 0.000 0.285 ± 0.000 0.284 ± 0.001 0.285 ± 0.000 0.285 ± 0.001 PHY 0.480 ± 0.010 0.479 ± 0.001 0.479 ± 0.001 0.481 ± 0.003 0.482 ± 0.009 0.483 ± 0.001 0.483 ± 0.001 0.477 ± 0.001
2.3 HY提取物长期稳定性影响因素考察
光照及温度:取HY提取物,分别在常温光照、常温避光和低温(-24 ℃ )避光条件下存放,于 1,2,4,6,8 周时测定 HY 和PHY的含量。结果见表4。可见,常温光照8周后,HY含量下降49.3%,PHY含量下降20.0%;常温避光8周后,HY含量下降8.5%,PHY含量下降6.0%。而低温避光保存的HY提取物,HY和PHY含量均未发生变化。
表2 短期内温度对HY稳定性的影响(,g/L,n=3)

表2 短期内温度对HY稳定性的影响(,g/L,n=3)
注:与加热前比较:*P <0.05。
时间 50℃ 60℃ 70℃ 80℃1 h 2 h 3 h 4 h HY 0.282 ± 0.002 0.283 ± 0.099 0.284 ± 0.093 0.284 ± 0.090 PHY 0.470 ± 0.012 0.476 ± 0.010 0.482 ± 0.003 0.484 ± 0.002 HY 0.284 ± 0.002 0.283 ± 0.099 0.284 ± 0.093 0.283 ± 0.090 PHY 0.467 ± 0.004 0.467 ± 0.001 0.468 ± 0.002 0.466 ± 0.004 HY 0.282 ± 0.003 0.281 ± 0.098 0.280 ± 0.092 0.276 ± 0.089*PHY 0.464 ± 0.006 0.464 ± 0.002 0.463 ± 0.001 0.456 ± 0.001*HY 0.278 ± 0.002 0.276 ± 0.097 0.274 ± 0.091 0.270 ± 0.088*PHY 0.462 ± 0.001 0.458 ± 0.002 0.457 ± 0.008 0.448 ± 0.003*
表3 抗坏血酸对HY稳定性的影响(,g/L,n=3)

表3 抗坏血酸对HY稳定性的影响(,g/L,n=3)
时间 光照 避光1 h 2 h 3 h 6 h 12 h 1 d 2 d 3 d HY 0.311 ± 0.002 0.309 ± 0.001 0.307 ± 0.001 0.304 ± 0.002 0.299 ± 0.000 0.289 ± 0.001 0.285 ± 0.002 0.279 ± 0.002 PHY 0.723 ±0.004 0.721 ±0.006 0.719 ±0.002 0.706 ±0.004 0.700 ±0.001 0.684 ±0.004 0.674 ±0.004 0.665 ±0.005 HY 0.281 ±0.000 0.281 ±0.001 0.282 ±0.001 0.281 ±0.000 0.281 ±0.000 0.282 ±0.001 0.281 ±0.001 0.281 ±0.000 PHY 0.471 ± 0.001 0.471 ± 0.002 0.471 ± 0.000 0.470 ± 0.000 0.470 ± 0.001 0.472 ± 0.001 0.471 ± 0.001 0.471 ± 0.001
表4 HY提取物的中长期稳定性试验(,g/L,n=3)

表4 HY提取物的中长期稳定性试验(,g/L,n=3)
时间(周)常温光照 常温避光 低温避光HY PHY HY PHY HY PHY 0.256 ±0.001 0.231 ±0.001 0.183 ±0.000 0.157 ±0.030 0.143 ±0.001 1 2 4 6 8 0.623 ±0.010 0.564 ±0.002 0.460 ±0.002 0.411 ±0.001 0.375 ±0.000 0.282 ± 0.001 0.278 ± 0.001 0.274 ± 0.002 0.269 ± 0.000 0.258 ± 0.000 0.472 ±0.003 0.470 ±0.000 0.457 ±0.000 0.453 ±0.002 0.441 ±0.001-0.283 ± 0.001 0.283 ± 0.002 0.281 ± 0.000 0.282 ± 0.001-0.471 ±0.001 0.471 ±0.001 0.472 ±0.002 0.470 ±0.002
抗坏血酸:取2.2项下抗坏血酸-HY提取物样品,分别在常温、光照和常温、避光条件下测定 1,2,4,6,8周时 HY及 PHY的含量。结果见表5。在抗坏血酸存在的条件下,HY提取物中HY及PHY含量反而下降剧烈。其中,HY含量在光照和避光条件下分别下降71.3%和34.0%,PHY含量下降45.6%和27.3%。

表5 抗坏血酸对HY提取物中长期稳定性影响(
3 讨论
在考察光照条件对HY提取物稳定性的影响时,光照1 h后HY及PHY含量并未降低反而略有升高。其原因可能是HY提取物中所含有的一些HY及PHY的前体物质,如原金丝桃素(protohypericin)、原伪金丝桃素(protopseudohypericin),在光照条件下,原金丝桃素可转化为HY,原伪金丝桃素可转化为PHY[7]。
王晓菊等[8]认为,加入抗坏血酸有助于提高HY的稳定性。本研究在考察抗坏血酸对HY提取物短期稳定性影响时,加入抗坏血酸与未加抗坏血酸的样品稳定性相类似。但考察其对HY提取物长期稳定性影响时,加入抗坏血酸使HY提取物中HY及PHY含量下降较明显,甚至比未加抗坏血酸的样品稳定性更差。其原因可能为抗坏血酸具有酸性调节作用,而HY和PHY在酸性条件下不稳定,具体原因尚待进一步研究。
HY提取物短期内,在常温避光及加抗坏血酸条件下较为稳定;光照能使提取物中HY及PHY含量短时间内升高,然后下降;在高温下,提取物稳定性差。HY提取物长期存放在常温光照、常温避光及加抗坏血酸条件下,HY及PHY含量均有不同程度地下降,在低温避光条件下比较稳定。因而在HY提取物的分离提取和纯化工艺及HY提取物的临床应用过程中,应尽量避免光照和高温,长期贮存HY提取物应置低温避光条件下。在HY提取物的长期保存过程中不应加入抗坏血酸。
[1]王向阳,刘志苏,姜合作,等.金丝桃素体外抗巨细胞病毒效应的实验研究[J].武汉大学学报:医学版,2006,27(3):303-310.
[2]Karioti A,Bilia AR.Hypericins as potential leads for new therapeutics[J].Int J Mol Sc,2010,11,562-594.
[3]王晓利,王彩虹,郭 懿,等.光诱导金丝桃素对人鼻咽癌细胞CNE-2的毒作用和凋亡研究[J].中药学,2010,32(8):1 296-1 298.
[4]赵 鑫,李铁军,于治国,等.贯叶金丝桃药材中萘骈二蒽酮类成分的分光光度法和HPLC法定量分析[J].药学服务与研究,2011,11(6):434-438.
[5]杨得坡,甘良春,王冬梅.贯叶连翘薄膜片中金丝桃素和金丝桃素类化合物的HPLC和UV测定[J].中国医药工业杂志,2004,35(9):548-550.
[6]Karioti A,Vincieri FF,Bilia AR.Rapid and efficient purification of naphthodianthronesfrom St.John's Wort extract by using liquid-liquid extraction and sizeexclusion column chro-matography[J].J Sep Sci,2009,32:1 374-1 382.
[7]毛淑才,刘展眉,郑康成.贯叶连翘提取物的研究新进展[J].时珍国医国药,2006,17(7):1 303-1 305.
[8]王晓菊,张立伟.金丝桃素的稳定性[J].光谱实验室,2005,22(4):797-800.
