丹参酮ⅡA联合参麦注射液对肾缺血-再灌注大鼠氧化应激及肾功能的影响
2014-11-05刘小勇陈胜龙
刘小勇,陈胜龙
(成都医学院第一附属医院泌尿外科,四川 成都 610500)
研究显示氧化应激在肾缺血再灌注(ischemiaresperfusion,IR)损伤过程中起重要作用[1~3],因此,抗氧自由基的产生或及时清除氧自由基对改善IR造成的损伤极为重要。丹参是一味重要的活血化瘀药,其主要有效成分丹参酮ⅡA(TanshineⅡA)对心、肝、脑、肾器官的缺血再灌注损伤有一定的保护作用[4~6]。参麦注射液是在经典方剂生脉饮的基础上研制而来,具有益气养阴、生津止渴以及固脱复脉的效果,实验显示其具有抗氧化应激作用[7]。但丹参酮ⅡA联用参麦注射液抗氧化效应是否增强尚不清楚。本实验以SD大鼠肾IR模型为基础,以丹参酮ⅡA合用参麦注射液作为干预手段,测定肾脏组织中MDA和SOD含量,同时测定血肌酐和尿素氮水平,并与单用丹参酮ⅡA和参麦注射液进行比较研究,观察丹参酮ⅡA合用参麦注射液对IR肾的保护作用及其作用机制。
1 材料与方法
1.1 材料 雄性SD大鼠200只,体重200~250 g(四川省医学科学院实验动物研究所提供)。参麦注射液(雅安三九药业有限公司生产,批号:040803)。丹参酮ⅡA磺酸钠注射液(上海第一生化药业有限公司,批号:070823)。大鼠MDA、SOD等ELISA试剂盒为R&D公司产品。
1.2 实验动物分组及IR模型制备 SD大鼠随机分为5组:假手术组,IR模型组、丹参酮ⅡA组、参麦组及丹参酮ⅡA联合参麦组各40只。所有动物均先给予标准饮食及自由饮水3d,然后给予药物处理。丹参酮ⅡA组、参麦组及丹参酮ⅡA联合参麦组分别给予丹参酮ⅡA 30 mg/kg、参麦注射液3 ml/kg、丹参酮ⅡA联合参麦注射液(丹参酮ⅡA 30 mg/kg、参麦注射液3 ml/kg),均于术前连续灌胃给药3 d,每天1次。假手术组和缺血再灌注组给予等量的生理盐水灌胃。第4天进行手术,术前12 h禁食不禁水,4%戊巴比妥钠(50 mg/kg)腹腔内注射麻醉,上腹部正中切口进入腹腔,推开肠腔,暴露左侧肾蒂,用无损伤微动脉夹夹闭肾动静脉50 min后松开血管夹使血液复流进行再灌注。观察肾脏颜色变化情况(若复流不畅则终止实验),并于左肾开放血流前2 min时切除右肾,然后缝合关闭切口。假手术组按同样步骤切除右肾,只是不钳夹阻断肾蒂血流。术后仅12 h、24 h组继续原方案给药。三组于术后3、6、12 h和24 h分别处死10只大鼠,常规分离血清,置于-80℃冰箱保存以备检测。取肾脏组织2.5 g制成匀浆,离心后取上清液置于-80℃冰箱保存待测。
1.3 指标测定 肾脏组织中MDA及SOD含量的测定严格按照ELISA试剂盒说明书进行定量测定。血清中Cr和BUN水平应用本院检验科的全自动生化分析仪测定。
1.4 统计学方法 使用SPSS 13.0软件包进行统计学分析。实验数据以均数±标准差表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 肾脏组织匀浆中MDA含量变化 在IR模型组中,肾组织匀浆MDA水平随再灌注时间的延长逐渐升高,12 h达高峰后下降,在6 h和12 h与其它组相比较有统计学意义(P<0.05),而丹参酮ⅡA组、参麦组、丹参酮ⅡA联合参麦组和假手术组中MDA水平无此变化,且四组相互比较差异无统计学意义(P>0.05),见表1。
2.2 肾脏组织匀浆中SOD活性变化 随再灌注时间的延长,肾组织匀浆SOD活性显著降低,于24 h达最低水平。丹参酮ⅡA组、参麦组在24 h、丹参酮ⅡA联合参麦组在12 h和24 h与IR模型组相比不同程度地提高SOD的活力(P<0.05),与假手术组比较差异无统计学意义(P>0.05);丹参酮ⅡA联合参麦组与丹参酮ⅡA组和参麦组相比在24 h SOD活力提高(P<0.05);丹参酮ⅡA组与参麦组比较差异无统计学意义(P>0.05),见表1。

表1 各组大鼠不同时段肾脏组织中MDA和SOD活性水平
2.3 血Cr和BUN水平的变化 IR模型组、丹参酮ⅡA组、参麦组和丹参酮ⅡA联合参麦组大鼠血Cr和BUN水平随病程进展逐渐升高,各时点与假手术组比较差异均有统计学意义(P<0.05)。丹参酮ⅡA组、参麦组和丹参酮ⅡA联合参麦组与IR组比较,血Cr和BUN水平低于IR组(P<0.05);丹参酮ⅡA联合参麦组与丹参酮ⅡA组和参麦组比较,在24 h血Cr和BUN值均降低明显,有统计学意义(P<0.05),而丹参酮ⅡA组与参麦组比较差异无统计学意义(P>0.05),见表2。
3 讨论
肾缺血再灌注损伤(ischemia-resperfusion injury,IRI)是临床常见的病理生理过程,是导致缺血性急性肾衰竭的主要原因之一,病死率很高,即便存活的患者亦有部分转变为终末期肾脏疾病。因此,如何减轻或避免肾IRI已经成为临床医师必须高度重视的问题。氧自由基增多导致的氧化应激损伤在缺血再灌注损伤中发挥了关键作用。缺血后急性肾衰竭时,氧自由基大量产生主要来源于黄嘌呤氧化酶途径,肾缺血后ATP降解生成大量的次黄嘌呤,再灌注后由于恢复供氧,次黄嘌呤在黄嘌呤氧化酶催化下生成黄嘌呤,同时产生大量的氧自由基和羟自由基,这些氧自由基主要通过膜的脂质过氧化对组织造成损害,即对生物膜中多价不饱和脂肪酸进行降解,而损害细胞膜和线粒体膜的结构和功能,造成各种细胞功能障碍。肾脏在缺血再灌注损伤时,由于其细胞膜和细胞器膜由大量的多不饱和脂肪酸构成,所以对氧自由基介导的损伤特别敏感。MDA是氧自由基与脂质过氧化的分解产物,可与体内多种物质发生交联而引起损害,因此,测定MDA不仅可以反映氧自由基的生成,还可间接反映细胞损伤的严重程度[8]。缺血-再灌注时MDA含量越高,体内脂质氧化程度越高,组织损伤越重。SOD是生物体内防御氧化损伤的一种十分重要的金属酶,对氧自由基有强烈清除作用[9]。
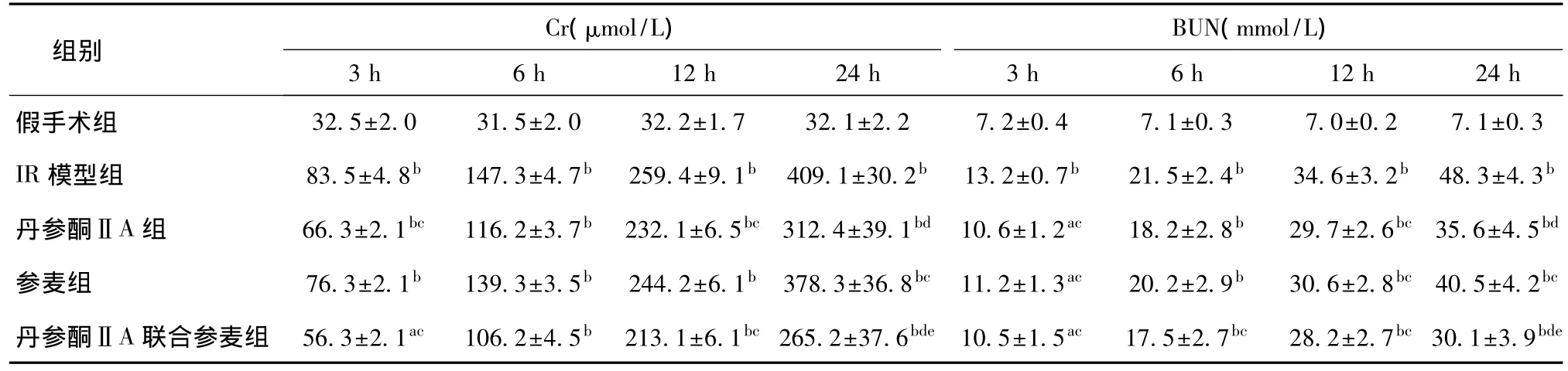
表2 各组大鼠不同时段血清Cr和BUN水平
实验显示,丹参主要有效成分丹参酮ⅡA对心、肝、脑、肾器官的缺血再灌注损伤有一定的保护作用[4~6];参麦注射液具有抗氧化应激作用[7]。临床研究显示,联用丹参酮ⅡA和参麦注射液对缺血性心脏病有明显改善作用[10]。本实验观察到:IRI时,肾组织匀浆MDA含量随再灌注时间的延长逐渐升高,于12 h达高峰,单用丹参酮ⅡA、参麦注射液或二者联用均可拮抗IRI时MDA水平的增高,表明在IR中,丹参酮ⅡA、参麦注射液、丹参酮ⅡA联合参麦注射液对脂类过氧化均有阻止效应,可以降低氧自由基水平。为确定IRI时,丹参酮ⅡA和参麦注射液的抗氧化作用是否参与了细胞内氧自由基清除酶活性的调节,我们检测了氧自由基清除酶SOD活性。发现与IR模型组相比,丹参酮ⅡA组、参麦组在24 h、丹参酮ⅡA联合参麦组在12 h和24 h提高SOD的活力,与假手术组相比差异无统计学意义;丹参酮ⅡA联合参麦组与丹参酮ⅡA组和参麦组相比在24 h SOD活力提高,表明丹参酮ⅡA、参麦注射液、丹参酮ⅡA联合参麦注射液由于增高了氧自由基清除酶SOD活性,从而清除了IRI时增多的氧自由基,使氧自由基水平降低,其介导产生的MDA水平减少,且联用丹参酮ⅡA和参麦注射液优于单用效应。丹参酮ⅡA组,参麦组,尤其是丹参酮ⅡA联合参麦组肾功能受到影响的程度和IR模型组相比均明显降低,说明丹参酮ⅡA、参麦注射液,尤其联用丹参酮ⅡA和参麦注射液对肾脏IRI具有保护作用。
[1]Ebrahimi A,Salimi F,Safaei M,et al.How effective are alprostadil and hydrocortisone on reperfusion injury in kidney after distant organ ischemia[J].J Res Med Sci,2013,18(9):755-758.
[2]Trujillo J,Chirino YI,Molina-Jijón E,et al.Renoprotective effect of the antioxidant curcumin:Recent findings[J].Redox Biol,2013,1(1):448-456.
[3]Yamamoto S,Hagiwara S,Hidaka S,et al.The antioxidant EPC-K1 attenuates renal ischemia-reperfusion injury in a rat model[J].Am J Nephrol,2011,33(6):485-490.
[4]Liang R,Bruns H,Kincius M,et al.Danshen protects liver grafts from ischemia/reperfusion injury in experimental liver transplantation in rats[J].Transpl Int,2009,22(11):1100-1109.
[5]Chang PN,Mao JC,Huang SH,et al.Analysis of cardioprotective effects using purified Salvia miltiorrhiza extract on isolated rat hearts[J].J Pharmacol Sci,2006,101(3):245-249.
[6]Tang C,Xue H,Bai C,et al.The effects of Tanshinone IIA on bloodbrain barrier and brain edema after transient middle cerebral artery occlusion in rats[J].Phytomedicine,2010,17(14):1145-1149.
[7]余喜讯,李莉华,冯志强,等.参麦注射液对兔缺血再灌流性肾损伤的预防作用研究[J].泸州医学院学报,2000,23(5):348-350.
[8]Spirlandeli AL,Deminice R,Jordao AA.Plasma malondialdehyde as biomarker of lipid peroxidation:effects of acute exercise[J].Int J Sports Med,2014,35(1):14-18.
[9]Schneeberger H,Schleibner S,Schilling M,et al.Prevention of acute renal failure after kidney transplantation by treatment with rh-SOD:interim analysis of a double-blind placebo-controlled trial[J].Transplant Proc,1990,22(5):2224-2225.
[10]卫蓉,丁应勇,张书国.参麦注射液加丹参酮注射液对气阴两虚夹血瘀型冠心病心绞痛的疗效观察及对同型半胱氨酸的影响[J].贵阳中医学院学报,2011,33(6):40-42.
