大鼠在体肠循环结合颈动脉取血研究非诺贝特纳米混悬剂的体内吸收
2014-11-02王永禄吕贝贝高天婴李学明南京工业大学药学院南京211816
王 栋,王永禄,叶 雯,吕贝贝,韩 杰,高天婴,李学明(南京工业大学药学院,南京 211816)
非诺贝特(fenofibrate)为第三代氯贝丁酯类降血脂药物,经口服吸收后,被体内脂酶水解后变成活性产物非诺贝酸而起效[1],是临床上常用的降脂调脂药物之一。非诺贝特在水中几乎不溶,所以口服吸收差,生 物 利 用 度 低[2]。 纳 米 混 悬 剂 (nanosuspensions)是适用于难溶性药物的新剂型,系将药物颗粒粉碎到纳米级后悬浮于分散介质中,从而增加药物的溶出速率,提高生物利用度[3]。本实验采用大鼠在体肠循环结合颈动脉取血的方法,更真实地模拟了正常的生理条件,研究了非诺贝特纳米混悬剂的在体肠吸收情况,并根据药时曲线计算其药动学参数,以求更全面深入地揭示非诺贝特纳米混悬剂在体内的肠吸收过程。
1 仪器与材料
1.1 仪器 高效液相色谱仪(日本岛津制作所,LC-20AT、SPD-20A);紫外可见分光光度计(北京普析通用仪器有限公司,TU-1901型);恒流蠕动泵(保定兰格恒流泵有限公司,BT00-300M型);电子分析天平(德国赛多利斯股份公司,BP211D型);数显恒温水浴锅(常州国华电器有限公司,HH-4型);医用低速离心机(金坛市正基仪器有限公司,80-2型);微型旋涡混合仪(上海沪西分析仪器厂,WH-2型);高压均质机(意大利 GEA Niro Soavi公司,NS1001L2K);纳米粒度分析仪(英国 Malvern仪器有限公司,3000HS);高剪切乳化器(上海弗鲁克流体机械制造有限公司);恒温磁力搅拌器(金坛市精达仪器制造厂)。
1.2 试药 非诺贝特原料药及对照品、非诺贝酸对照品均由徐州恩华药业公司提供;非诺贝特纳米混悬剂为自制,批号20110820;氯贝酸由上海安谱科学仪器有限公司提供,批号C11480000;泊洛沙姆188由南京威尔化工有限公司提供;PVP K30购自上海化学试剂公司;吐温80购自上海凌峰化学试剂有限公司;酚红购自南京奥多福尼生物科技有限公司;其余化学试剂均为分析纯;三蒸水为自制。
1.3 动物 SD大鼠,雄性,体质量为250g左右,共6只。动物许可证号:SCXK(沪)2011-2010。
2 方法与结果
2.1 非诺贝特纳米混悬剂的制备 将PVP K30和泊洛沙姆188溶于三蒸水中,加入非诺贝特适量,于85℃水浴中加热至熔融状态,再用高剪切乳化器以10 000r·min-1转速乳化3min,置于高压均质机中,以300和500bar循环3次,再以800bar循环12次,将得到的样品置于冰浴中,迅速冷却固化,即得到非诺贝特纳米混悬剂[4]。
2.2 肠循环液中酚红、非诺贝特及非诺贝酸的含量测定方法的建立
2.2.1 色谱条件 色谱柱:Kromasil C18柱(150mm×4.6mm,5μm);预柱:DIKMA(C18,10mm×4.6mm);流动相:甲醇-水(80∶20),用磷酸调pH 至3.0;柱温:25℃;检测波长:286nm;流速:1.0mL·min-1;进样量:20μL[5]。
2.2.2 溶液的配制 (1)Krebs-Ringer试液(pH 7.4,简称K-R试液)称取氯化钠7.8g、氯化钾0.35g、无水氯化镁0.02g、无水氯化钙0.37g、磷酸二氢钠0.32g、碳酸氢钠1.37g、葡萄糖1.4g,加三蒸水溶解并稀释至1L,即得。
(2)非诺贝特对照溶液 取非诺贝特对照品50mg,精密称定,置于100mL量瓶中,加无水乙醇溶解稀释至刻度,作为储备液;精密移取储备液20mL,置于100mL量瓶中,加0.1g·mL-1的吐温80溶液5mL,用K-R试液稀释至刻度。
(3)非诺贝酸对照溶液 取非诺贝酸对照品10mg,精密称定,置于100mL量瓶中,用K-R试液溶解并稀释至刻度,作为储备液;精密量取5mL,置于50mL量瓶中,加K-R试液稀释至刻度。
(4)混合对照液 精密量取非诺贝特储备液50mL、非诺贝酸储备液10mL,置于100mL量瓶中,精密加入0.1g·mL-1的吐温80溶液5mL,用K-R试液稀释刻度。
(5)空白肠循环液 取酚红30mg,精密称定,再称取2.2.1中各物质,加乙醇50mL及0.1g·mL-1的吐温80溶液50mL,用三蒸水溶解并稀释至1L。将配制好的溶液在体循环4h,中止实验,即得空白肠循环液。
(6)肠循环供试液 精密量取非诺贝特纳米混悬液适量,用空白肠循环液稀释至含非诺贝特约100μg·mL-1的溶液,在体循环4h后中止,即得肠循环供试液。
2.2.3 酚红标准曲线的制备 取酚红10mg,精密称定,置于100mL量瓶中,用K-R试液溶解并稀释至刻度,作为储备液。精密移取酚红储备液0.1,0.15,0.2,0.25,0.3,0.35和0.4mL,置于10mL 量瓶中,用0.01mol·L-1氢氧化钠溶液稀释至刻度,作为标准工作溶液。取上述标准工作溶液,以0.01mol·L-1氢氧化钠溶液为空白,于558nm测定吸光度,以吸光度A为纵坐标、酚红质量浓度C(μg·mL-1)为横坐标进行线性回归,回归方程:A=0.197 9C+0.003 9,r=0.999 3(n=5)。
2.2.4 非诺贝特及非诺贝酸含量测定方法 取供试溶液5mL,以10 000r·min-1离心5min,取上清液1mL,置于10mL量瓶中,加0.01mol·L-1氢氧化钠溶液稀释至刻度,作为待测溶液,以0.01mol·L-1氢氧化钠溶液为空白,于558nm测定吸光度,根据外标法计算酚红质量浓度。另取适量上清液,经0.45μm微孔滤膜过滤后,在2.2.1条件下进样测定,记录色谱图,按外标法计算肠循环液中非诺贝特和非诺贝酸的质量浓度。
2.2.5 方法专属性 分别取2.2.2项下(1)~(6)溶液,在2.2.1条件下注入液相色谱仪,记录色谱图,如图1。结果显示,肠循环样品液中非诺贝酸、非诺贝特的保留时间与对照品的一致,分别为5.3和12.8min。其他成分在色谱条件下不干扰测定。

图1 非诺贝特、非诺贝酸HPLC测定色谱图A.阴性对照液;B.非诺贝特对照液;C.非诺贝酸对照液;D.混合对照液;E.空白肠循环液;F.肠循环样品液;1.非诺贝酸;2.非诺贝特Fig.1 HPLC chromatograms for fenofibrate and fenofibric acidA.negative sample;B.fenofibrate reference solution;C.fenofibric acid reference solution;D.reference solution with fenofibrate and fenofibric acid;E.blank circumfusion solution;F.circumfusion solution;1.fenofibric acid;2.fenofibrate
2.2.6 线性 分别精密量取混合对照液0.01,0.1,0.5,2.5和5mL,置于10mL量瓶中,分别用 K-R试液稀释至刻度,作为标准工作溶液。取上述标准工作溶液,在2.2.1条件下进样,以色谱峰面积A为纵坐标、溶液质量浓度C为横坐标进行线性回归。结果显示,非诺贝特的回归方程为:A=63 218C-2 844,r=0.999(n=5),线性范围为0.25~124.68μg·mL-1;非诺贝酸的回归方程为:A=90 819C-501.25,r=0.999 9(n=5),线性范围为0.01~5.05μg·mL-1;表明二者线性均良好。
2.2.7 最低检测限考察 分别取非诺贝特对照液、非诺贝酸对照溶液逐步稀释,进样测定,以信噪比约为3∶1作为检测限,得非诺贝特及非诺贝酸的最低检测质量浓度分别为10.0和1.01ng·mL-1。
2.2.8 精密度 取2.2.6项下非诺贝特质量浓度为0.25,12.47和124.68μg·mL-1的3份混合溶液,在2.2.1条件下分别连续进样5次,记录色谱图,结果3种质量浓度下非诺贝特峰面积RSD分别为0.31%,0.05%和0.03%,非诺贝酸峰面积 RSD分别为0.84%,0.15%和0.04%。另取上述溶液置于冰箱中保存,分别在1,2,3,4和5d取样测定,记录色谱图,结果3种质量浓度下非诺贝特峰面积RSD分别为0.99%,0.16%和0.10%,非诺贝酸峰面积RSD分别为2.13%,0.33%和0.12%。实验结果表明方法日内和日间精密度均良好。
2.2.9 回收率 取混合对照品溶液1,2和3mL,分别置于10mL量瓶中,用K-R试液稀释至刻度,作为不同质量浓度的供试溶液。在2.2.1项条件下进行测定,记录色谱图,分别计算非诺贝特与非诺贝酸的回收率。结果如表1所示,结果表明方法回收率良好。
2.2.10 稳定性考察 将混合对照液置于37℃水浴中,放置4h后取出,用K-R试液稀释后在2.2.1项条件下测定,比较放置前后药物含量变化,结果放置后非诺贝特含量为放置前的98.24%,非诺贝酸含量为放置前的99.97%。实验结果表明在K-R试液中2种物质的稳定性均良好。
2.3 血浆药物质量浓度测定方法的建立
2.3.1 色谱条件 色谱柱:Kromasil C18柱(150mm×4.6mm,5μm);预柱:DIKMA(C18,10mm×4.6mm);流动相:甲醇-水(75∶25),磷酸调pH 至3.0;柱温:25℃;检测波长:286nm;流速:1.0mL·min-1;进样量:50μL。
2.3.2 血浆样品测定方法 取血浆样品100μL,置于1.5mL离心管中,加内标溶液50μL(100μg·mL-1的氯贝酸甲醇溶液),涡旋30s,再加入200μL蛋白沉淀剂(乙腈与1mol·L-1盐酸以95∶5配制而成),涡旋30s,再以12 000r·min-1转速离心处理15min,取上清液作为供试溶液,照2.3.1项下色谱条件测定。
2.3.3 方法专属性 分别配制空白血浆、空白血浆加内标、空白血浆加非诺贝酸以及大鼠体内给药后血样的供试溶液,在2.3.1条件下检测,结果如图2所示。

表1 回收率实验结果Tab.1 The result of recovery test

图2 方法专属性验证液相色谱图A.空白血浆;B.内标;C.非诺贝酸;D.动物给药血样Fig.2 HPLC chromatograms of plasma to verify the method specificityA.plasma blank;B.the internal standard;C.fenofibric acid;D.blood sample
由图2可见,内标(氯贝酸)的保留时间约为4.9min,非诺贝酸的保留时间约为8.5min。色谱峰峰形良好,血浆中内源性物质不干扰非诺贝酸的含量测定。
2.3.4 线性 取非诺贝酸对照品适量,精密称定,用甲醇溶解并稀释制成质量浓度约为20和200μg·mL-1的储备液 A 和 B,分别移取储备液 A 0.2,0.4,1和2mL,储备液B 0.4,1,1.5和2mL,置于10mL量瓶中,用甲醇稀释至刻度;分别取上述溶液50μL,用氮气吹干后加入空白血浆样品100μL,涡旋30s,照2.3.2处理得到血药质量浓度分别为0.2,0.4,1,2,4,10,15和20μg·mL-1的标准溶液;取上述溶液,在2.3.1条件下进行测定,记录色谱图,以非诺贝酸峰面积Ai与内标峰峰面积As之比Ai/As对血浆非诺贝酸质量浓度C(μg·mL-1)进行线性回归,得回归方程:A=0.210 5C+0.027 8,r=0.999 9(n=8),表明非诺贝酸血药质量浓度与峰面积在2~80μg·mL-1范围内呈良好的线性关系。
2.3.5 最低检测质量浓度 精密移取空白血浆100μL,向其中加入不同质量浓度非诺贝酸对照溶液,照2.3.2进行处理并测定,以信噪比约为3作为检测限,结果表明最低检测限为200ng·mL-1。
2.3.6 精密度 日内精密度 按2.3.2项下方法平行制备5份质量浓度为0.4,4和15μg·mL-1的样品溶液,并于同日测定,记录色谱图。结果显示3个质量浓度下血浆中非诺贝酸RSD值分别为6.41%,1.1%和0.16%,表明其日内精密度良好。
日间精密度 取日内精密度项下供试溶液,分别在1,2,3,4和5d取样测定,记录色谱图。结果显示,5d内非诺贝酸的RSD分别为4.65%,1.12%和0.2%,其日间精密度良好。
2.3.7 冻融稳定性实验 取2.3.4项下质量浓度为0.4,4和15μg·mL-1的样品溶液,置于-80℃冰箱冷藏1周,取出,用37℃水浴解冻后,测定其血药质量浓度,并将结果与室温放置的样品进行比较。结果见表2。由表2可知,在室温下以及在冰箱内冷冻保存后再复融的3种质量浓度的非诺贝酸血浆样品测定值RSD均小于5%,表明在冷冻条件下,大鼠待测血浆样品较为稳定,因此,待测血浆样品在冷冻条件下保存1周不会影响实验测定结果的准确性。
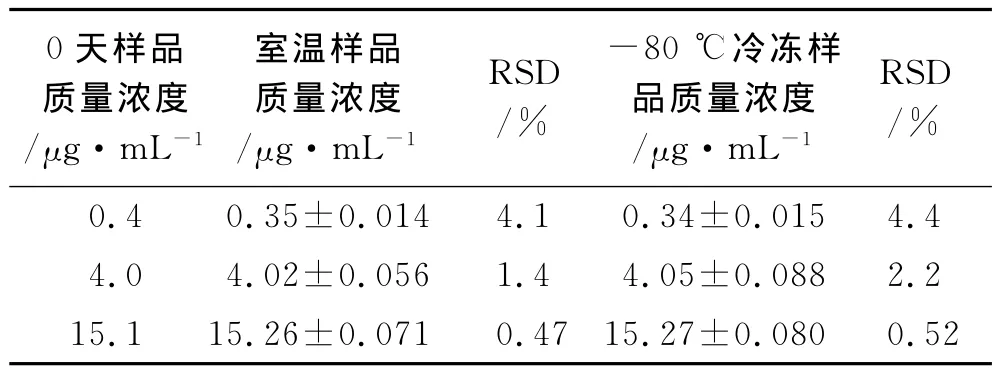
表2 冻融过程对含量测定的影响Tab.2 Stability of plasma samples in freezing conditions(n=3)
2.4 大鼠在体肠循环结合颈动脉取血实验
2.4.1 实验方法 实验前大鼠禁食24h,称体质量后,于腹腔注射乌拉坦溶液(0.01mL·g-1)麻醉固定,在颈动脉处做好取血准备。沿腹中线打开腹腔(切口约2.5cm长),找出并结扎胆管,于实验肠段两端各切一小口,在切口处分别插入玻璃管并扎紧。用注射器从上切口处缓缓注入37℃的生理盐水清洗肠管至净。再将肠管两端的玻璃管与蠕动泵连接形成回路。用蠕动泵将供试液以5mL·min-1流速循环10min后,调节流速为2.5mL·min-1,并立即自供试液锥形瓶中取样5mL,作为测定零时刻肠循环液样品,并向锥形瓶中补加酚红液5mL。同时,从大鼠颈动脉取血1mL,置于肝素化刻度离心管中,其后每隔30min亦按同法取肠循环液(补加酚红KR液)和血样,循环4h后,中止实验。肠循环样品照2.2.4进行测定,结果以酚红为参比进行校正,血样照2.3.2方法处理后测定。实验结果如表3所示。
由表3数据可知,随着肠腔中药物含量的逐渐减少,血中药物质量浓度逐渐升高,从而印证了体外循环液中药物的消失是因为吸收入血的结果。
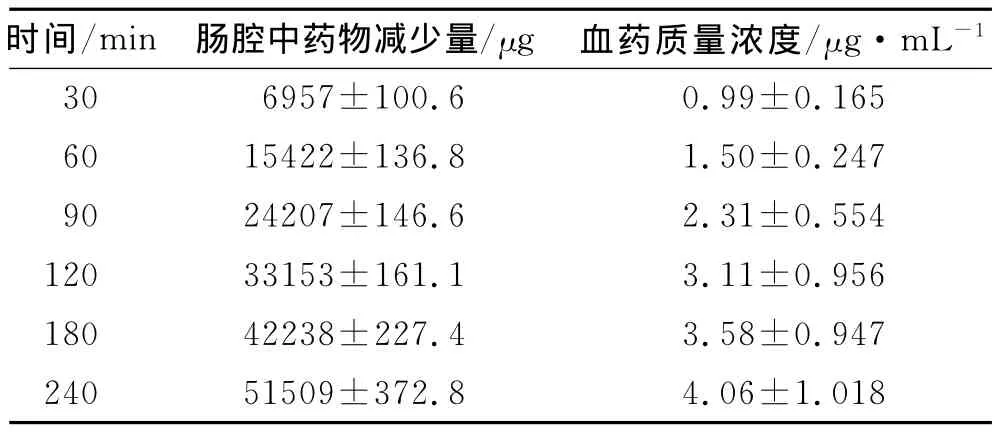
表3 大鼠在体肠循环结合颈动脉取血中肠内药物减少量及血药质量浓度Tab.3 The reductions in the intestine and the concentration in plasma of fenofibrate
2.4.2 大鼠肠腔内药物减少量与血药质量浓度的相关性 以大鼠在体肠循环结合颈动脉取血实验中的肠腔内药物累计减少量为自变量(x)、血药质量浓度为因变量(y),进行线性回归,线性方程:y=7×10-5x
+0.521 9,r=0.993 6。
3 讨论
3.1 血浆药物浓度检测方法 本实验参照有关文献建立了大鼠血浆中非诺贝特降解活性代谢物非诺贝酸的HPLC检测方法,血浆中内源物质不干扰非诺贝酸的含量测定,方法简单快捷,专属性强。大鼠血浆中药物线性关系良好(r=0.997 5,n=8),准确度在90%~110%之间,日间和日内精密度小于10%,最低检测限为100ng·mL-1,冻融实验符合要求,该方法能够满足血浆样品中非诺贝酸的测定要求。
3.2 动物体内吸收的研究方法 本课题中所采用的动物实验方法为改良的肠襻法,传统的肠襻法是将大鼠的肠腔结扎,有时需要做部位研究时,也可以分段结扎肠腔。将药物溶液注入到肠襻中,经过一定时间的吸收后,取出肠襻,收集冲洗肠腔内肠液,测定剩余的药物量[6]。根据药物的减少量来了解药物在肠腔的吸收情况。肠襻法可以考察药物的吸收情况和部位差异,以及促进剂的促吸收效果,在实验过程中避免破坏血液供应和淋巴流。
在体肠循环法虽然与正常的生理条件最为接近,但是实验手术对大鼠生理特征的改变必定会影响正常的药物体内行为。此外,在操作过程中,麻醉、背位固定的方式及连续取血等操作也经常会加速大鼠的死亡,影响血样的正常采集和数据的完整。
鉴于体内血药质量浓度测定与在体肠灌注法研究药物体内吸收均存在各自的优缺点,本课题采用两种方法相结合的方式,同时研究非诺贝特纳米混悬剂在大鼠体内的肠吸收与体内药动学过程,以求更全面深入地揭示非诺贝特纳米混悬剂的体内吸收过程。实验结果表明,大鼠在体肠循环实验与动物整体的药物吸收程度有较好的相关性,血药质量浓度与肠腔中药物减少量在相应的各个时间点分别相关,相关系数r=0.993 6,可以判定两者为点对点相关,相关水平最高,此时肠吸收药量可以直接反映药物吸收入血的程度[7],提示在体肠循环模型可用于非诺贝特纳米混悬剂的处方优化,预测非诺贝特的体内吸收情况。
[1]Hanafy A,Spahn-Langguth H,Vergnault G,et al.Pharmacokinetic evaluation of oral fenofibrate nanosuspensions and SLN in comparison to conventional suspensions of micronized drug[J].Adv Drug Del Rev,2007,59(6):419-426.
[2]刘秀美,王凌,蒋学华.HPLC测定大鼠血浆中非诺贝特的活性代谢物及其药动学研究[J].华西药学杂志,2012,27(4):424-427.
[3]Xueming Li,Li Gu,Yuanlong Xu,et al.Preparation of fenofibrate nanosuspension and study of its pharmacokinetic behavior in rats[J].Drug Dev Ind Pharm,2009,35(7):827-833.
[4]黄琴琴,李学明,王永禄,等.高效液相色谱法同时测定大鼠在体肠循环液中非诺贝特和非诺贝酸的含量[J].中国医院药学杂志,2011,31(17):1429-1432.
[5]孙小虎,黄琴琴,王永禄,等.非诺贝特纳米混悬剂大鼠在体肠吸收动力学研究[J].中国药学杂志,2012,47(22):1844-1849.
[6]王科燕,张永军,樊莲莲,等.阿苯达唑自微乳大鼠在体肠 吸 收 研 究 [J].西 北 药 学 杂 志,2009,24(5):375-376.
[7]N Fottaki,A Aivaliotis,J Butler,et al.A comparative study of different release apparatus in generating in vitro-in vivo correlations for extended release formulations[J].Eur J Pharm Biopharm,2009,73(1):115-120.
