丁香叶的提取工艺研究
2014-11-02张继业杨范莉西安交通大学药学院西安7006西安交通大学第一附属医院西安7006
张继业,杨范莉,童 华(.西安交通大学药学院,西安 7006;2.西安交通大学第一附属医院,西安 7006)
丁香叶folium syringae来源于木犀科Oleaceae丁香属Syringa植物紫丁香Syringa oblata Lindl.、朝鲜丁香Syringa diatata Nakai、洋丁香Syringa Vulgaris L.的干燥叶[1],具有抗菌消炎、抗病毒[2-3]、降压、镇咳祛痰、保肝护胆等作用[2,4-5],且毒副作用较小,其有效成分为原儿茶醛及原儿茶酸[2]。提取工艺研究是中药有效成分研究的重要组成部分,本文以原儿茶醛及原儿茶酸为指标成分初步地研究提取方法,并测定了有效成分的含量。
1 仪器与试药
1.1 仪器 LC-10A 液相色 谱系统,包 括 LC-10ATvp色谱泵,SPD-10Avp检测器及CLASS-vp工作站(日本岛津);TGL-16LC型离心机(上海安亭科学仪器厂)。
1.2 试药 紫丁香叶(西安市药材市场,经鉴定为药典规定药材);原儿茶酸(批号110809-200604)和原儿茶醛对照品(批号11810-200506)购自中国食品药品检定研究院;甲醇为色谱纯;水为超纯水;其余试剂为分析纯。
2 方法与结果
2.1 原儿茶醛和原儿茶酸的含量测定方法 采用高效液相色谱法测定。色谱条件:色谱柱:Planetsil C18(150mm×4.6mm,5μm);流动相:甲醇-水-冰醋酸(12∶78∶0.5);流速:1.0mL·min-1;检测波长:280nm;柱温:30℃。
2.2 提取方法
2.2.1 溶剂倍数的影响 取干燥的紫丁香叶粉碎,过120目筛,备用。取3份紫丁香叶细粉1g,精密称定,置于圆底烧瓶中,分别加入50,100和200mL水,回流提取5h,滤过;用盐酸调节滤液pH至2,用乙酸乙酯萃取3次,每次40mL,合并乙酸乙酯液;挥干溶剂,残渣加甲醇适量溶解,转移至10mL量瓶中,定容,滤过,取续滤液进样10μL分析。结果见表1。
2.2.2 提取时间的影响 取3份紫丁香叶细粉1g,精密称定,置于圆底烧瓶中,加入100mL水,分别回流提取3,5和7h,滤过;用盐酸调节滤液pH至2,用乙酸乙酯萃取3次,每次40mL,合并乙酸乙酯液;挥干溶剂,残渣加甲醇适量溶解,转移至10mL量瓶中,定容,滤过,取续滤液进样10μL分析。结果见表1。
2.2.3 回流次数的影响 取3份紫丁香叶细粉1g,精密称定,置于圆底烧瓶中,加入100mL水,均回流提取5h,分别回流1次,2次(3h,2h),3次(2,2,1h)后,提取液滤过;盐酸调节滤液pH至2,用乙酸乙酯萃取3次,每次40mL,合并乙酸乙酯液;挥干溶剂,残渣加甲醇适量溶解,转移至10mL量瓶中,定容,滤过,取续滤液进样10μL分析。结果见表1。

表1 不同提取因素对指标成分含量的影响Tab.1 The influence of extraction factors on the component content
综上所述,对紫丁香叶中原儿茶酸和原儿茶醛同时进行提取,选择水为溶剂,当样品量为1g、溶剂量为100mL、回流时间为5h、回流3次时(2h,2h,1h),提取率相对较高。
2.3 方法学考察
2.3.1 专属性 在所选色谱条件下,样品中原儿茶酸和原儿茶醛峰形和分离度良好,如图1所示,该方法具有良好的专属性。
2.3.2 标准曲线 分别精密吸取5,7.5,10,12.5和15μL的原儿茶酸和原儿茶醛对照品混合溶液,进样,测定峰面积积分值,以进样量(μg)为横坐标、峰面积为纵坐标进行回归,得到的线性回归方程分别为:Y=28 294 X+12 322,r=0.999 7(线性范围0.073~0.219μg);Y =22 294 X +3 694.4,r=0.999 6(线性范围0.024 5~0.073 5μg)。
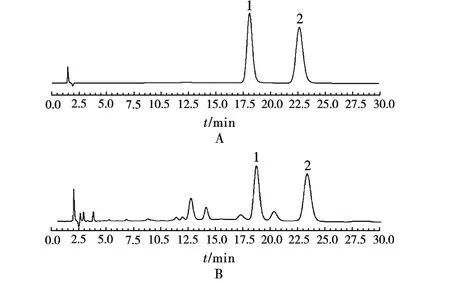
图1 HPLC图A.混合对照品;B.样品;1.原儿茶酸;2.原儿茶醛Fig.1 HPLC chromatogramsA.mixed reference;B.sample;1.protocatechuic acid;2.protocatechualdehyde
2.3.3 精密度 原儿茶酸和原儿茶醛对照品溶液精密度:根据样品所测的原儿茶酸的质量浓度,精密量取原儿茶酸和原儿茶醛混合对照品储备液5mL,稀释到10mL作为原儿茶酸和原儿茶醛的混合对照品溶液,在相同条件下,连续进样6次,测得其精密度RSD为0.7%和0.8%。
样品精密度:精密称取柴丁香叶细粉1.0g,用100倍量的水回流提取3次(第1次2h,第2次2h,第3次1h)后,滤过,滤液浓缩至100mL,用盐酸调节pH至2.0,用乙酸乙酯萃取3次,每次40mL,合并乙酸乙酯液,挥干,残渣加甲醇溶解并定容至10 mL的量瓶中,滤过。精密吸取续滤液10μL,重复进样6次,测定其峰面积。原儿茶酸和原儿茶醛的RSD分别为1.0%和2.4%。
2.3.4 重复性 取同一批紫丁香叶药材约1.0g,精密称定,共5份,按供试品溶液制备方法制备,并按上述色谱条件测定,原儿茶酸和原儿茶醛含量的RSD分别为1.8%和1.4%。
2.3.5 稳定性 精密称取紫丁香叶药材1.0g,按供试品溶液制备方法制备,并在配制好的0,2,4,8,12,24和48h测定,结果表明样品溶液在48h内稳定。
2.3.6 加样回收率 取已知含量的样品,研细,精密称取6份(每份约0.5g),分别置于索氏提取器中,再精密量取适量原儿茶醛及原儿茶酸对照品溶液(预先配制的与样品中原儿茶醛及原儿茶酸含量相当的对照品溶液),分别加入样品中,按供试品溶液制备方法制备,并按上述色谱条件测试,计算回收率。原儿茶醛回收率为98.6%,RSD为1.50%;原儿茶酸回收率为98.2%,RSD为0.889%(n=6)。
2.4 不同批次药材含量测定 取干燥的紫丁香叶粉末约1g,精密称定,按供试品处理方法处理,进样10μL分析,测得峰面积积分值,计算原儿茶酸和原儿茶醛含量,结果见表2。

表2 3批紫丁香叶药材中有效成分含量测定结果Tab.2 Contents of protocatechuic acid and protocatechualdehyde in three batches of folium syringae (n=5)
3 讨论
在选择提取溶剂时,首先选择了不同体积分数的乙醇溶液按照同一种提取方式(超声1h)对紫丁香叶中的原儿茶酸和原儿茶醛同时进行提取,但含量较低,原因可能是提取溶剂或提取方式不合适。回流提取后,仍没有获得较好的提取效果,根据原儿茶酸和原儿茶醛的性质,其为酚酸类成分,具有水溶性,采用水为溶剂进行提取。
溶剂量与提取效果紧密相关,当溶剂倍数为100倍时,对紫丁香叶中的原儿茶酸和原儿茶醛基本完全提取。提取回流时间过长,导致原儿茶酸和原儿茶醛的含量下降,可能是原儿茶酸和原儿茶醛对热不稳定所致。
[1]李永吉,吕邵娃,王艳宏,等.丁香叶药用研究进展[J].中医药信息,2003,20(1):22-24.
[2]米杰,滕佳琳.以丁香命名的几种中草药[J].山东中医杂志,1995,14(6):267.
[3]李倩,廖予菲,杨洋,等.HPLC-TOF-MS法优选麻黄中麻黄碱的提取工艺[J].西北药学杂志,2013,28(1):4-7.
[4]王丹丹,刘盛泉,陈英杰,等.紫丁香有效成分的研究[J].药学学报,1982,17(12):951-954.
[5]王克辉,李宗友.紫丁香素的降压作用[J].国外医学中医中药分册,1997,19(1):32-33.
