非诺贝特对凝胶包埋培养的原代大鼠肝细胞的毒性
2011-01-16周喆鲁燕华孟琴
周喆,鲁燕华,孟琴
(浙江大学化学工程与生物工程学系,浙江杭州310027)
非诺贝特对凝胶包埋培养的原代大鼠肝细胞的毒性
周喆,鲁燕华,孟琴
(浙江大学化学工程与生物工程学系,浙江杭州310027)
目的研究非诺贝特对凝胶包埋培养的原代大鼠肝细胞内氧化压力和脂质含量的影响。方法将收获得到的新鲜原代大鼠肝细胞进行胶原凝胶包埋,构建肝细胞体外凝胶包埋培养模型,同时构建传统平板模型作为对照。在肝细胞培养过程中加入非诺贝特25和100 μmol·L-1,分别于培养3和7 d后,检测细胞内活性氧类(ROS)、丙二醛(MDA)、甘油三酯(TG)含量,并用尼罗红和油红O对细胞内中性脂滴进行定量分析和染色观察。结果平板模型非诺贝特各组之间没有显著性差异,而凝胶包埋模型非诺贝特各组之间差异明显。对于凝胶包埋模型,非诺贝特25和100 μmol·L-1均导致细胞内ROS增加,其中非诺贝特处理3 d组细胞内ROS分别为对照组的(131±19)%和(149±10)%,非诺贝特处理7 d组细胞内ROS分别为正常对照组的(121±8)%和(117±5)%(P<0.01);非诺贝特还导致了胞内MDA含量、TG和中性脂含量的显著增加(P<0.05)。结论凝胶包埋培养原代大鼠肝细胞作为体外培养模型相对于平板模型能更好地反映非诺贝特的肝毒性作用。
非诺贝特;共同培养技术;肝;毒性作用
非诺贝特(fenofibrate)作为第二代贝特类降血脂药物被广泛应用于临床。具有降低血液中甘油三酯(triglycerides,TG)、升高血液中高密度脂蛋白胆固醇等作用。在体内,非诺贝特能调控脂肪酸转运蛋白、肉毒碱棕榈酰基转移酶、乙酰辅酶A羧化酶和脂肪酸合成酶等基因的表达,从而影响胞内脂肪代谢[1-2]。虽然非诺贝特在临床上被认为是安全的,但是在啮齿类动物体内实验中发现非诺贝特会引发肝毒性[3]。有文献报道服用非诺贝特后的小鼠体内肝TG含量上升[4]。产生这一现象的原因是非诺贝特虽然促进了肝中脂肪酸的代谢(氧化、转运和合成),但脂肪酸的氧化速率仍低于转运和合成速率,最终导致肝中脂质的堆积。此外,体内报道非诺贝特可诱导细胞内活性氧类(reactive oxygen species,ROS)的产生,从而引起胞内过氧化压力并进一步造成DNA损伤[5-7]。
然而,目前尚未见体外肝细胞培养反映非诺贝特在啮齿类动物中造成的肝毒性,可能与体外二维单层贴壁培养模型不能较好地反映肝的脂质代谢情况有关。单层贴壁培养的肝细胞很快丧失肝分化功能,其代谢情况与体内差别较大,且在毒性评价过程中易产生假阴性结果[8]。本实验室改进的凝胶包埋肝细胞模型,能够较好地模拟体内细胞间微环境保证代谢功能的长期维持,且可以成功反映利福平、四环素和硫唑嘌呤等20种药物的体内肝毒性[9-11]。
本实验采用凝胶包埋培养的原代大鼠肝细胞作为体外肝细胞模型考察非诺贝特的毒性影响。
1 材料与方法
1.1 动物
Sprague-Dawley大鼠,雌雄不拘,体质量200~250 g,动物许可证号:SCXK浙2008-0033,由浙江医学科学院动物实验中心提供。
1.2 药品与试剂
非诺贝特,尼罗红,胰岛素,地塞米松,表皮生长因子(epithelial growth factor,EGF)和高血糖素Ⅳ型胶原酶由美国Sigma公司生产,William E培养基由美国Gibco公司生产,胎牛血清由杭州四季青牧场生产,L-谷氨酰胺,青霉素和链霉素由美国Amresco公司生产。Ⅰ型胶原参考文献中的方法[8]由实验室自行制备。双氢罗丹明购自德国Invitrogen公司。甘油三酯检测试剂盒由宁波塞克生物技术有限公司提供。其余药品与试剂均为国产分析纯或优级纯试剂。
1.3 肝细胞的收获与培养
肝细胞的收获和胶原凝胶培养方法参考文献[14]。大鼠ip麻醉后,门静脉插针固定,用37℃灌流液Ⅰ(g·L-1:NaCl 8.3,KCl 0.5,EGTA 0.95)灌流10 min后改用含0.05 g·L-1胶原酶的灌流液Ⅱ(g·L-1:NaCl 3.9,KCl 0.5,CaCl20.7)灌流10 min。将分离得到的的肝细胞纯化处理后,进行计数,细胞活率高于85%时可用于实验。细胞收获下来之后,首先在4℃下将4×William E浓缩培养基与鼠尾Ⅰ型胶原按1∶3的体积比混合后,调节pH至7.4。原代大鼠肝细胞1×109L-1加入胶原与培养基的混合溶液中并混合均匀。将细胞培养于中空纤维丝内并置入6孔板底部。在孔板中加入培养基并放入5%CO2培养相中于37℃培养。
1.4 细胞分组
细胞包埋完成后,加入William E培养基进行培养,培养基添加成分有L-谷氨酰胺2 mmol·L-1、青霉素100 kU·L-1、链霉素100 mg·L-1、地塞米松1 μmol·L-1、胰岛素0.2 kU·L-1、高血糖素4 μg·L-1、表皮生长因子5 μg·L-1以及5%胎牛血清。在非诺贝特组培养基中添加非诺贝特母液使其终浓度分别为25和100 μmol·L-1。每2 d更换1次培养基,并重新加药。在培养的第3天和第7天取样并进行分析。在考察非诺贝特对细胞利用游离脂肪酸的实验中,添加了非诺贝特25 μmol·L-1及棕榈酸200 μmol·L-1,2 d后检测各组细胞内TG含量。
1.5 荧光染色检测ROS
采用双氢罗丹明123染料检测肝细胞内ROS。细胞内罗丹明123的荧光强度,反映细胞内ROS水平。将凝胶包埋的细胞从中空丝中打出,迅速置于双氢罗丹明10 μmol·L-1的PBS中,37℃温育30 min。用荧光酶标仪(Tecan公司,德国)读取荧光值,激发波长为488 nm,发射波长为535 nm[13]。ROS(%)=加药组荧光值/正常组荧光值×100%。
1.6 硫代巴比妥酸(TBA)检测丙二醛(MDA)含量
MDA用反应检测[14]。在冰浴环境下将凝胶包埋的细胞收集至1.5 ml离心管中,加入0.3 ml磷酸0.88 mmol·L-1和0.1 ml TBA溶液42 mmol·L-1,然后将离心管封口并置于沸水中,1 h后取出离心管并离心5 min(8000×g)除去细胞碎片。对反应后的样品用1100型高效液相色谱进行分析(美国安捷伦公司),分离柱为ChromSpher C18栓(150 mm×4.6 mm,5 μm)。流动相为甲醇-磷酸缓冲液0.01 mmol·L-1(pH 7.0)=65∶35,流速为1 ml·min-1,检测波长为532 nm。
1.7 甘油三酯含量的测定
4℃下将凝胶包埋的细胞放入PBS中并超声破胞。向破胞后的混合液中加入氯仿/甲醇(2∶1)萃取其中的脂肪[15]。室温下使氯仿挥发干净并用6 μl正丁醇溶解剩余的脂肪。最后用甘油三酯测定试剂盒检测胞内TG含量。
1.8 尼罗红荧光检测肝细胞内中性脂
将凝胶包埋的细胞从中空丝中打出,迅速置于含尼罗红3 μmol·L-1的PBS中,37℃温育30 min。用荧光酶标仪读取荧光值,激发波长为580 nm,发射波长为630 nm[10]。尼罗红(%)=加药组荧光值/正常组荧光值×100%。
1.9 油红O染色检测肝细胞内中性脂
称取1 g油红O固体,加入100 ml异丙醇,并置于80℃水浴加热1 h,使其充分溶解,冷却后用滤纸过滤。按1∶1的比例,加入去离子水,混匀后静置1 h以上,用滤纸过滤。
将细胞培养样品用10%甲醛(V/V)固定2 h以上,除去甲醛,加入20%异丙醇水溶液。清洗数秒钟后,加入过滤好的油红O染液,染色10 min,除去油红O染液。加入50%异丙醇溶液,洗涤10 s,重复2遍后在显微镜下观察并拍照记录。
1.10 实验结果数据以±s表示。采用SPSS10.0软件,各组均数先行方差齐性检验,样本均数的比较采用方差分析及t检验。
2 结果
2.1 非诺贝特对凝胶包埋培养的肝细胞内ROS的影响
凝胶包埋的肝细胞内ROS分析结果如图1A所示。药物处理3 d后,非诺贝特25和100 μmol·L-1均显著增加肝细胞内ROS的积累量,分别从正常对照组的(100±9)%增加到(131±19)%和(149±10)%。加药7 d后,非诺贝特25和100 μmol·L-1处理又分别使得肝细胞内ROS积累量增加至对照组的(121±8)%和(117±5)%。但是,对两个浓度处理组进行比较,可以发现,3 d时ROS的积累量随非诺贝特浓度增加而增加,即非诺贝特100 μmol·L-1组ROS积累量显著大于非诺贝特25 μmol·L-1组,但这种浓度依赖性随培养时间延长(7 d)而消失。图1B显示的是非诺贝特对传统平板培养模型中肝细胞内ROS的影响。由于该平板培养肝细胞在7 d时很难存活,对各项细胞指标的检测毫无意义,因此只在3 d取样进行分析。由图可以看出在平板模型中,两个浓度的非诺贝特均没有导致ROS上升,各组之间没有显著性差异,这与体内报道的趋势不符。
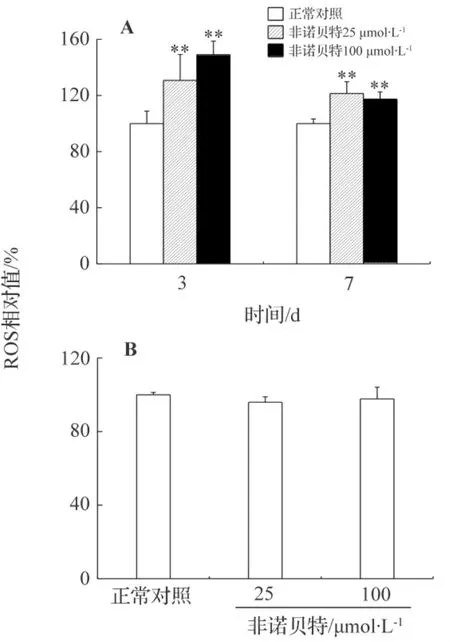
图1 非诺贝特对凝胶包埋(A)和平板(B)模型中肝细胞活性氧类(ROS)的影响.平板培养的细胞3 d取样.采用双氢罗丹明荧光染色法检测ROS.ROS(%)=加药组荧光值/正常培养组荧光值×100%.x¯±s,n=3.**P<0.01,与正常对照组比较.Fig.1 Effect of fenofibrate on reactive oxygen species(ROS)of hepatocytes in gel entrapped(A)and monolayer(B)culture models.
2.2 非诺贝特对凝胶包埋培养的肝细胞MDA含量的影响
由图2A分析结果可知,在凝胶包埋模型中,非诺贝特25和100 μmol·L-1在3 d时MDA已经出现了增多,分别为正常对照组的(113±8)%和(110±6)%。7 d时非诺贝特组胞内MDA继续上升,分别为正常对照组的(127±16)%和(125±21)%。这一结果与图1A中ROS的变化情况是一致的,说明非诺贝特增加了肝细胞内的氧化应激,并进一步导致了胞内脂质过氧化。而在平板培养模型中,非诺贝特均能使胞内MDA出现显著上升,但非诺贝特25和100 μmol·L-1之间无显著性差异(图2B)。
2.3 非诺贝特对凝胶包埋培养的肝细胞甘油三酯的含量影响
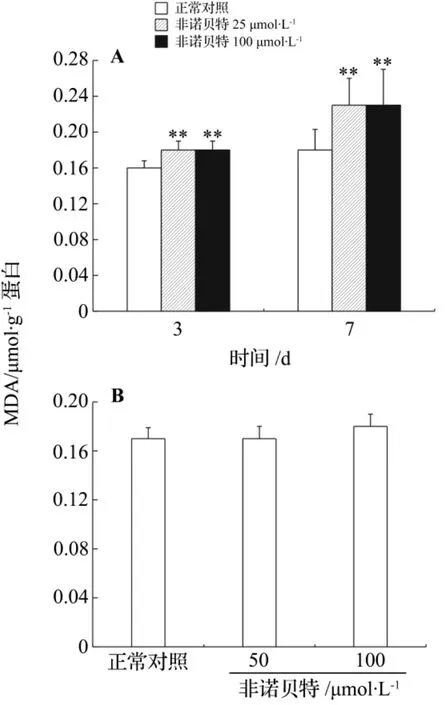
图2 非诺贝特对凝胶包埋(A)和平板(B)模型中肝细胞丙二醛含量(MDA)的影响.分组处理同图1.±s,n=3.**P<0.01,与正常对照组比较.Fig.2 Effect of fenofibrate on malonaldehyde(MDA)content of hepatocytes in gel entrapped(A)and monolayer(B)culture models.
凝胶包埋(图3A)和平板培养(图3B)3 d的肝细胞内TG含量分别为18.5±2.8和(58.1±20.4)μmol·g-1蛋白。而文献报道的体内值为(15.6±2.6)μmol·g-1蛋白。很显然,凝胶包埋的肝细胞内甘油三酯含量更接近体内值。培养3 d后,与凝胶包埋的正常对照组相比,非诺贝特25和100 μmol·L-1组胞内TG的含量分别为24.7±5.0和(25.2±5.0)μmol·g-1蛋白。培养7 d后,凝胶包埋正常对照组肝细胞TG含量为(23.3±5.9)μmol·g-1蛋白,非诺贝特25和100 μmol·L-1组肝细胞内TG含量则分别增加到30.2±4.2和(28.0±4.7)μmol·g-1蛋白。提示非诺贝特使肝细胞内产生了脂肪积累的现象。而在平板培养模型(图3B)中,非诺贝特都没有造成胞内TG含量的显著变化。
2.4 非诺贝特对凝胶包埋的肝细胞中性脂的影响
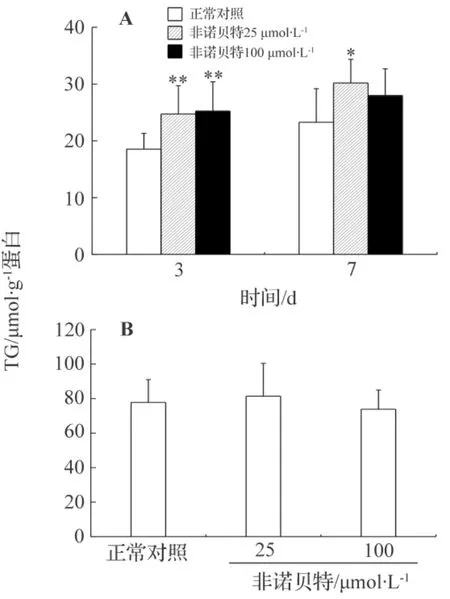
图3 非诺贝特对凝胶包埋(A)和平板模型(B)中肝细胞甘油三酯含量的影响.细胞处理同图1.甘油三酯含量用酶法剂盒检测.x¯±s,n=3.*P<0.05,**P<0.01,与正常对照组比较.Fig.3 Effect of fenofibrate on intracellular TG content of hepatocytes in gel entrapped(A)and monolayer(B)culture models.
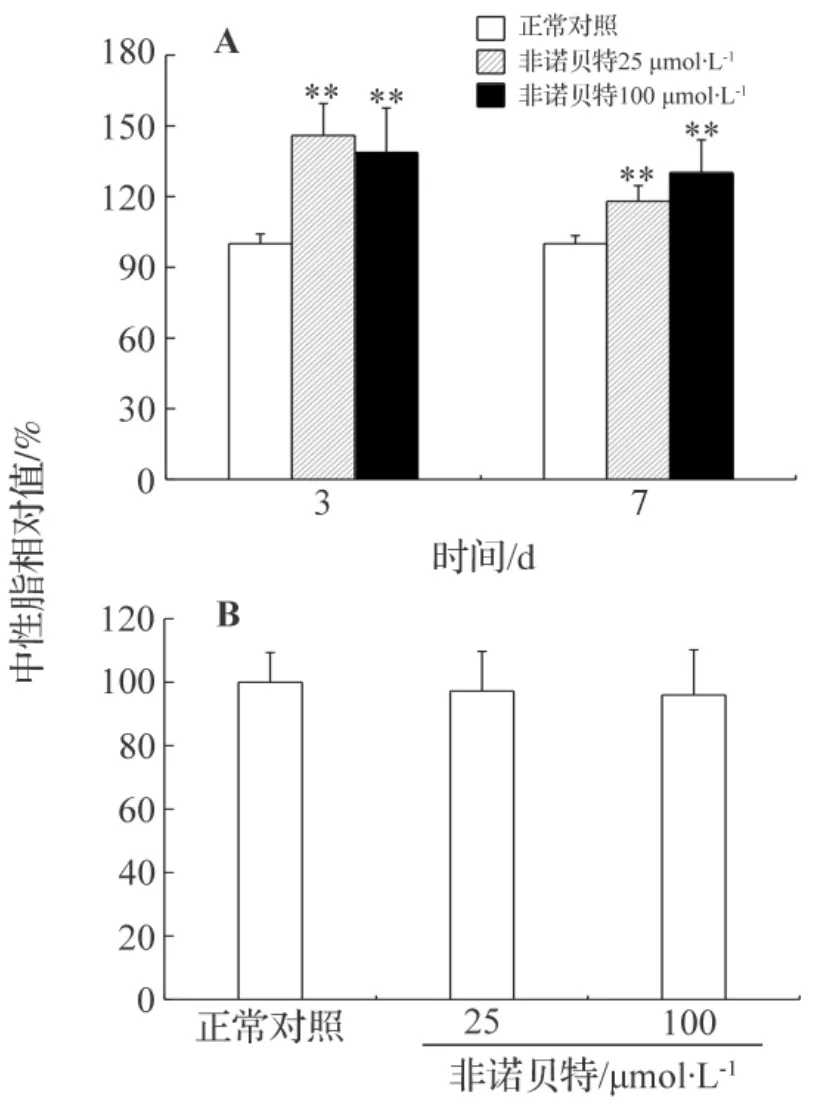
图4 非诺贝特对凝胶包埋(A)和平板(B)模型中肝细胞中性脂含量的影响.细胞处理同图1.用尼罗红荧光染色法检测肝细胞内中性脂.x¯±s,n=3.**P<0.01,与正常对照组比较.Fig.4 Effect of fenofibrate on intracellular natural lipid level of hepatocytes in gel entrapped(A)and monolayer(B)culture models.
细胞尼罗红荧光染色分析,结果如图4所示。对于凝胶包埋模型培养的细胞,加药3 d后,非诺贝特25和100 μmol·L-1分别使尼罗红荧光值提高为正常对照组的(146±15)%和(139±19)%。加药7 d后,非诺贝特组的胞内荧光值虽略有下降但仍比正常对照组高,分别是正常对照组的(118±7)%和(130±14)%。尼罗红荧光分析结果显示,非诺贝特能导致肝细胞内的脂质积累。而平板模型培养的细胞各加药组之间却并没有显著的区别(图4B)。凝胶包埋模型加药3 d和7 d后各组肝细胞油红O染色。结果如图5所示。药物作用3 d后,细胞内中性脂滴明显多于正常对照组,且非诺贝特25 μmol·L-1组脂滴最多。培养7 d后,非诺贝特组胞内脂滴积累情况更严重,脂滴有增多、变大的趋势。油红O染色分析结果进一步验证非诺贝特作用会导致肝细胞内的脂质积累。
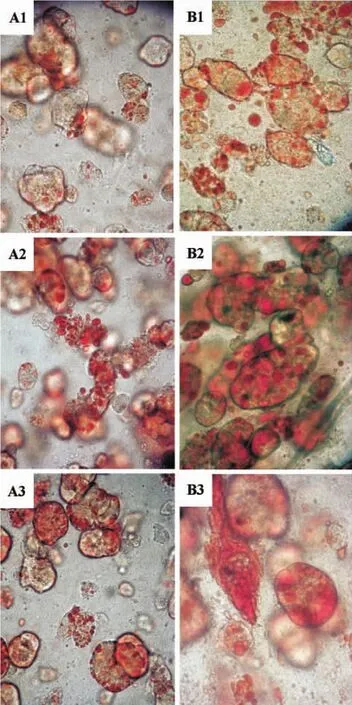
图5 光学显微镜下凝胶包埋的肝细胞中性脂的影响油红O染色(×400).细胞处理同图1.A:培养3 d;B:培养7 d.1-3分别为正常对照、非诺贝特25和100 μmol·L-1组.Fig.5 Light microscopic morphology of intracellular neutral lipid drops in gel entrapped hepatocytes stained with Oil red O(×400).
2.5 非诺贝特对凝胶包埋肝细胞利用游离脂肪酸的影响
为了进一步阐述非诺贝特对凝胶细胞脂肪代谢能力的影响,选用无血清培养基对该肝细胞进行培养,并添加棕榈酸200 μmol·L-1,考察脂肪酸单独使用及其与非诺贝特25 μmol·L-1合用两种情况对肝细胞胞内脂肪代谢的调节作用。由图6可以看出,经过2 d的作用,非诺贝特组细胞内TG含量与正常对照组基本持平,而外加棕榈酸的细胞组胞内TG含量是正常对照组的1.44倍。棕榈酸和非诺贝特的共同作用尤其显著,可使细胞内TG含量升高至正常对照组的1.93倍。
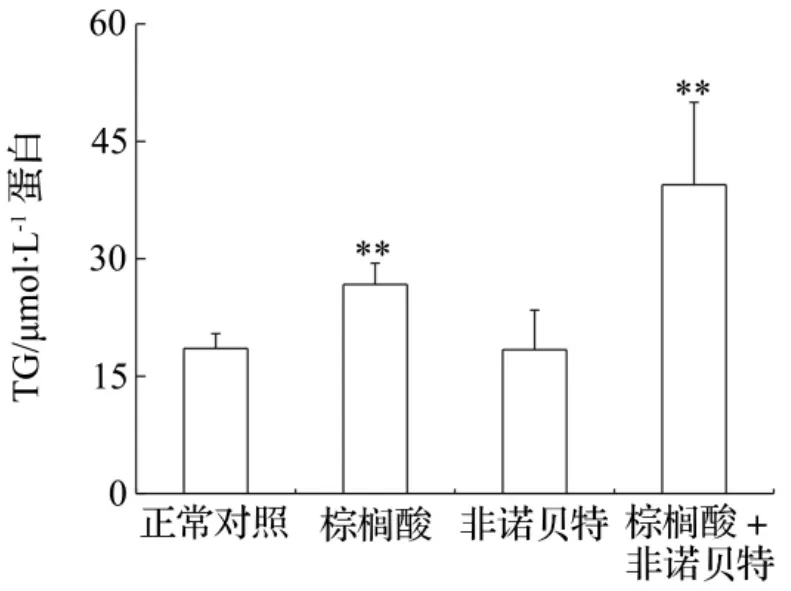
图6 非诺贝特对凝胶包埋的大鼠肝细胞利用脂肪酸能力的影响.培养于无血清培养基中.在培养过程中加入棕榈酸200 μmol·L-1或非诺贝特25μmol·L-1,或添加两者的混合物.2 d后检测胞内TG含量.x¯±s,n=3.**P<0.01,与正常对照组比较.Fig.7 Effect of utility of fenofibrate on free fatty acid in gel entrapped hepatocytes.
3 讨论
本研究结果发现,平板培养肝细胞对非诺贝特的处理没有表现出明显的脂肪堆积和氧化压力,而凝胶培养肝细胞却表现出与体内相符的毒性反应。凝胶培养肝细胞经过非诺贝特的处理,出现ROS和MDA等氧化应激标志物的上升、过量脂质的堆积现象,而油红O染色分析结果进一步验证了非诺贝特作用促进肝细胞内产生脂肪积累的现象。由上面的结果可知,凝胶包埋模型对于非诺贝特的短期作用比较敏感,更接近体内情况。肝细胞的不同培养模式对非诺贝特的不同毒性反应可能与其细胞本身的差异性表现有关。在无任何药物处理的正常培养情况下,平板和凝胶包埋培养的肝细胞胞内TG含量分别为58.1±20.4和(18.5±2.8)μmol·g-1蛋白,而文献报道的体内值为(15.6±2.6)μmol·g-1蛋白,可见凝胶包埋的肝细胞内TG含量更接近体内值。以往文献也曾报道过平板培养情况下脂质严重堆积的情况[16]。同时,实验发现正常平板培养下的氧化应激的绝对值比凝胶包埋的要高出很多,随着培养时间的延长,这种差距更大(实验室前期数据)。此外,采用无血清培养基进行原代大鼠肝细胞有无添加非诺贝特的培养,进一步阐述凝胶培养肝细胞可反映非诺贝特促进游离脂肪酸的代谢能力。
综上所述,相对于平板培养,凝胶包埋作为一种三维拟组织化的体外肝细胞培养方式,能较为准确地模拟药物作用后的体内情况,较为准确地预测非诺贝特的肝毒性并能对其致毒机制作出一定的阐释,为体外药物的药效、药理,以及药物毒性研究提供了一个良好的平台。
[1]Chen X,Matthews J,Zhou L,Pelton P,Liang Y,Xu J,et al.Improvement of dyslipidemia,insulin sensitivity,and energy balance by a peroxisome proliferator-activated receptor alpha agonist[J].Metabolism,2008,57(11):1516-1525.
[2]Guo Y,Jolly RA,Halstead BW,Baker TK,Stutz JP,Huffman M,et al.Underlying mechanisms of pharmacology and toxicity of a novel PPAR agonist revealed using rodent and canine hepatocytes[J].Toxicol Sci,2007,96(2):294-309.
[3]Nishimura J,Dewa Y,Okamura T,Muguruma M,Jin M,Saegusa Y,et al.Possible involvement of oxidative stress in fenofibrate-induced hepatocarcinogenesis in rats[J].Arch Toxicol,2008,82(9):641-654.
[4]Oosterveer MH,Grefhorst A,van Dijk TH,Havinga R,Staels B,Kuipers F,et al.Fenofibrate simultaneously induces hepatic fatty acid oxidation,synthesis,and elongation in mice[J].J Biol Chem,2009,284(49):34036-34044.
[5]Arnaiz SL,Travacio M,Llesuy S,Boveris A.Hydrogen peroxide metabolism during peroxisome proliferation by fenofibrate[J].Biochim Biophys Acta,1995,1272(3):175-180.
[6]Nishimura J,Dewa Y,Muguruma M,Kuroiwa Y,Yasuno H,Shima T,et al.Effect of fenofibrate on oxidative DNA damage and on gene expression related to cell proliferation and apoptosis in rats[J].Toxicol Sci,2007,97(1):44-54.
[7]Nishimura J,Dewa Y,Okamura T,Jin M,Saegusa Y,Kawai M,et al.Role of Nrf2 and oxidative stress on fenofibrate-induced hepatocarcinogenesis in rats[J].Toxicol Sci,2008,106(2):339-349.
[8]Zhang L,Mu X,Fu J,Zhou Z.In vitro cytotoxicity assay with selected chemicals using human cells to predict target-organ toxicity of liver and kidney[J].Toxicol In Vitro,2007,21(4):734-740.
[9]Shen C,Cheng X,Li D,Meng Q.Investigation of rifampicin-induced hepatotoxicity in rat hepatocytes maintained in gel entrapment culture[J].Cell Biol Toxicol,2009,25(3):265-274.
[10]Meng Q.Three-dimensional culture of hepatocytes for prediction of drug-induced hepatotoxicity[J].Expert Opin Drug Metab Toxicol,2010,6(6):733-746.
[11]Rajan N,Habermehl J,Coté MF,Doillon CJ,Mantovani D.Preparation of ready-to-use,storable and reconstituted typeⅠcollagen from rat tail tendon for tissue engineering applications[J].Nat Protoc,2006,1(6):2753-2758.
[12]Wu DQ,Zhang GL,Shen C,Zhao Q,Li H,Meng Q.Evaluation of diffusion in gel entrapment cell culture within hollow fibers[J].World J Gastroenterol,2005,11(11):1599-1604.
[13]Qu B,Li QT,Wong KP,Tan TM,Halliwell B.Mechanism of clofibrate hepatotoxicity:mitochondrial damage and oxidative stress in hepatocytes[J].Free Radic Biol Med,2001,31(5):659-669.
[14]Wong SH,Knight JA,Hopfer SM,Zaharia O,Leach CN Jr,Sunderman FW Jr.Lipoperoxides in plasma as measured by liquid-chromatographic separation of malondialdehyde-thiobarbituric acid adduct[J].Clin Chem,1987,33(2 Pt 1):214-220.
[15]El-Assal O,Hong F,Kim WH,Radaeva S,Gao B.IL-6-deficient mice are susceptible to ethanol-induced hepatic steatosis:IL-6 protects against ethanol-induced oxidative stress and mitochondrial permeability transition in the liver[J].Cell Mol Immunol,2004,1(3):205-211.
[16]Shen C,Meng Q,Schmelzer E,Bader A.Gel entrapment culture of rat hepatocytes for investigation of tetracycline-induced toxicity[J].Toxicol Appl Pharmacol,2009,238(2):178-187.
Toxic effect of fenofibrate on gel entrapped primary rat hepatocytes
ZHOU Zhe,LU Yan-hua,MENG Qin
(Department of Chemical and Biological Engineering,Zhejiang University,Hangzhou310027,China)
OBJECTIVETo explore effect of fenofibrate on oxidative stress and intracellular lipid content of collagen gel-entrapped primary rat hepatocytes.METHODSPrimary rat hepatocytes were gel-entrapped in hollow fiber or on monolayer as contrast after harvest.During the culture,fenofibrate 25 μmol·L-1and 100 μmol·L-1were added.After 3 and 7 d treatment,intracellular reactive oxygen species(ROS),malondialdehyde(MDA)and triglycerides(TG)contents were determined.The intracellular neutral lipid drops stained with both oil red O and Nile red were quantified and observed by light microscope,respectively.RESULTThere were no significant difference between these groups in monolayer model.However,in the gel-entrapped model,distinct differences among groups was discovered.After 3 and 7 d treatment,both fenofibrate 25 and 100 μmol·L-1induced the accumulation of intracellular ROS.Compared with normal control group,fenofibrate 25 and 100 μmol·L-1increased the intracellular ROS up to(131±19)%and(149±10)%on the third day,but on the seventh day,ROS level was(121±8)%and(117±5)%,respectively.Fenofibrate also induced the increasing in intracellular MDA content and the accumulation of intracellular TG and neutral lipid drops(P<0.05).CONCLUSIONGel entrapment culture of primary rat hepatocytes better reflects the toxic effect of fenofibrate demonstrated by the increasing in the intracellular oxidative stress and intracellular lipid accumulation.
fenofibrate;co-culture techniques;liver;toxic actions
The project supported by National Natural Science Foundation of China(21076186)
MENG Qin,E-mail:mengq@zju.edu.cn,Tel:(0571)87953193
R972.6,R965.2
A
1000-3002(2011)05-0463-06
10.3867/j.issn.1000-3002.2011.05.009
国家自然科学基金资助项目(21076186)
周喆(1987-),男,硕士研究生,主要从事组织工程学研究。孟琴(1966-),女,教授,博士,主要从事细胞组织工程学研究。
孟琴,E-mail:mengq@zju.edu.cn,Tel:(0571)87953193
2011-01-26接受日期:2011-05-24)
(本文编辑:付良青)
