原儿茶酸对结肠癌SW620 细胞糖酵解及增殖的影响
2021-09-27刘经州杨红群马东旺
刘经州,杨红群,马东旺
(1.承德医学院附属医院,河北 承德067000; 2.承德市妇幼保健院,河北 承德067000; 3.天津市人民医院,天津 300000)
结肠癌是常见的恶性肿瘤类型之一,其发病率在消化道肿瘤中高居第三位,严重威胁人类健康和生命安全[1]。尽管手术辅以化疗、免疫治疗显著提高结肠癌患者生存率,但仍存在严重的不良反应和毒副作用。近年来,天然化合物在人类癌症防治中的作用受到特别关注。原儿茶酸是一种广泛存在的天然酚酸,具有抗氧化、抗炎、抗高血糖、抗纤维化以及心血管和神经保护活性[2⁃3]。研究显示,原儿茶酸显著抑制卵巢癌细胞增殖,并抑制二乙基亚硝胺/苯巴比妥诱发的小鼠肝细胞癌形成[4⁃5]。但其在结肠癌中的抗肿瘤机制并未完全阐明。长非编码RNA(lncRNAs)是由200多个核苷酸组成的RNA 转录本,其通过转录、转录后调控、基因组印迹等参与调节多种人类恶性肿瘤的生理和病理过程,是癌症治疗的潜在靶点[6⁃7]。研究显示,lncRNA心肌素基因(MYOSLID)在骨肉瘤、头颈部鳞状细胞癌中表达增加,干扰MYOSLID可降低细胞的增殖、迁移和侵袭能力[8⁃9]。然而MYOSLID在结肠癌中的抗肿瘤作用鲜有研究。糖酵解代谢活跃、过度增殖是肿瘤细胞的重要特征,本研究拟从糖酵解、增殖角度研究原儿茶酸、MYOSLID在结肠癌中的抗肿瘤作用,探讨其潜在分子机制,以期为原儿茶酸用于防治结肠癌提供实验依据。
1 材料与方法
1.1 组织来源 收集2018 年1 月至2019 年1 月于承德医学院附属医院行手术切除的结肠癌组织样本及癌旁组织样本(距离肿瘤边缘5 cm 处癌旁黏膜组织)共41 对,男23例,女18 例,所有患者术前未接受放疗、化疗或免疫治疗等辅助治疗。该研究获得承德医学院附属医院伦理委员会的批准和患者知情同意(2018000421)。
1.2 细胞 人结肠癌细胞SW620,购自中国科学院上海细胞研究所。
1.3 药物和试剂 原儿茶酸(纯度≥98%,生产批号809⁃201603)购自上海联迈生物工程有限公司;小干扰RNA 序列片段(si⁃RNA)、质粒(pcDNA)购于广州复能基因有限公司;TRIzol 试剂、乳酸检测试剂盒、葡萄糖检测试剂盒、细胞计数试剂盒(CCK⁃8)购自北京索莱宝生物科技有限公司;第一链cDNA 合成试剂盒、SYBR Green PCR 试剂盒购于大连宝生物工程有限公司;羊抗兔IgG 二抗(7074)、兔源细胞周期素D1(CyclinD1)(55506)、p21(2947)、甘油醛⁃3⁃磷酸脱氢酶(GAPDH)(5174)单克隆抗体购于上海赛信通生物试剂有限公司。
2 方法
2.1 细胞培养和分组 SW620 细胞采用补充10% 胎牛血清、1%青链霉素双抗的DMEM 培养基在37 ℃、5% CO2细胞培养箱培养。当细胞70%融合时,胰酶消化,按照1 ∶3 比例稀释,将细胞接种于新的培养瓶中,每2 d 换液1次,取对数期SW620 细胞进行实验。用原儿茶酸终浓度分别为0、5、10、20 μmol/L 的培养液孵育细胞48 h,分别命名为对照组、原儿茶酸低浓度组、原儿茶酸中浓度组和原儿茶酸高浓度组。为探讨原儿茶酸的抗肿瘤作用和MYOSLID关系,利用脂质体转染法将si⁃NC、si⁃MYOSLID分别转染SW620 细胞,分别命名为si⁃NC 组、si⁃MYOSLID组;将pcDNA、pcDNA⁃MYOSLID 分别转染SW620 细胞,用原儿茶酸终浓度20 μmol/L 的培养液处理转染成功细胞48 h,分别命名为原儿茶酸+pcDNA 组、原儿茶酸+pcDNA⁃MYOSLID 组。
2.2 葡萄糖消耗和乳酸产生水平检测 采用乳酸检测试剂盒、葡萄糖检测试剂盒,收集细胞培养基,3 000 r/min 离心获得上清液。按照试剂盒说明书步骤,测定各组细胞的乳酸产量以及葡萄糖消耗量。
2.3 细胞活力检测 采用CCK⁃8 法。将未转染的SW620细胞接种96 孔板,贴壁后用含5、10、20 μmol/L 原儿茶酸[8]的培养液(每孔100 μL)孵育48 h;将转染si⁃NC 或转染si⁃MYOSLID 的SW620 细胞接种96 孔板,培养48 h。将转染pcDNA 或pcDNA⁃MYOSLID 的SW620 细胞接种96孔板,贴壁后用含20 μmol/L 原儿茶酸的培养液(每孔100 μL)孵育48 h,设置3 个复孔。每孔加入10 μL 的CCK⁃8 溶液,再培养2 h,酶标仪在450 nm 处测量OD。增殖抑制率=(1-OD实验组/OD对照组)×100%。
2.4 细胞克隆形成能力检测 采用集落形成实验检测。各组取2 mL 细胞悬液(约5×102个细胞)接种到96 孔板中,米字型晃动平板使细胞分散均匀。约培养14 d 时,用甲醇固定集落,用0.1%结晶紫染色,显微镜下计算大于50 个细胞的集落数。
2.5 lncRNA MYOSLID 表达检测 采用RT⁃PCR 法。TRIzol 试剂提取细胞总RNA 后。采用第一链cDNA 合成试剂盒进行反转录,使用SYBR Green PCR 试剂盒进行实时RT⁃qPCR。GAPDH 作 为MYOSLID的内源 性对照,MYOSLID表达水平以2-△△Ct公式计算。MYOSLID正向5′⁃AAGAGGGAGTGGGAGTTAGGC⁃3′,正向 5′⁃CACTGTGGT GGGATCTGCAAG⁃3′;GAPDH正向 5′⁃TGATGACCCTTTT GGCTCCC⁃3′,反向5′⁃GAAGCTTGTCATCAA TGGAAAT⁃3′。
2.6 CyclinD1 和p21 蛋白表达检测 采用Western blot 法。
放射免疫测定(RIPA)缓冲液冰上裂解细胞30 min,离心收集上清液并测定蛋白浓度。十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白样品,并恒流转移至聚偏氟乙烯膜。4 ℃下用5%脱脂奶粉将膜封闭12 h。弃去封闭液,室温下加入特异性一抗溶液(1 ∶1 000)孵育膜2 h。随后将膜与相应二抗(1 ∶1 000)室温下孵育2 h。洗膜后,加入显影剂暗室反应15 min,以GAPDH 为内参,使用Quantity One软件对蛋白质表达水平进行定量。
2.7 统计学分析 采用GraphPad Prism 7.0 软件进行统计分析,计量资料以()表示。采用独立样本t检验比较两组差异,采用单因素方差分析和SNK⁃q 检验比较多组间差异。P<0.05 为差异有统计学意义。
3 结果
3.1 原儿茶酸对结肠癌SW620 细胞糖酵解的影响 与对照组比较,原儿茶酸低、中、高浓度组SW620 细胞葡萄糖消耗量、乳酸产生量降低(P<0.05),且表现出一定的剂量依赖性。见表1。
表1 原儿茶酸对结肠癌SW620 细胞糖酵解的影响(,n=9)
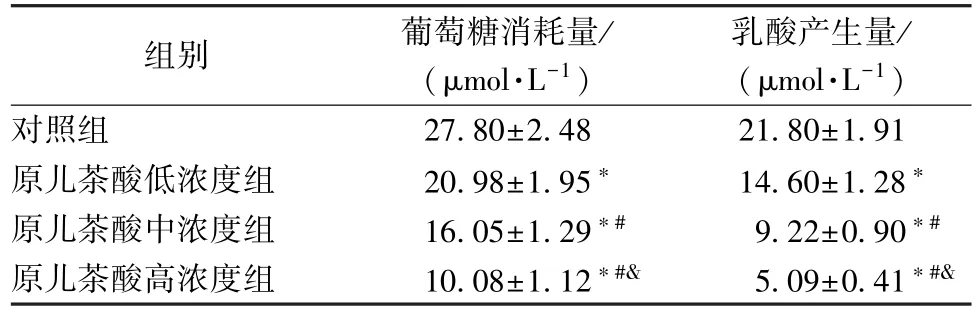
表1 原儿茶酸对结肠癌SW620 细胞糖酵解的影响(,n=9)
注:与对照组比较,*P<0.05;与原儿茶酸低浓度组比较,#P<0.05;与原儿茶酸中浓度组比较,&P<0.05。
3.2 原儿茶酸对结肠癌SW620 细胞增殖的影响 与对照组比较,原儿茶酸低、中、高浓度组SW620 细胞增殖抑制率、p21 蛋白表达升高,克隆形成数、CyclinD1 蛋白表达降低(P<0.05),且表现出一定的剂量依赖性。见表2、图1。
表2 原儿茶酸对结肠癌SW620 细胞增殖的影响(, n=9)

表2 原儿茶酸对结肠癌SW620 细胞增殖的影响(, n=9)
注:与对照组比较,*P<0.05;与原儿茶酸低浓度组比较,#P<0.05;与原儿茶酸中浓度组比较,&P<0.05。
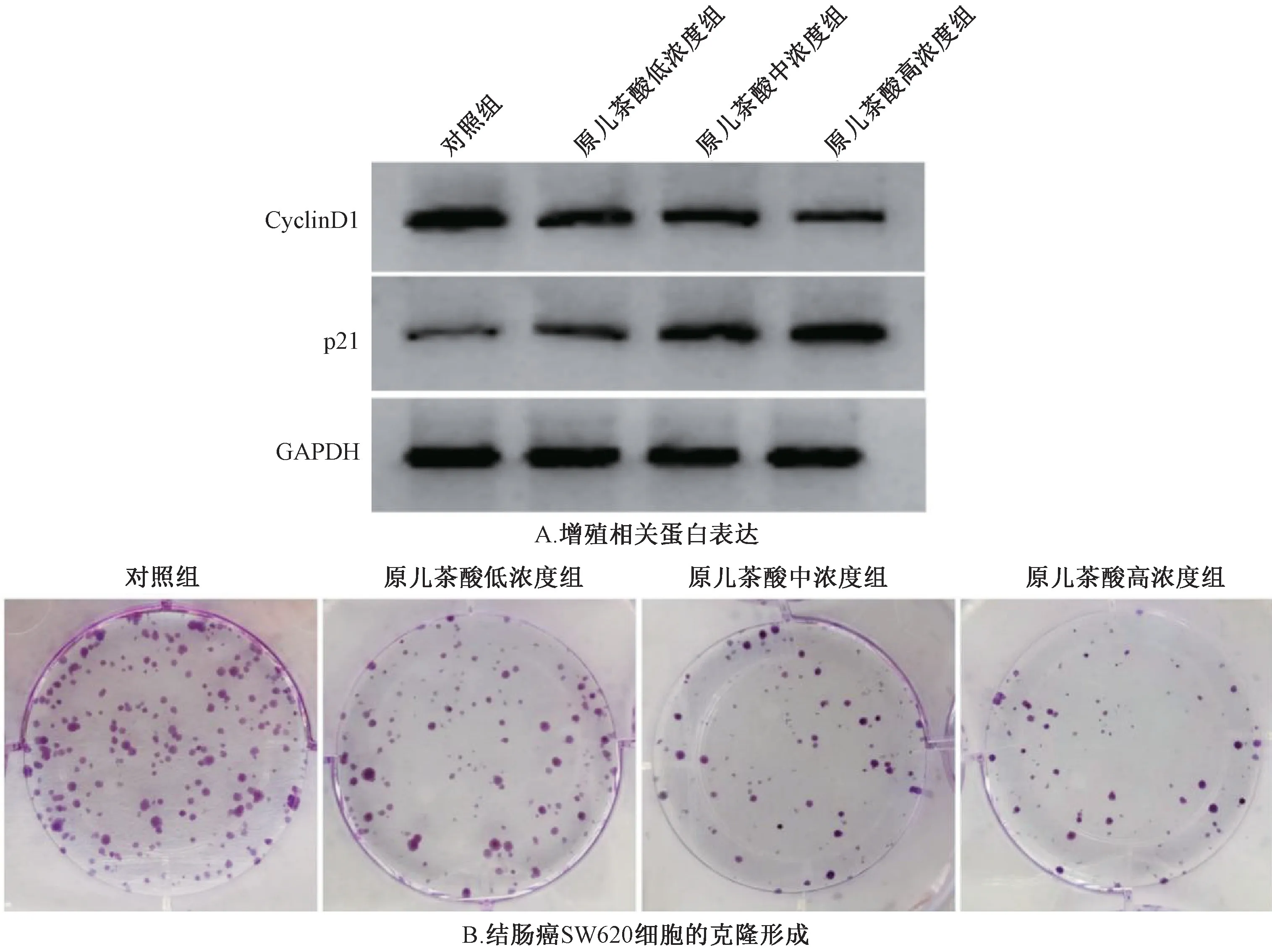
图1 原儿茶酸对结肠癌SW620 细胞增殖的影响
3.3 lncRNAMYOSLID在结肠癌组织中的表达 lncRNAMYOSLID在结肠癌组织中的表达较癌旁组织升高(P<0.01)。见表3。
表3 lncRNA MYOSLID 在结肠癌组织中的表达(,n=3)

表3 lncRNA MYOSLID 在结肠癌组织中的表达(,n=3)
注:与癌旁组织比较,**P<0.01。
3.4 原儿茶酸对结肠癌SW620 细胞中lncRNAMYOSLID表达的影响 与对照组比较,原儿茶酸低、中、高浓度组SW620 细胞lncRNAMYOSLID的表达降低(P<0.05),且表现出一定的剂量依赖性。见表4。
表4 原儿茶酸对结肠癌SW620 细胞中lncRNA MYOSLID表达的影响(, n=9)

表4 原儿茶酸对结肠癌SW620 细胞中lncRNA MYOSLID表达的影响(, n=9)
注:与对照组比较,*P<0.05;与原儿茶酸低浓度组比较,#P<0.05;与原儿茶酸中浓度组比较,&P<0.05。
3.5 干扰lncRNAMYOSLID表达对结肠癌SW620 细胞糖酵解和增殖的影响 与si⁃NC 组比较,si⁃MYOSLID 组SW620细胞lncRNAMYOSLID表达降低,葡糖糖消耗量、乳酸产生量、克隆形成数、以及CyclinD1 蛋白表达降低,细胞增殖抑制率、p21 蛋白表达升高(P<0.05)。见表5、图2。
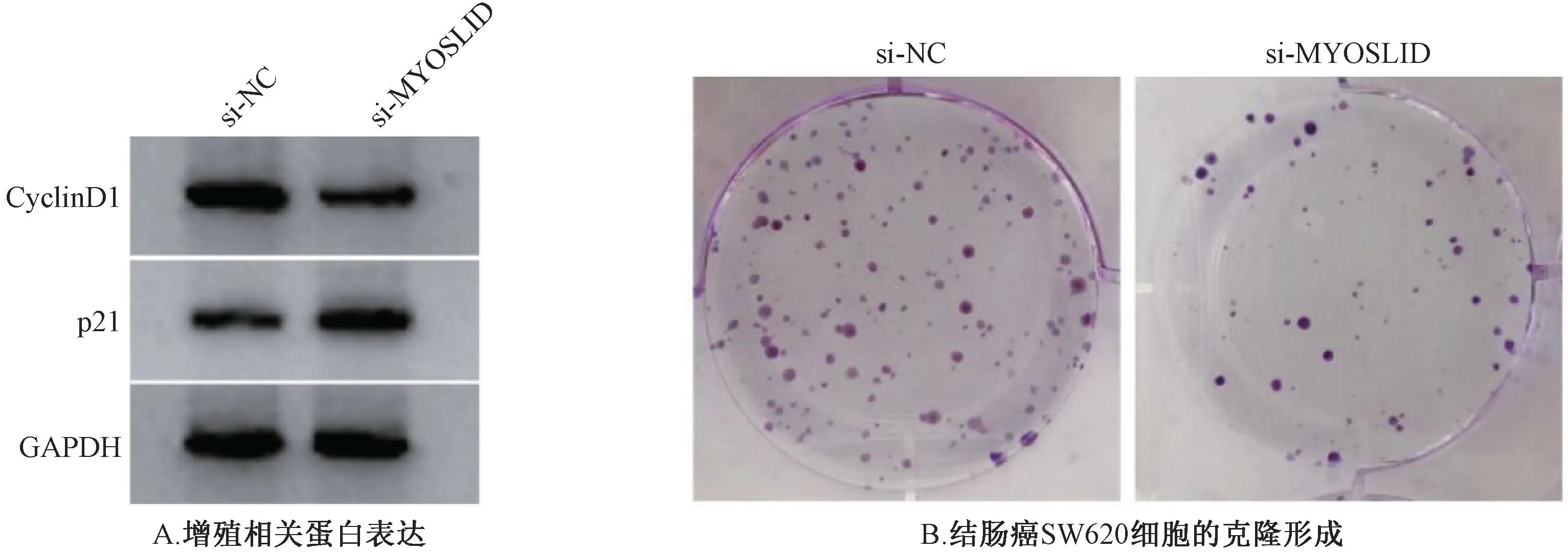
图2 干扰lncRNA MYOSLID 表达对结肠癌SW620 细胞增殖的影响
表5 干扰lncRNA MYOSLID 表达对结肠癌SW620 细胞糖酵解和增殖的影响(, n=9)

表5 干扰lncRNA MYOSLID 表达对结肠癌SW620 细胞糖酵解和增殖的影响(, n=9)
注:与si⁃NC 组比较,**P<0.01。
3.6 lncRNAMYOSLID过表达逆转原儿茶酸(20 μmol/L)对结肠癌SW620 细胞糖酵解和增殖的作用与原儿茶酸+pcDNA 组比较,原儿茶酸+pcDNA⁃MYOSLID 组SW620 细胞lncRNAMYOSLID表达显著升高,葡糖糖消耗量、乳酸产生量、克隆形成数以及CyclinD1 蛋白表达升高,细胞增殖抑制率、p21 蛋白表达降低(P<0.05)。见表6、图3。
表6 lncRNA MYOSLID 过表达逆转了原儿茶酸对结肠癌SW620 细胞糖酵解和增殖的作用(, n=9)

表6 lncRNA MYOSLID 过表达逆转了原儿茶酸对结肠癌SW620 细胞糖酵解和增殖的作用(, n=9)
注:与原儿茶酸+pcDNA 组比较,**P<0.01。
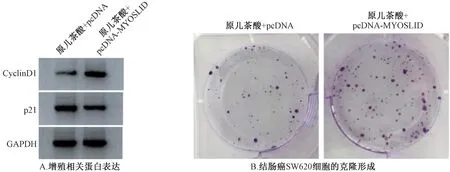
图3 lncRNA MYOSLID 过表达逆转了原儿茶酸对结肠癌SW620 细胞增殖的作用
4 讨论
原儿茶酸存在于许多水果和蔬菜中,具有多种生物活性。Owumi 等[10]研究发现,原儿茶酸通过升高大鼠肝脏和肾脏中抗氧化酶活性、抑制脂质过氧化、拮抗细胞凋亡机制保护抗癌药甲氨蝶呤诱导的肝肾毒性。Tsao 等[11]研究表明原儿茶酸以剂量依赖方式抑制肺癌细胞生长、降低线粒体膜电位和诱导细胞凋亡。此外,原儿茶酸通过抑制核因子κB(NF⁃κB)激活、下调基质金属蛋白酶2(MMP⁃2)表达进而抑制胃癌细胞的迁移和侵袭,抑制小鼠中黑色素瘤细胞的肝转移[12]。以上研究表明,原儿茶酸具有防治人类癌症的巨大潜力。糖酵解是癌细胞的重要生化特征之一,糖酵解不仅为肿瘤细胞提供充足的能量,而且为肿瘤细胞的快速增殖提供大量的生物合成原料,抑制糖酵解反应可抑制结肠癌进程[13]。CyclinD1 是G1到S 周期转化的关键介质,其上调导致结肠癌细胞的快速生长,而p21 则通过抑制G1到S 期转换具有抗增殖作用[14⁃15]。本研究发现,原儿茶酸以剂量依赖方式抑制葡萄糖消耗和乳酸产生,抑制细胞增殖、克隆形成和CyclinD1 表达,促进p21 表达。提示,原儿茶酸通过抑制SW620 细胞增殖和糖酵解反应在结肠癌癌中具有抗肿瘤作用。
lncRNA 参与调节肿瘤细胞的增殖、周期分布、凋亡、迁移侵袭、糖酵解代谢等多个生物学过程,是人类癌症进展的重要调节剂[16⁃17]。lncRNAMYOSLID在胃癌组织和细胞中呈高表达,其表达水平与肿瘤大小,肿瘤分期、浸润深度和生存时间相关,干扰MYOSLID表达可诱导凋亡和生长停滞,抑制裸鼠移植瘤形成[18]。此外,MYOSLID高表达可预测骨肉瘤患者预后不良,促进骨肉瘤细胞的生长和转移[8]。本研究发现结肠癌组织中MYOSLID表达水平显著升高,转染si⁃MYOSLID 干扰MYOSLID表达可降低SW620 细胞克隆形成能力,降低Cyclin D1 表达,提高p21 表达,降低乳酸消耗和葡萄糖产生量,这提示干扰MYOSLID 表达可抑制结肠癌细胞的增殖和糖酵解反应。原儿茶酸处理后MYOSLID表达以剂量依赖方式降低,提示原儿茶酸的抗肿瘤作用可能与调节MYOSLID表达有关。进一步研究证实,过表达MYOSLID降低了原儿茶酸对SW620 细胞增殖、克隆形成和糖酵解的抑制作用,恢复细胞增殖、糖酵解以及Cyclin D1 和p21 表达。提示,原儿茶酸通过下调MYOSLID在结肠中发挥抗肿瘤作用。
总之,原儿茶酸通过抑制SW620 细胞增殖和糖酵解反应在结肠癌中具有抗肿瘤作用,其机制与下调MYOSLID表达有关,为原儿茶酸在结肠癌防治中的应用提供了实验依据。
