乳腺生物反应器表达的重组人抗凝血酶Ⅲ的分离纯化
2014-10-31王翠杰黄永东孔英俊罗坚张贵锋赵东旭苏志国马光辉
王翠杰 ,黄永东,孔英俊,罗坚,张贵锋,赵东旭,苏志国,马光辉
1 北京理工大学生命学院,北京 100086
2 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190
抗凝血酶Ⅲ (Antithrombin Ⅲ,AT Ⅲ)是血浆中最重要的一个抗凝血酶因子[1],在维持血液的凝血与抗凝血平衡中起重要作用[2]。AT Ⅲ的分子量为58−64 kDa,等电点为5.1。目前,AT Ⅲ有3种来源,从血浆中纯化[3]、用基因工程细胞生产[4]和用乳腺生物反应器生产[5-6]。乳腺生物反应器能够生产出具有正确氨基酸序列的人源蛋白质,能进行翻译后修饰,蛋白具有生物活性,且表达量高,很容易通过增加饲养动物的规模来获得大量的重组蛋白[7-8]。因此,利用乳腺生物反应器生产rhAT Ⅲ具有广阔的应用前景。
青岛森淼实业有限公司开展了利用崂山奶山羊乳腺生物反应器制备药用蛋白的研究工作,建立了乳腺生物反应器的开发平台[9-10],其中利用乳腺生物反应器生产rhAT Ⅲ已经达到大规模生产的要求,在此基础上开发一条高效的分离纯化工艺将有助于推进其产业化进程。已有的从转基因羊奶中提取rhAT Ⅲ的纯化工艺主要包含切向流过滤、肝素亲和层析、超滤、阴离子交换层析、疏水层析和超滤,总蛋白收率为53%[5]。该工艺由六步组成,操作过于繁琐、纯化周期长,不利于产品的快速、规模化制备和成本控制。
羊奶中的蛋白主要为酪蛋白,含量超过70%,本研究首先通过筛选有效的预处理方法,去除羊奶中的大部分酪蛋白,再通过肝素亲和层析将rhAT Ⅲ与其他蛋白分开,快速有效地将rhAT Ⅲ提取出来,减少操作步骤,提高收率,为今后的规模化制备提供参考与依据。
1 材料与方法
1.1 药品、试剂材料与仪器
转基因羊奶 (青岛森淼实业有限公司);血浆抗凝血酶Ⅲ标准品 (Chromogenix,ITA);Heparin QZT 6FF亲和介质 (国家生化工程技术研究中心,北京)、DEAE Sepharose FF阴离子交换介质和Phenyl Sepharose FF疏水介质 (GE,USA);其他试剂均为分析纯。
离心机 H-2050R (湘仪集团);层析系统ÄKTA purifier (GE,USA);电泳仪 Mini-Protein Ⅲ(Bio-Rad,USA);分光光度计 Ultrospec 2100-pro(GE,USA);450型酶联免疫检测仪 (Bio-Rad,USA)。
1.2 方法
1.2.1 转基因羊奶预处理
取出适量保存在-20 ℃的转基因羊奶,4 ℃融化后离心 (10 000×g,4 ℃,30 min),去除沉淀和漂浮的奶脂,留上清液备用。
等电点沉淀法:往上清液中加入等体积去离子水,然后用1 mol/L盐酸调pH至4.6。静置沉淀 1 h 后离心 (10 000×g,4 ℃,30 min),上清用0.45 μm的滤膜过滤,调pH备用。
乙二胺四乙酸 (EDTA)沉淀法、钙离子 (Ca2+)沉淀法和锌离子 (Zn2+)沉淀法:分别往上清液中加入等体积20 mmol/L EDTA、40 mmol/L CaCl2和40 mmol/L ZnCl2溶液,静置沉淀1 h后离心 (10 000×g,4 ℃,30 min),上清用0.45 μm的滤膜过滤,调pH备用。
1.2.2 溶液条件对rhAT Ⅲ稳定性的影响
分别考察rhAT Ⅲ在不同pH (4.6、6.2、7.2、8.2和9.2)和温度 (4 ℃和25 ℃)下的活性变化情况。
1.2.3 rhAT Ⅲ分离纯化
1) 不同层析模式纯化效果考察
DEAE阴离子交换层析:DEAE阴离子交换柱(6.37 cm × 1.0 cm I.D., CV = 5.0 mL)用平衡缓冲液Buffer A (20 mmol/L PB, pH 7.2)平衡后进料 10 mL上清液,继续用缓冲液A淋洗至基线,再采用线性梯度 (0−100% 缓冲液 B (20 mmol/L PB+1 mol/L NaCl, pH 7.2), 60 min)洗脱。
Phenyl疏水层析:Phenyl疏水柱 (6.37 cm ×1.0 cm I.D., CV = 5.0 mL)用平衡缓冲液Buffer C(20 mmol/L PB+1.5 mol/L (NH4)2SO4, pH 7.2)平衡后进料10 mL上清液,继续用缓冲液C淋洗至基线,再采用线性梯度 (0−100%缓冲液 D(20 mmol/L PB, pH 7.2), 60 min)进行洗脱。
Heparin亲和层析:Heparin亲和柱 (6.37 cm ×1.0 cm I.D., CV = 5.0 mL)用平衡缓冲液 E(50 mmol/L Tris, pH 7.2)平衡后进料10 mL上清液,继续用缓冲液 E淋洗至基线,再采用线性梯度(0–100%缓冲液F (50 mmol/L Tris+ 0.5 mol/L NaCl,pH 7.2), 60 min)进行洗脱。
2) 亲和层析方法优化
在Heparin亲和层析过程中,分别考察了洗脱梯度 (线性梯度和阶跃梯度)、pH (6.2−8.2)、流速(0.5−2.0 mL/min)和上样量 (1−4 mL 料液/mL 肝素亲和介质)对亲和层析效果的影响。
1.3 分析方法
1.3.1 蛋白浓度检测
采用Bradford法进行蛋白浓度测定[11]。
rhAT Ⅲ浓度检测:采用文献报道的方法进行反相色谱分析[9],根据rhAT Ⅲ浓度和峰高的标准曲线计算各样品中的rhAT Ⅲ浓度。
1.3.2 rhAT Ⅲ活性检测
采用龚道元等[12]报道的多肽底物发色法测定rhAT Ⅲ的生物活性。
1.3.3 电泳检测
参考Laemmli法进行SDS-PAGE电泳[13],采用银染法进行染色[14]。
2 结果与讨论
2.1 原料预处理
酪蛋白等电点为4.6,可利用等电点沉淀法将其沉淀出来。此外,酪蛋白在羊奶中通过磷酸钙形成稳定胶束存在,而EDTA能够螯合磷酸钙,Ca2+、Zn2+也能替代磷酸钙,造成酪蛋白胶束的解聚,从而沉淀出来。4种沉淀方法的效果如表1所示,其中等电点沉淀和Zn2+沉淀两种方法对rhAT Ⅲ的含量和活性均无太大影响,但是Zn2+沉淀效果并不明显,只有离心后才能出现澄清的上清液。等电点沉淀后,分层明显,上清中总蛋白量减少50%左右,在不影响rhAT Ⅲ活性收率的情况下,有效去除羊奶中的酪蛋白。
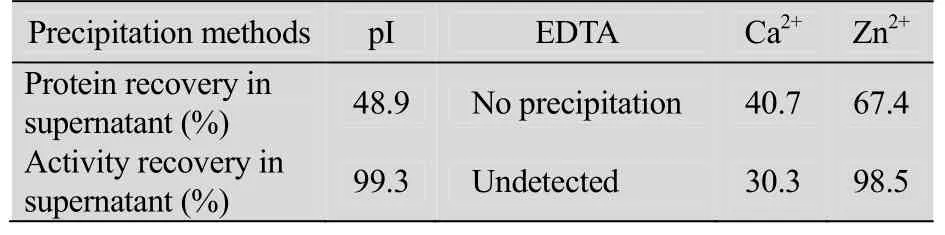
表1 酪蛋白沉淀方法筛选结果Table 1 Results of casein precipitation methods
2.2 溶液条件对rhAT Ⅲ稳定性的影响
在层析中,如何保持rhAT Ⅲ的活性是首要解决的问题。pH、温度和时间对rhAT Ⅲ活性保持的影响如图1所示。由图1可知,pH对其稳定性影响显著,pH 7.2的条件对原料的保存最有利,即使长时间放置(24 h),rhAT Ⅲ活性损失相对最小。此外,低温 (4 ℃)比室温 (25 ℃)更有利于样品中rhAT III的活性保持。因此,利用等电点沉淀法去除酪蛋白后要尽快把样品pH调至中性,放置于4 ℃冰箱中,并尽可能快速地进行后续的纯化实验,以保证活性收率。
2.3 层析模式对rhAT Ⅲ纯化的影响
离子交换层析和疏水层析具有载量高、介质成本低的优势,而肝素亲和层析具有特异性高、分离纯化效果好的特点,上述3种层析方法都已用于转基因羊奶中rhAT Ⅲ的分离纯化[4]。为了简化rhAT Ⅲ的分离纯化步骤,本文对3种层析模式 (采用线性梯度洗脱)进行比较,从中筛选出最有效的层析模式。
在离子交换和疏水层析中,除穿透峰 (P0)外,都只有1个洗脱峰 (P1, 图略);而在肝素亲和层析中,大量杂蛋白直接穿透 (P0),洗脱时出现两个明显的洗脱峰 (P1, P2),并且有较好的分离度 (图略)。对层析所得的样品进行电泳分析 (图2),离子交换层析和疏水层析并不能很好地将rhAT Ⅲ和其他杂蛋白分开,而肝素亲和层析的洗脱峰P1 (Lane 3)的条带与文献[13]报道的rhAT Ⅲ的分子量60 kDa相符,为目标蛋白rhAT Ⅲ,纯度达到85%以上,进一步优化洗脱梯度有望达到更好的分离纯化效果。
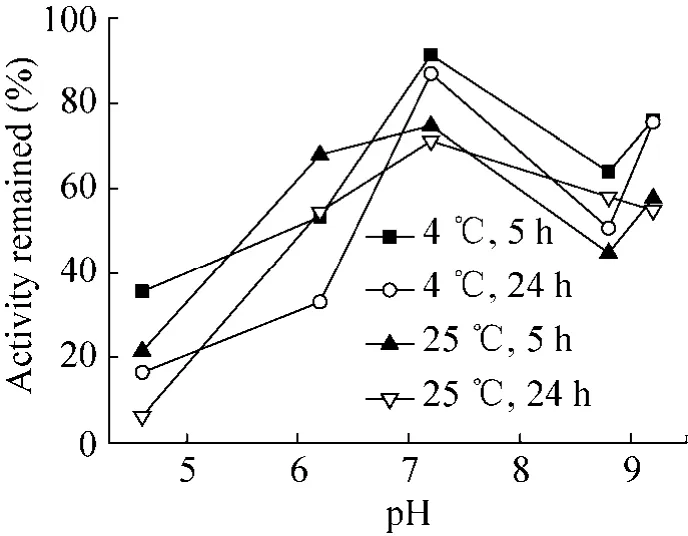
图1 pH对rhAT Ⅲ稳定性的影响Fig. 1 Effect of pH on rhAT Ⅲ stability.
2.4 溶液条件及洗脱条件对肝素亲和层析纯化效果的影响
2.4.1 洗脱梯度的影响
在线性梯度洗脱的基础上,分别考察不同阶跃 梯 度 (1: 0−20%−30%−50%−60%−100% ;2:0−50%−100%)的洗脱效果。采用阶跃梯度1,各洗脱梯度下均有洗脱峰,但电泳分析结果表明,20%、30%和50%洗脱梯度对应的洗脱峰无明显区别(图略),均为高纯度的rhAT Ⅲ,所以没必要把洗脱梯度分得过于精细;直接用 0−50%−100%的洗脱梯度可以得到两个洗脱峰 (图 3),其中50%梯度对应的洗脱峰P1纯度达到电泳纯 (图4,泳道 5),该方法操作简单,短时间内即可得到高纯度的rhAT Ⅲ。
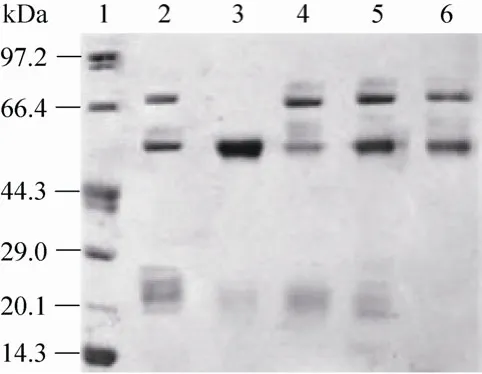
图2 不同层析模式所得样品的SDS-PAGE电泳图Fig. 2 SDS-PAGE analysis of rhAT Ⅲ eluted from different chromatography patterns. 1: marker; 2–4: P0, P1 and P2 of heparin affinity chromatography; 5: P1 of DEAE anion chromatography; 6:P1 of phenyl hydrophobic interaction chromatography.

图3 肝素亲和层析谱图Fig. 3 Chromatogram of heparin affinity chromatography.
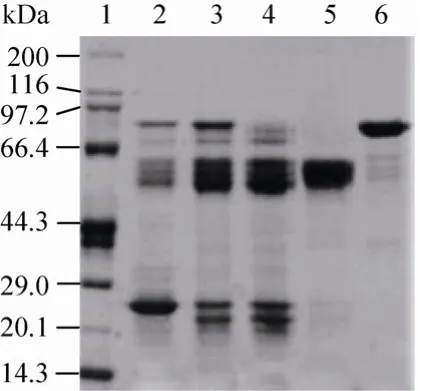
图4 亲和层析样品的SDS-PAGE电泳图Fig. 4 SDS-PAGE analysis of rhAT Ⅲ eluted from heparin affinity chromatography. 1: marker; 2: goat milk;3: supernatant of pH 7.2; 4: P0; 5: P1; 6: P2.
2.4.2 pH的影响
考察不同pH值 (pH 6.2、7.2、8.2)对rhAT Ⅲ分离纯化的影响 (采用0−50%−100%洗脱梯度洗脱)。当pH为6.2时,目标洗脱峰P1最大,但其杂质含量也最高;当pH为7.2和8.2时,所得样品的纯度最高,无明显杂质。不同pH条件下目标组分 (P1峰)中rhAT Ⅲ的活性收率分别为 20.6% (pH 6.2)、49.7%(pH 7.2)、13.9% (pH 8.2),说明pH不仅影响溶液中rhAT Ⅲ的活性保持 (图1),还对层析过程中rhAT Ⅲ的活性收率具有显著影响。综合考虑活性收率和纯度,pH 7.2的条件最有利于rhAT Ⅲ的分离纯化。
2.4.3 流速的影响
不同流速 (0.5、1.0、1.5、2.0 mL/min)对层析效果的影响 (pH 7.2,采用0−50%−100%的梯度洗脱)如表2所示。流速太低 (0.5 mL/ min)时,蛋白在柱上停留时间过长,活性收率低;流速太高 (2.0 mL/min)时,不利于蛋白的有效吸附,活性收率较低;1.0−1.5 mL/min的流速有利于提高蛋白的活性收率。综合考虑蛋白收率和活性收率,选择1.0 mL/min的操作流速。
2.4.4 上样量的影响
从表3可以看出,1和2 mL料液/mL介质的上样量的效果基本相当;随着上样量的进一步增加,rhAT Ⅲ的蛋白收率和活性收率都有下降趋势,这主要是因为上样量过高,超过了介质载量,造成部分目标蛋白穿透。综合考虑处理速度、蛋白收率和活性收率,选择2 mL料液/mL介质的上样量。
2.4.5 层析过程 (吸附-解吸)对蛋白活性的影响
将 50%梯度洗脱所得的 P1峰用平衡缓冲液透析后再次进行Heparin亲和层析。结果表明rhAT Ⅲ的蛋白收率达到95%以上,但活性收率只有68%,存在明显的活性损失现象。荧光光谱分析结果表明,rhAT Ⅲ再次进行肝素亲和层析后,其最大吸收波长从原来的338.6 nm降低到334.2 nm,发生了蓝移。由此可见,层析过程中的吸附-解吸过程是造成rhAT Ⅲ结构变化和活性收率低的主要原因。
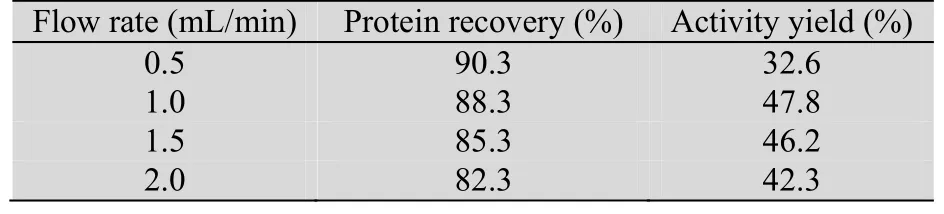
表2 不同流速条件的rhAT Ⅲ收率Table 2 Recovery of rhAT Ⅲ with different flow rate

表3 不同上样量的rhAT Ⅲ收率Table 3 Recovery of rhAT Ⅲ with different sample loaded
2.5 rhAT Ⅲ结构分析
所纯化的rhAT Ⅲ经胰蛋白酶和DTT降解后,通过液质联用分析其氨基酸序列,结果表明rhAT Ⅲ的氨基酸覆盖率达到82.6% (与血浆来源的AT Ⅲ相比);二硫键定位结果表明rhAT Ⅲ中存在3个二硫键位置,分别是 Cys21-Cys95、Cys8-Cys128、Cys247-Cys430,与血浆来源的AT Ⅲ一致;糖基化位点分析结果表明rhAT Ⅲ中存在4个糖基化位点,分别为Asn96、Asn135、Asn155和Asn192,与血浆来源的AT Ⅲ一致[15-16]。上述分析结果表明所纯化的rhAT Ⅲ的结构与血浆来源的AT Ⅲ一致,结构正确。
3 结论
本研究开发了一条基于等电点沉淀和肝素亲和层析纯化rhAT Ⅲ的工艺,重点考察了溶液条件和操作条件对rhAT Ⅲ蛋白收率和活性收率的影响,优化了亲和层析的操作条件 (pH 7.2、洗脱梯度为 0−50%−100%Buffer F、流速1.0 mL/min、上样量2 mL料液/mL Heparin介质),实现了rhAT Ⅲ的高效纯化,纯度达到99%以上,蛋白收率为 90%,活性收率约为 50%。与离子交换和疏水层析相比,肝素亲和层析具有特异性强、分辨率高、产品回收率高的特点。经过液质联用、圆二色光谱、荧光光谱分析,所纯化的rhAT Ⅲ与血浆来源AT Ⅲ结构一致[16]。该工艺简化了rhAT Ⅲ分离纯化的操作步骤,有利于工艺的进一步放大和产品的规模化制备。
[1]Morelli A. Production and clinical use of plasma antithrombin III//Bertolini J, Goss N, Curling J, Eds. Production of Plasma Proteins for Therapeutic Use. New York: Wiley, 2012: 147.
[2]Mochizuki S, Miyano K, Kondo M, et al. Purification and characterization of recombinant human antithrombin containing the prelatent form in Chinese hamster ovary cells.Protein Expres Purif, 2005, 41: 323−331.
[3]Hoffman D. Purification and large-scale preparation of antithrombin Ⅲ. Am J Med, 1989, 87(3): S23−S26.
[4]Bu S, Wang HM, Sun T, et al. Expression and antiserum preparation of recombinant human antithrombin-Ⅲ. Chin J Cell Molr Immunol, 2013, 29(2): 174−177 (in Chinese).卜澍, 王洪梅, 孙涛, 等. 人抗凝血酶Ⅲ的表达及其抗血清的制备. 细胞与分子免疫学杂志, 2013, 29(2): 174−177.
[5]Edmunds T, Van Patten SM, Pollock J, et al. Transgenically produced human antithrombin: structural and functional comparison to human plasma derived antithrombin. Blood,1998, 91(12): 4561−4571.
[6]Dai CY, Huang HJ. Progress of animal mammary gland bioreactor.Modern Agri Sci Technol, 2010, 4: 332−333 (in Chinese).代长云, 黄海军. 动物乳腺生物反应器研究进展. 现代农业科技, 2010, 4: 332−333.
[7]Khodarovich YM, Goldman IL, Sadchikova ER, et al.Expression of eukaryotic recombinant proteins and deriving them from the milk of transgenic animals. Appl Biochem Micro, 2013, 49(9): 711−722.
[8]Niemann H, Kues WA. Transgenic farm animals: an update.Reprodu Fert Develop, 2007, 19(6): 762−770.
[9]Zou XG, Yuan SP, Xian J, et al. Large scale production of recombinant human antithrombin Ⅲ (rhAT Ⅲ)in transgenic cloned goats. Chin J Biotech, 2008, 24(1): 117−123 (in Chinese).邹贤刚, 袁三平, 鲜建, 等. 转基因克隆奶山羊大量生产重组人的抗凝血酶III蛋白质 (rhAT Ⅲ). 生物工程学报, 2008,24(1): 117−123.
[10]Zou XG, Zhao YL, Yan SP. A recombinant goat fetal fibroblast cell for the expression of antithrombin Ⅲ: Chinese Patent, 201210362487.9.邹贤刚, 赵雅琳, 袁三平. 一种表达抗凝血酶Ⅲ的重组羊胎儿成纤维细胞: 中国, 201210362487.9.
[11]Zhu HC. Guide to Protein Purification and Identification.Beijing: Science Press, 1999: 158−159 (in Chinese).朱厚础. 蛋白质纯化与鉴定实验指南. 北京: 科学出版社,1999: 158−159.
[12]Gong DY, Li ZP, Ling GX. Determination of anfithrombin Ⅲactivity by microassay of chromogenic tripeptide substmte and its clinical application. Jiangxi J Med Lab Sci, 2000, 18(4):200−202 (in Chinese).龚道元, 李子萍, 凌光鑫. 微量发色三肽底物法测定抗凝血酶 III活性及其临床应用. 江西医学检验, 2000, 18(4):200−202.
[13]Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970,227(259): 680−685.
[14]Swain M, Ross NW. A silver stain protocol for proteins yielding high resolution and transparent background in sodium dodecyl sulfate-polyacrylamide gels. Electrophoresis, 1995,l6(6): 948−951.
[15]Carrell R, Stein P, Fermi G, et al. Biological implications of a 3 structure of dimeric antithrombin. Structure, 1994, 2(4):257−270.
[16]Kong YJ, Zhang GF, Luo J, et al. Facile purification and characterization of recombinant human antithrombin III from transgenic goat milk. J Chem Technol Biotechnol, 2011,86(10): 1303−1309.
