丹参悬浮培养细胞原生质体的制备和活力检测
2014-10-31朱楠刘俊张馨宇董娟娥
朱楠,刘俊,张馨宇,董娟娥
西北农林科技大学生命科学学院,陕西 杨凌 712100
植物原生质体是被脱掉了细胞壁、仅有质膜包围、裸露而生活的植物细胞。质膜在生命活动中的作用极为重要,例如信息传递、能量转换、物质运输等生命现象都与质膜有密切的关系[1]。原生质体裸露而具生活力的特性为与植物质膜功能有关的研究提供了有利的条件,已在细胞水平上揭示了一系列生命过程的本质[2]。植物对诱导子的抵抗反应是在细胞水平上进行的,在整体水平上进行研究受到了各种干扰,而用原生质体作为材料则可排除干扰,对于阐明植物抗逆性的生化过程及在细胞水平上所发生的现象非常有利[1]。如多种外界刺激,包括诱导子、机械刺激、低温胁迫、渗透胁迫、光和氧化胁迫[3-8]等均能引起植物细胞胞质游离Ca2+浓度升高。Ca2+的信使功能通过调控细胞内游离Ca2+浓度来实现[9-10]。胞质Ca2+浓度常用激光共聚焦显微镜检测[11],但由于细胞壁的酯酶对Fluo-3/AM荧光探针的水解而使装载失败,影响检测[12-13],利用原生质体可使探针顺利进入细胞内准确检测胞质游离Ca2+。
常用来提取原生质体的材料有植物的幼叶、子叶、根和下胚轴[2,14-17]等。植物的愈伤组织内有大量的细胞间隙,是一团薄壁的松散的细胞团,其细胞壁易被酶解,是制备原生质体的理想材料。本研究从丹参悬浮培养细胞原生质体分离过程中的酶液配比、酶解时间、甘露醇浓度、离心条件等方面进行考察,分析各因素对其原生质体产量及活力的影响,建立丹参悬浮培养细胞原生质体的制备方法。并以Fluo-3/AM为荧光探针,以水杨酸为诱导子,利用激光共聚焦显微观测水杨酸 (Salicylic acid)诱导后丹参胞质 Ca2+信号的时空变化。为利用原生质体进行细胞信号转导研究奠定基础。
1 仪器、试剂与方法
1.1 仪器
普通光学显微镜,倒置荧光显微镜 (Leica DMI3000B型,德国);激光共聚焦显微镜(AIR/A1型,日本尼康);台式冷冻离心机(Allegra X-15R型,美国贝克曼库尔特);电热恒温水浴锅 (森信 DK-S26型);无菌过滤器(Millex-HV 0.45 μm)。
1.2 试剂
水杨酸 (Salicylic acid, Sigma, 批号69-72-7),纤维素酶 (R-10, Yakult Honsha,216017),果胶酶 (Y-23, Yakult Honsha, Y-007),离析酶 (R-10, Yakult Honsha, 202047),二乙酸荧光素 (FDA, aladdin, 596-09-8),钙离子荧光探针 (Fluo-3/AM, Sigma, 121714-22-5),二甲基亚砜 (DMSO, Sigma, 67-68-5),聚-L-赖氨酸氢溴酸盐 (Poly-L-lysine hydrobromide, Wt 300 000,Sigma, 25988-63-0),甘露醇 (Amresco, 69-65-8,USP级),牛血清白蛋白 (BSA, Sigma,9048-46-8),2-(N-吗啡啉)乙磺酸 (MES,Genview, 4432-31-9),NAA (天津博迪化工有限公司),6-BA (北京康倍斯科技有限公司),2,4-D(北京康倍斯科技有限公司)。
1.3 方法
1.3.1 诱导愈伤组织及继代培养
将丹参种子 (来源于陕西商洛丹参 GAP药源基地)培育出无菌苗,再将丹参无菌苗上生长健壮的叶片剪成 0.5 cm×0.5 cm大小的外植体。在无菌条件下,将外植体接种于MS固体培养基上,培养基中含有 1.0 mg/L NAA、1.0 mg/L 6-BA、1.0 mg/L 2,4-D、5.5 g/L 琼脂、30 g/L蔗糖,在光照条件下诱导形成愈伤组织。将诱导出的愈伤组织每20 d继代培养1次。培养条件同上。
将继代培养 3代性状稳定的愈伤组织再培养12 d,转接到含25 mL MS液体培养基 (无生长调节物质和琼脂)的50 mL的三角瓶中,在转速为125 r/min、温度为25 ℃的条件下黑暗悬浮培养。悬浮培养 6 d的细胞用于原生质体的分离。
1.3.2 原生质体的分离
分别用不同浓度的纤维素酶、果胶酶、离析酶及其组合处理材料。酶的溶剂为0.4 mol/L甘露醇、20 mmol/L的KCl、20 mmol/L的MES的混合溶液,用1 mol/L KOH调至pH 5.7。10 mL酶溶剂中加入组合酶后在 55 ℃水浴锅中活化10 min,放置到常温后再经0.45 μm微孔滤膜过滤灭菌。加入1.5 g鲜重的悬浮细胞,酶解混合物置于40 r/min、25 ℃黑暗条件下酶解4−20 h,每隔 2 h取样在显微镜下观察原生质体的形态和活力,确定酶浓度及酶解时间。结果为 3组平行实验的平均值。
1.3.3 原生质体纯化
利用上述选择的酶浓度组合充分酶解材料后,酶解混合物经 80 r/min离心 1 min,再用600目尼龙网过滤酶解混合液至 50 mL离心管中,加入等体积W5溶液 (154 mmol/L NaCl,125 mmol/L CaCl2,5 mmol/L KCl,2 mmol/L MES-K,pH值5.7),在不同离心速度 (300 r/min、600 r/min、1 000 r/min)下离心5 min,弃上清;再加入10 mL W5溶液离心5 min,弃上清,再加入2 mL W5溶液重悬后于冰上放置30 min后离心3 min,弃上清。加入1.5 mL W5溶液 (含0.4 mol/L甘露醇)重悬保存,得到纯化的原生质体。
1.3.4 原生质体的计数
用W5 稀释原生质体溶液5倍,取少量上述原生质体悬浮液滴加在 0.1 mm 血球计数板上。当原生质体充满计数室后,在光学显微镜下观察,并用细胞计数板测定原生质体的浓度:计算 4 个角上大格及中央大格 (共 5个大格)内的原生质体个数,然后按公式计算原生质体数,每个样品计数 3个重复,最后计算出每克鲜重材料游离得到的原生质体产量 (个/g FW)。

1.3.5 原生质体的活力检测
原生质体活力测定用 0.01%二乙酸荧光素(FDA)染色,用荧光显微镜统计发绿色荧光的原生质体数和原生质体总数,选取 3个有代表性的视野进行统计,取平均值。原生质体活力以一个视野中有活力的原生质体数占该视野中原生质体总数的百分数来表示。

1.3.6 Ca2+荧光探针Fluo-3/AM的装载
利用激光共聚焦显微镜进行观测前,原生质体需要进行贴壁固定。用30万分子量的多聚赖氨酸包被的盖玻片来固定原生质体,多聚赖氨酸的工作浓度为0.02 g/mL。Fluo-3/AM (溶于无水DMSO中,配成1 mmol/L的母液,于–20 ℃贮存,用W5溶液 (含0.4 mol/L甘露醇)稀释母液至终浓度为20 μmol/L则为Fluo-3/AM工作液。
将丹参悬浮细胞原生质体孵育在Fluo-3/AM工作液中1 h。W5洗涤两遍后,室温下静置1 h。之后固定在多聚赖氨酸处理的玻片上,再施加 22 mg/L的水杨酸处理。在处理30 min内,每30 s测定1次荧光并拍照。激发波长为488 nm,发射波长为510 nm。
2 结果与分析
2.1 酶对原生质体产量和活力的影响
以丹参悬浮培养细胞为材料,用不同的酶液组合 (0.4 mol/L甘露醇调节渗透压)处理12 h,600 r/min离心收集原生质体,结果如图1所示。纤维素酶 1.5%+果胶酶 0.3%组合提取得到的原生质体产量较低 (1.4×105个);纤维素酶1.5%、果胶酶0.3%和离析酶0.5%联合使用可使原生质体的产量增加至1.1×106个,这可能是由于离析酶的添加增加了酶解细胞壁的能力;但将 3种酶浓度均增大后并没有增加原生质体产量 (图1A)。取酶液处理后的材料镜检发现,酶液组合 (纤维素酶 3.0%+果胶酶 0.6%+离析酶1.0%)处理后破碎的细胞增多,部分原生质体发生破碎导致产量降低。用纤维素酶1.5%+果胶酶 0.3%+离析酶 0.5%处理得到的原生质体,FDA孵育后在荧光显微镜下发荧光的数目最多(图1B),且活力最高 (图1C),其他处理得到的原生质体发荧光数目和活力较低 (图1B、1C)。
2.2 酶解时间对原生质体产量和活力的影响
用酶液组合 (纤维素酶1.5%+果胶酶0.3%+离析酶 0.5%)酶解不同时间观察原生质体的产量和活力,结果如图2所示。酶解6 h时原生质体产量很低,6 h以后产量明显提高,12 h时原生质体产量最高,14 h后大幅度下降 (图2A)。镜检发现,酶解14 h后酶解液中碎片明显增多,说明原生质体产量下降是由于原生质体破碎导致的结果。FDA孵育后发荧光原生质体数目和产量的变化规律是一致的,酶解12 h得到的原生质体发荧光数目最多 (图2B)。酶解10 h以内的原生质体活力低于90%,酶解10−16 h的原生质体活力均处于高水平 (>95%),超出16 h后活力急剧下降 (图2C)。

图1 酶对原生质体产量和活力的影响 (A:酶液组合对原生质体产量的影响;B:酶液组合对发荧光原生质体数的影响;C:酶液组合对原生质体活力的影响)Fig. 1 The influence of enzymes on protoplast yield and vitality. (A)The influence of enzyme liquid combination on protoplast yield. (B)Combination of enzyme liquid on fluoresce protoplast number. (C)The influence of liquid combination on protoplast enzyme activity. Abscissa chart represents different enzyme liquid combination. C, P and M given in abscissa of the chart means cellulase, pectinase and macerozyme respectively.

图2 酶解时间对原生质体产量和活力的影响 (A:酶解时间对产量的影响;B:酶解时间对发荧光原生质体数的影响;C:酶解时间对原生质体活力的影响)Fig. 2 The influence of enzymatic hydrolysis time on protoplast yield and vitality. (A)The influence of enzymatic hydrolysis time on protoplast yield. (B)Enzymatic hydrolysis time on fluoresce protoplast number. (C)The influence of enzymatic hydrolysis time on protoplast enzyme activity.
2.3 酶液中甘露醇浓度对原生质体产量和活力的影响
当酶解液的渗透压与原生质体不能维持等渗时,原生质体会胀裂或者皱缩,适宜的渗透压是获得高质量原生质体的必要条件。甘露醇在酶解液中的主要作用是维持渗透压,甘露醇的浓度很大程度上决定了原生质体的产量和活力。以上述选择的酶组合酶解12 h,考察酶液中不同甘露醇浓度对原生质体产量和活力的影响,结果如图3所示。0.3 mol/L的甘露醇浓度下,原生质体产量虽然高但活力较低,镜检发现破碎细胞很多,这可能是由于低浓度甘露醇使原生质体在离心收集时易于沉降,但渗透压太低无法使细胞内外等渗造成原生质体胀破,收集的原生质体量多但破碎的也很多;在0.4−0.5 mol/L的甘露醇浓度下,原生质体的产量较高 (产量高于 106个);甘露醇浓度高于0.5 mol/L时原生质体产量急剧下降,主要是由于渗透压太高使得原生质体离心收集时难以沉降造成低产量 (图 3A)。低渗透压 (0.3 mol/L甘露醇)和高渗透压 (0.6−0.7 mol/L甘露醇)下,FDA孵育后发荧光原生质体数目较少 (图3B),原生质体活力较低 (<80%)(图3C),主要是由于低渗透压会造成原生质体破裂,高渗透压则造成原生质体皱缩。渗透压适宜时(0.4−0.5 mol/L甘露醇)提取得到的原生质体FDA孵育后发荧光的数目最多 (图 3B),活力最高 (96%)(图 3C)。
2.4 离心速度对原生质体产量和活力的影响
在上述选择的最佳组合条件下处理培养细胞,考察不同离心速度对原生质体活力和产量的影响,结果如图4所示。600 r/min离心得到的原生质体产量最高,转速过低 (300 r/min)和过高 (1 000 r/min)收集到的原生质体产量都较低,主要是由于低转速时原生质体难以沉降,高转速则使其易于破碎 (图4A)。适宜转速 (600 r/min)离心收集得到的原生质体,FDA染色后发荧光数目最多 (图4B),原生质体活力最高 (图4C),主要是因为细胞碎片在此转速下不易沉降,而完整的原生质体又能被沉降收集。
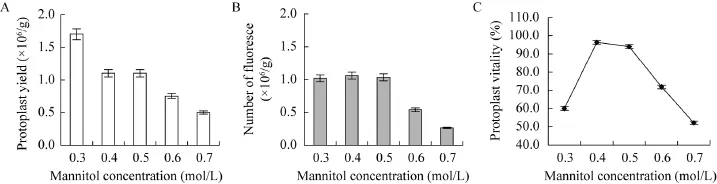
图3 甘露醇浓度对原生质体产量和活力的影响 (A:甘露醇浓度对原生质体产量的影响;B:甘露醇浓度对发荧光原生质体数的影响;C:甘露醇对原生质体活力的影响)Fig. 3 The influence of mannitol concentrations on protoplast yield and vitality. (A)The influence of mannitol concentrations on protoplast yield. (B)Mannitol concentration on fluoresce protoplast number. (C)The influence of mannitol concentrations on protoplast enzyme activity.
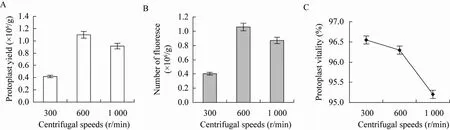
图4 离心速度对原生质体产量和活力的影响 (A: 离心速度对原生质体产量的影响;B: 离心速度对发荧光原生质体数的影响;C:离心速度对原生质体活力的影响)Fig. 4 The influence of centrifugal speeds on protoplast yield and vitality. (A)The influence of centrifugal speeds on protoplast yield. (B)Centrifugal speeds on fluoresce protoplast number. (C)The influence of centrifugal speeds on protoplast enzyme activity.
2.5 原生质体活力检测
FDA是一种亲脂性物质,可以透过原生质膜进入细胞内部,被胞内脂酶分解成一种发荧光的非亲脂性物质,用于检测细胞膜的完整性,荧光越强表示原生质体活力越高,破碎或无生命活力的原生质体则不发荧光。图5A−5E分别为可见光下纯化后的原生质体、488 nm激发光下经FDA染色后的发绿色荧光的原生质体、荧光显微镜下FDA染色后原生质体、激光共聚焦显微下FDA染色后原生质体3D全荧光效果图和明场下的原生质体激光显微图片。可以看出,FDA可定位于细胞膜,指示细胞膜的完整性,说明在本实验条件下提取的原生质体活力较高。

图5 原生质体活力检测 (A:可见光下的原生质体;B:488 nm激发光下经FDA染色后的原生质体;C:荧光显微镜下FDA染色;D:激光共聚焦显微下FDA染色后原生质体3D全荧光效果图;E:激光共聚焦显微镜明场下的原生质体)Fig. 5 Protoplast dynamic detection. (A)Protoplasts in bright field. (B)Protoplasts after FDA staining in excitation 488 nm. (C)Protoplasts after FDA staining under fluorescence microscope in excitation 488 nm. (D)Protoplasts after FDA staining under the laser confocal microscope in excitation 488 nm. (E)Protoplasts under the laser confocal microscope in bright field.
2.6 水杨酸刺激引起丹参培养细胞原生质体胞质Ca2+迸发
为了进一步观察提取的丹参培养细胞原生质体的结构和活力是否可以满足研究的要求,利用22 mg/L的水杨酸瞬时刺激原生质体,观察胞质Ca2+的荧光变化,如图6、7所示。水杨酸可以显著诱导丹参培养细胞原生质体的胞质Ca2+迸发,水杨酸处理后0.7 min胞质Ca2+荧光强度开始快速升高,至12 min时荧光强度达到最大,是对照 (水处理)的4.3倍,说明水杨酸瞬时刺激诱发了胞质 Ca2+迸发。图 7为与之对应的原生质体荧光变化激光共聚焦显微图片。分别用胞外、胞内 Ca2+抑制剂 2-APB和 LaCl3处理后,均抑制了水杨酸诱导的胞质Ca2+迸发,使荧光强度显著低于水杨酸处理,主要是由于钙通道抑制剂阻断了胞内、胞外钙库中的钙离子流向胞质。说明本实验条件提取的原生质体完全能够满足研究要求。
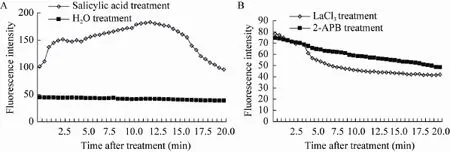
图6 水杨酸对丹参悬浮培养细胞原生质体胞质Ca2+荧光强度的影响 (A:水杨酸处理后Ca2+荧光强度;B:抑制剂处理后Ca2+荧光强度)Fig. 6 The influence of salicylic acid on [Ca2+]cyt fluorescence intensity of protoplasts which from salvia miltiorrhiza suspension culture cells. (A)[Ca2+]cyt fluorescence intensity curve after salicylic acid added. (B)[Ca2+]cyt fluorescence intensity curve after inhibitors added.
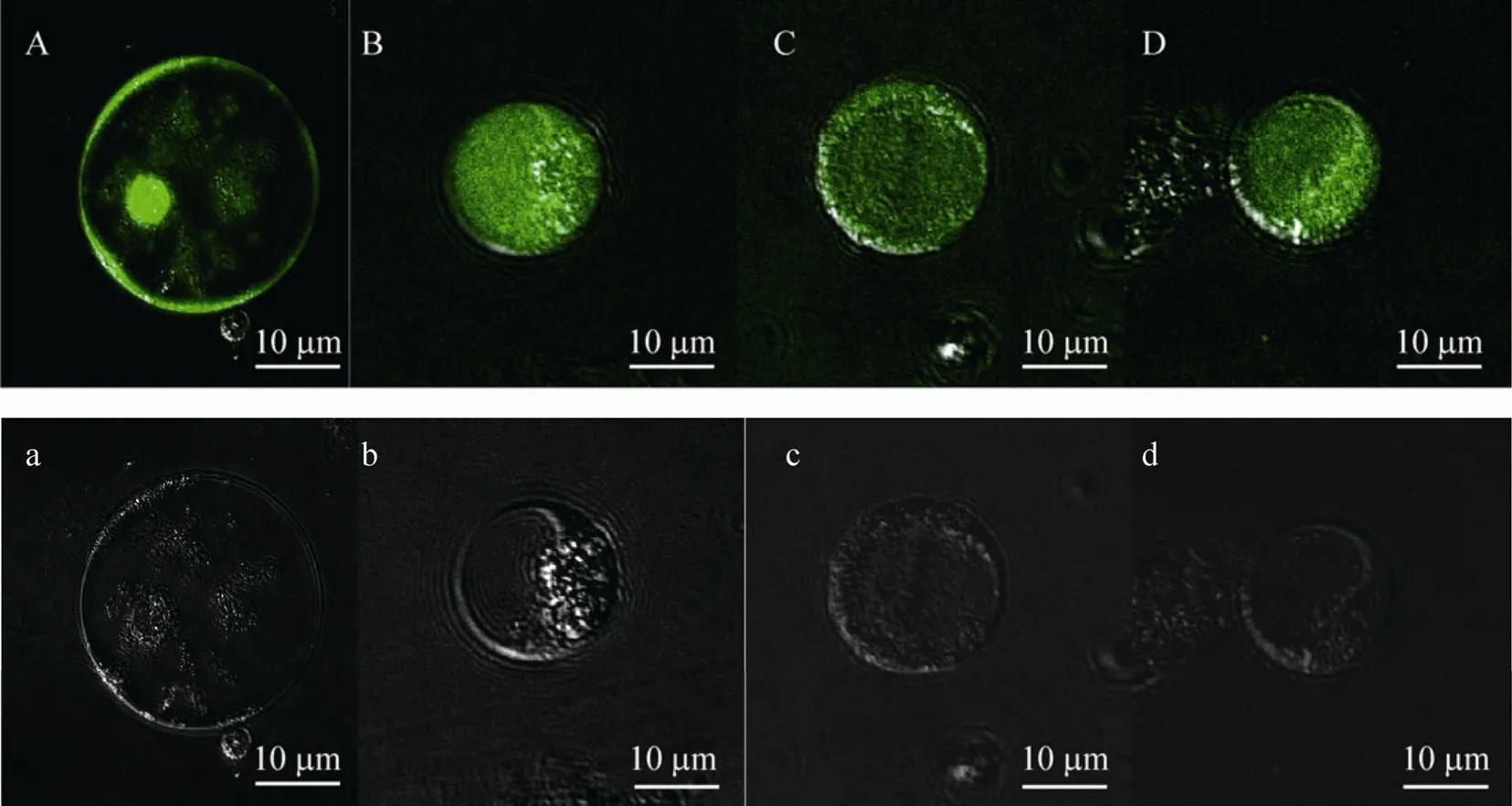
图7 水杨酸处理引起丹参培养细胞原生质体胞质钙离子迸发 (A:水处理;B:水杨酸处理;C:水杨酸+2-APB处理;D:水杨酸+LaCl3处理;a−d分别为A−D对应的明场下原生质体激光共聚焦显微图片)Fig. 7 Salicylic acid induced [Ca2+]cyt burst of protoplasts of Salvia miltiorrhiza suspension culture cells. (A)H2O treatment. (B)Salicylic acid treatment. (C)Salicylic acid+2-APB treatment. (D)Salicylic acid+ LaCl3 treatment;(A−D): Fluo-3/AM, excitation 488 nm. (a−d)Bright field.
3 讨论与结论
原生质体的提取、分离、纯化对环境的要求十分严格,用于除去细胞壁的酶的浓度和配比组合直接影响原生质体的产量[18]。植物细胞除去细胞壁后,如果酶液中的渗透压和细胞内的渗透压不平衡,会导致原生质体涨破或收缩[15]。因此,在配制酶解液、洗液和培养液中,加入一定浓度的渗透压稳定剂,使胞外渗透压大致与原生质体内的渗透压相同或相近[17]。在对提取好的原生质体进行收集时,离心机的转速直接影响原生质体的产量[15],适宜的转速不仅能保持原生质体不被外力破碎,且能在最大程度上获得更高产量的完整的原生质体。FDA是一种亲脂性物质,可以透过质膜,被质膜中的酯酶分解成一种非亲脂性的物质,用于反应细胞膜的完整性,荧光越强则原生质体活力越高。本研究采用甘露醇作为渗透压稳压剂,在溶液中加入了 2-(N-吗啡啉)乙磺酸有助于提高原生质体细胞膜的稳定性。
细胞通过细胞表面受体感受外界刺激后,将胞外信号转化为胞内信号,并通过细胞内信使系统级联放大信号,调节相应酶或基因的活性[19]。钙信号转导在调节植物生长、发育、代谢及适应环境中都有重要作用[6,20]。将钙离子探针 Fluo-3/AM成功导入细胞中是检测胞质钙离子的关键步骤,对于带有细胞壁的植物细胞常常因为细胞壁中存在的非特异性酯酶的影响而使装载失败[12-13]。利用除去细胞壁得到的原生质体则可以解决探针无法进入胞质的问题[21]。我们前期研究发现,水杨酸作为诱导子可以有效提高丹参培养细胞中丹酚酸 B[22]和迷迭香酸[23]的生物合成,其生物合成很可能与 Ca2+信号有关[24-26]。但 Ca2+在水杨酸诱导次生代谢物合成过程中的作用机制并不清楚。
本研究成功制备了丹参悬浮培养细胞的原生质体。制备条件为:纤维素酶1.5%、果胶酶0.3%、离析酶0.5%、0.4 mol/L甘露醇,酶解时间为12 h,在600 r/min下离心5 min收集,得到的原生质体产量为1.1×106,活力达到95%以上。在该条件下提取的原生质体完全能够满足后续以单个细胞为研究对象的一系列研究,为后续利用显微方法和成像技术研究诱导子诱导的钙信号的产生、传导及其对植物次生代谢的影响奠定了基础。
[1]Qian YQ. The application of plant protoplast.Chin Bull Bota, 1984, 2(1): l–7 (in Chinese).钱迎倩. 植物原生质体的应用. 植物学通报,1984, 2(1): l–7.
[2]Kanokwan R, Kevin AS. Protoplast isolation for species in the Chamelaucium group and the effect of antioxidant enzymes on protoplast viability. In Vitro Cell Dev Biol, 2013, 49(5): 593–598.
[3]Beatrix B, Thorsten N, Norbert N, et al. Receptormediated increase in cytoplasmic free calcium required for activation of pathogen defense in Parsley. The Plant Cell, 2000, 12(8): 1425–1440.
[4]Gabriele B, Monshausen, Tatiana N, et al. Ca2+regulates reactive oxygen species production and pH during mechanosensing in Arabidopsis roots.The Plant Cell, 2009, 21(8): 2341–2356.
[5]Knight MR, Compbell AK, Steven M, et al.Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium. Nature, 1991, 352(6335): 524–526.
[6]Sun J, Chen S, Dai S, et al. NaCl-induced alternations of cellular and tissue ion fluxes in roots of salt-resistant and salt-sensitive poplar sepecies. Plant Physiol, 2009, 149(2): 1141–1153.
[7]Baum G, Long JC, Jenkins GI, et al. Stimulation of the blue light phototropic receptor NPH1 causes a transient increase in cytosolic Ca2+. Proc Natl Acad Sci USA, 1999, 96(23): 13554–13559.
[8]Shabala S, Lone B, Shabala L, et al. Plasma membrane Ca2+transporters mediate virus-induced acquired resistance to oxidative stress. Plant Cell Environ, 2011, 34(3): 406–417.
[9]Berridge MJ, Galione A. Cytosolic calcium oscillators. FASEB J, 1988, 2(15): 3074–3082.
[10]Evans NH, McAinsh MR, Hetherington AM, et al.Calcium oscillations in higher plants. Curr Opin Plant Biol, 2001, 4(5): 415–420.
[11]Swanson SJ, Choi WG, Chanoca A, et al. In vivo imaging of Ca2+, pH, and reactive oxygen species using fluorescent probes in plants. Annu Rev Plant Biol, 2011, 62(6): 273–297.
[12]Callaham DA, Hepler PK. Measurement of Free Calcium in Plant Cells. New York: Oxford IRL Press, 1991: 383–410.
[13]Cork RJ. Problems with the application of quin-2-AM to measuring cytoplasmic free calcium in plant cells. Plant Cell Environ, 1986, 9(2):157–161.
[14]Sun H, Lang ZH, Zhu L, et al. Optimized condition for protoplast isolation from maize,wheat and rice leaves. Chin J Biotech, 2013, 29(2):224–234 (in Chinese).孙鹤, 郎志宏, 朱莉, 等. 玉米、小麦、水稻原生质体制备条件优化. 生物工程学报, 2013,29(2): 224–234.
[15]Zhao HJ, Zhang B, Chen AP, et al. Effects of different enzymolysis conditions on the cotyledons protoplast isolation of Alfalfa. Acta Agrestia Sin, 2008, 16(1): 51–53 (in Chinese).赵红娟, 张博, 陈爱萍, 等. 酶解对苜蓿子叶原生质体分离效果的影响. 草地学报, 2008, 16(1):51–53.
[16]Yu LJ, Wang Y, Xu XF, et al. Isolation method of root protoplasts of Malu zumi. Agri Res Arid Areas, 2010, 28(2): 118–121 (in Chinese).于立杰, 王忆, 许雪峰, 等. 珠眉海棠根原生质体分离条件研究. 干旱地区农业研究, 2010,28(2): 118–121.
[17]Zhao JL, Lu BD, Liang AH, et al. Optimization of the system of protoplast culture and regeneration for Chinese cabbage. Acta Bot Bor Occident Sin,2005, 25(3): 546–551 (in Chinese).赵军良, 逯保德, 梁爱华, 等. 大白菜原生质体培养再生体系的优化. 西北植物学报, 2005,25(3): 546–551.
[18]Fan XF, Li DB, Liu LX, et al. Protoplast culture and plant regeneration of Celastrus orbiculatus thunb. Bull Bot Res, 2011, 31(3): 300–305 (in Chinese).范小峰, 李东波, 刘灵霞, 等. 南蛇藤原生质体培养及植株再生. 植物研究, 2011, 31(3):300–305.
[19]Zhao J, Davis LC, Verpoorte R, et al. Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnol Adv, 2005,23(4): 283–333.
[20]Dodd AN, Kudla J, Sanders D, et al. The language of calcium signaling. Annu Rev Plant Biol, 2010,61(2): 593–620.
[21]Sun J, Wang ME, Ding MQ, et al. H2O2and cytosolic Ca2+signals triggered by the PM H+-coupled transport system mediate K+/Na+homeostasis in NaCl-stressed Populus euphratica cells. Plant Cell Environ, 2010, 33(6): 943–958.
[22]Dong JE, Wan GW, Liang ZS. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell culture. J Biotechnol, 2010, 148(2/3): 99–104.
[23]Jiao ML, Cao RR, Chen HY, et al. Effects of salicylic acid on synthesis of rosmarinic acid and relatedenzymes in the suspension cultures of Salvia miltiorrhiza. Chin J Biotech, 2012, 28(3):320–328 (in Chinese).焦蒙丽, 曹蓉蓉, 陈红艳, 等. 水杨酸对丹参培养细胞中迷迭香酸生物合成及其相关酶的影响.生物工程学报, 2012, 28(3): 320–328.
[24]Liu LC, Dong JE, Zhang JY, et al. Effects of calcium on synthesis of rosmarinic acid and related enzymes in suspension cultures of Salvia miltiorrhiza. Chin J Biotech, 2012, 28(11):1359–1369 (in Chinese).刘连成, 董娟娥, 张婧一, 等. Ca2+对丹参培养细胞中迷迭香酸合成及其相关酶活性的影响.生物工程学报, 2012, 28(11): 1359−1369.
[25]Cao RR, Xing BY, Dang XL, et al. Effects of Ca2+induced by salicylic acid on the biosynthesis of salvianolic acid B in young seedlings of Salvia miltiorrhiza Bunge. Chin J Biotech, 2013, 29(12):1836–1846 (in Chinese).曹蓉蓉, 行冰玉, 党小琳, 等. 水杨酸诱发的Ca2+对丹参幼苗丹酚酸 B生物合成的影响. 生物工程学报, 2013, 29(12): 1836–1846.
[26]Xu YN, Zhong JJ. Impacts of calcium signal transduction on the fermentation production of antitumor ganoderic acids by medicinal mushroom Ganoderma lucidum. Biotechnol Adv, 2012, 30(6):1301–1308.
