Bac-to-Bac/BmNPV杆状病毒在家蚕幼虫中表达重组鲎C因子
2014-10-31祁静刘涛李珍贡成良吴海苹张春
祁静,刘涛,李珍,贡成良,吴海苹,张春
1 中国科学院苏州生物医学工程技术研究所 苏州市分子诊断与治疗技术重点实验室,江苏 苏州 215163
2 苏州大学基础医学与生命科学学院,江苏 苏州 215006
3 厦门市鲎试剂实验厂有限公司,福建 厦门 361022
内毒素又称之“热原”,其主要成分为脂多糖 (Lipopolysaccharide,LPS)。热原进入人体内后可导致发热、休克甚至死亡,因而内毒素检测是药厂制药和医疗设备制造中必须的一道程序[1-2]。鲎试剂 (Limulus Amebocyte Lysate,LAL/Tachypleus Amebocyte Lysate, TAL)是国际上至今为止检测内毒素的金标准,具有简单、快速、灵敏度高等特点。然而鲎数量有限,鲎血中 G因子干扰以及鲎试剂批次间不均一性等局限性,迫切需要开发鲎试剂的替代品[3-5]。
鲎C因子 (Factor C)是鲎血细胞中对LPS具有高亲和力的一种丝氨酸蛋白酶,LPS激活Factor C后,活化的C因子能起始鲎血细胞中的凝集反应,并且其丝氨酸酶活性可以切割含精氨酸 (Arg)的三肽底物[6-7]。早期有研究人员在不同的表达系统中表达过鲎C因子,并证实该蛋白在昆虫细胞中表达时具有完全的生物学功能[8-11]。
杆状病毒表达系统具有高效表达,安全性好,表达产物稳定,后加工修饰等优点[12],与细菌、酵母、哺乳动物细胞表达系统并列为公认的基因工程 4大表达系统[13]。苜蓿银纹夜蛾核型多角体病毒 (Autographa califormica nuclear polyhedrosis virus, AcNPV)和家蚕杆状病毒 (Bombyx mori nuclear polyhedrosis virus,BmNPV)是最常用的两类杆状病毒表达载体。前者利用无血清培养基在昆虫细胞中表达蛋白,可用于生产和纯化分泌蛋白[14-15]。后者利用家蚕生物反应器表达重组蛋白,相比前者具有表达产量高、成本低、易形成自主产业等特点[16-18]。Wang等[11]利用AcNPV在草地贪夜蛾Spodoptera frugiperda 卵巢细胞系Sf9细胞中表达Factor C,可用于检测内毒素,其反应原理如图1所示。
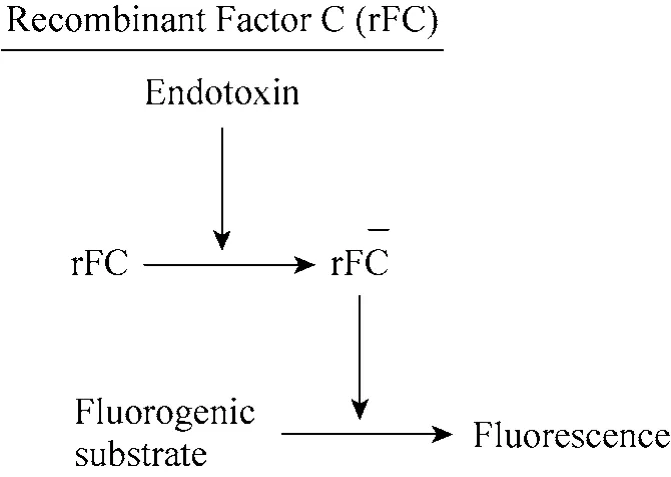
图1 重组Factor C检测内毒素原理图Fig. 1 Endotoxin detection mechanism of recombinant Factor C.
Bac-to-Bac/BmNPV杆状病毒表达系统是2005年由 Motohashi等[19]首次建立的,相比传统的BmNPV表达系统,生产重组蛋白的周期大大缩短[20]。本研究利用该系统表达鲎C因子,并分析表达产物的生物学活性,旨在为开发低成本新型内毒素检测试剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 载体、菌株和细胞
pFastBacHTb载体、大肠杆菌 (E. coli)DH5α由本实验室保存。E. coli BmDH10Bac[21]、家蚕细胞系 BmN和家蚕品种青松×皓月由苏州大学基础医学与生命科学学院贡成良实验室保存。东方鲎血细胞由厦门鲎试剂厂馈赠。
1.1.2 试剂和酶
RT逆转录试剂盒、限制性内切酶、T4 DNA连接酶购自Fermentas公司。KOD-plus-neo DNA聚合酶购自TOYOBO公司。Trizol试剂、Grace细胞培养基、胎牛血清、cellfectinⅡReagent均购自Gibco公司。荧光底物购自 Sigma公司。引物由上海生工有限公司合成。
1.2 方法
1.2.1 重组pFastbacHTb-Factor C载体的构建
用 trizol试剂提取东方鲎血细胞中的总RNA, 逆转录成cDNA。设计一对特异性引物扩增factor C基因片段 (P1和P2,见表1)。并且在上下游引物 5′末端分别引入 XbaⅠ和 KpnⅠ酶切位点。PCR扩增条件为94 ℃ 2 min;98 ℃ 10 s,59.5 ℃ 30 s,68 ℃ 3 min,35个循环。PCR产物用 1%琼脂糖电泳,胶回收。用 XbaⅠ和 KpnⅠ双酶切胶回收产物和pFastbacHTb载体,纯化后用T4 DNA连接酶连接,转化DH5α感受态,挑取转化子经37 ℃过夜培养后抽提质粒,酶切鉴定并测序。
1.2.2 重组bacmid-Factor C的构建
将测序正确的pFastbacHTb-Factor C质粒转化含有bacmid和helper质粒的BmDH10Bac感受态,蓝白斑筛选出阳性克隆,抽提重组bacmid,用M13通用引物PCR鉴定 (P3和P4,见表1)。
1.2.3 重组杆状病毒的获取
将鉴定正确的bacmid-Factor C用cellfectinⅡReagent转染六孔板中的BmN细胞,细胞密度为60%–70%,120 h后收集培养上清,1 000 r/min离心5 min,得到的上清即为P1。取P1按MOI值0.1连续感染BMN细胞两次后获得高滴度的P3病毒。
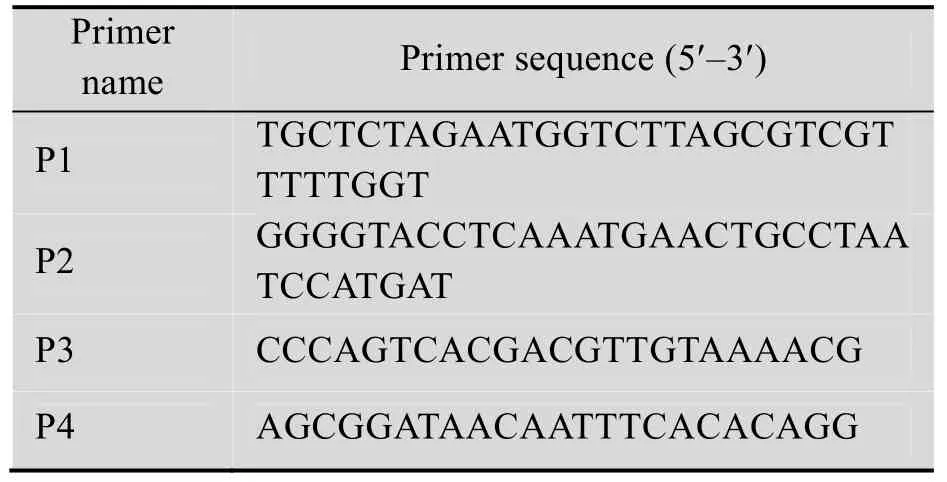
表1 PCR引物序列Table 1 Primer sequences
1.2.4 杆状病毒表达Factor C的鉴定
取MOI 1、5、10感染六孔板中的BMN细胞,48、72 h后收集细胞,1 000 r/min离心,用无内毒素水洗两遍。细胞沉淀裂解后,上清用于SDS-PAGE和Western blotting检测。浓度胶浓度 5%,分离胶浓度 10%。一抗为小鼠抗6×His单克隆抗体,二抗为辣根过氧化物酶标记的抗体。
1.2.5 重组Factor C在家蚕幼虫中的表达
参照Yue等[22]报道的方法,2 μL P3野生型(Wild)病毒和重组 Factor C病毒 (108pfu/mL)皮下注射到五龄第 1天家蚕体内,当家蚕出现典型的病变特征后每天收集家蚕血清,4 000 r/min、4 ℃离心 5 min,上清冻于–20 ℃。
1.2.6 重组Factor C的活性鉴定
参照Ding等[23]报道的方法,家蚕血清用无内毒素水稀释100、500、1 000倍,利用动态荧光法检测重组Factor C活性。在无内毒素的96孔板中依次加入LPS (0–10 EU/mL),0.01%吐温20,稀释的蚕血,75 μmol/L荧光底物Boc-Val-Pro-Arg-MCA,总体积 200 μL。设定酶标仪的反应温度为37 ℃,激发波长360 nm,发射波长460 nm,检测荧光信号。每个浓度做3个复孔,设置阴性对照2个。
2 结果
2.1 重组pFastbacHTb-Factor C载体的构建
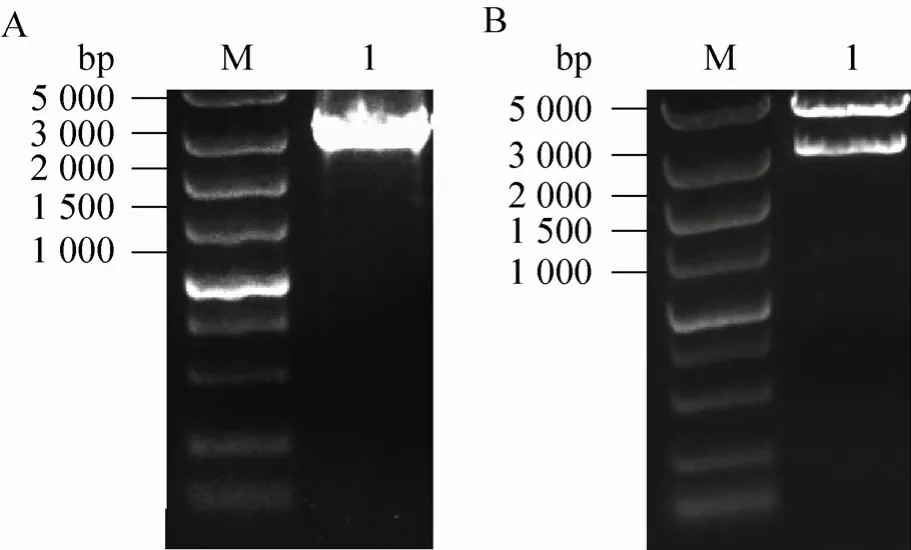
图2 Factor C基因的克隆和pFastbacHTb-Factor C的构建Fig. 2 Cloning of factor C and construction of pFastbacHTb-Factor C. (A)RT-PCR cloning of factor C. M: DNA marker DS 5 000; 1: PCR fragment of factor C. (B)Identification of pFastbacHTb-Factor C by restrictive enzyme digestion. M: DNA marker DS 5 000; 1: pFastbacHTb-factor C digested with XbaⅠ/Kpn I.
东方鲎factor C基因全长3 060 bp,编码1 019个氨基酸。以逆转录的cDNA为PCR模板扩增目的基因。琼脂糖凝胶电泳显示目的基因的大小在3 000 bp附近 (图2A)。factor C基因通过XbaⅠ和KpnⅠ插入到pFastbacHTb载体中,转化后抽提质粒双酶切鉴定,可切下4.8 kb和3 kb左右预期大小的条带 (图2B)。酶切鉴定正确的质粒送去测序,与GenBank中已报道的东方鲎factor C基因序列 (D90271)比对,显示仅仅编码的第 823个氨基酸不一样,但与同一亚科的圆尾鲎 factor C基因序列该位点的氨基酸一致 (S77063),说明得到的基因序列是正确的。
2.2 重组bacmid-Factor C的鉴定
以野生型bacmid和重组bacmid-Factor C为模板,M13上下游引物做PCR扩增,鉴定重组杆状病毒 DNA。结果显示,野生型 bacmid在250 bp附近有目的条带(图3A),与预期的300 bp一致。重组bacmid在5 000–6 000 bp之间有目的条带 (图3B),与预计的5 500 bp结果一致。
2.3 重组杆状病毒的获取
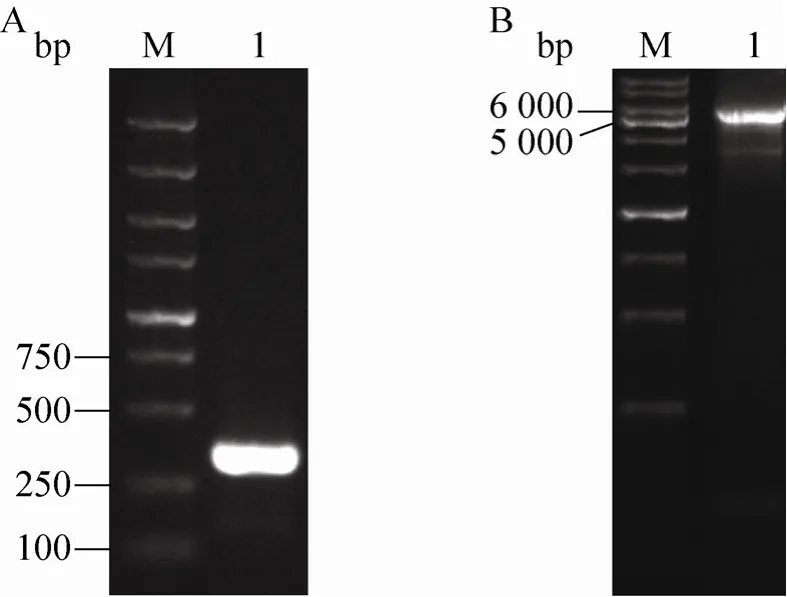
图3 PCR鉴定重组bacimdFig. 3 Identification of recombinant bacmid by PCR.(A)M: DNA marker DS 5 000; 1: wild bacmid. (B)M:1 kb DNA marker; 1: recombinant bacmid.
重组bacmid转染BmN细胞后,72 h后可以观察到明显的病变,表现在细胞停止生长,形状由梭形变成圆形。120 h大部分细胞飘起来,并裂解 (图 4)。此时可以收集到成熟的杆状毒P1。
2.4 重组Factor C在BmN细胞中的表达
用抗his标签的单克隆抗体检测BmN细胞中表达的重组Factor C,同时用未感染的BmN细胞和野生型病毒感染的BmN细胞作对照。结果显示,相比对照,重组病毒感染的BmN细胞在100 kDa处有预期大小的条带 (图5)。

图4 正常细胞和bacmid转染后的细胞Fig. 4 Normal BMN and BMN cells transfected with bacmid. (A)Normal BMN cells. (B)BMN cells transfected with recombinant bacmid after 120 h.
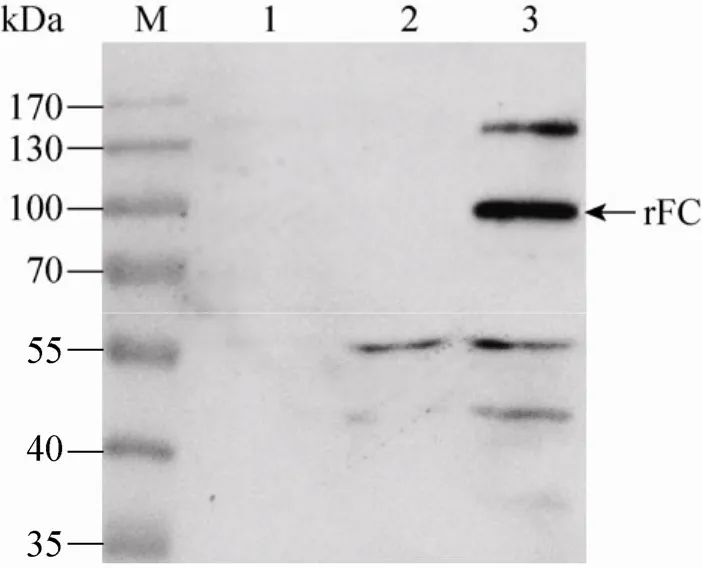
图5 抗 His标签单抗对重组 rFC的 Western blotting检测Fig. 5 Identification of rFC expressed in BmN cells by Western blotting using anti-his-tag antibody. M:PageRuler TM prestained protein ladder; 1: normal BmN cells; 2: BmN cells infected by wild virus; 3: BmN cells infected with recombinant virus.
2.5 重组Factor C在家蚕幼虫中的表达
杆状病毒注射到家蚕幼虫后,72 h后家蚕出现典型的感染症状,即食欲下降,生长缓慢,并出现身体肿胀,关节处最为明显 (图6)。144 h后感染的家蚕幼虫陆续开始死亡。收集72、96、120、144 h的家蚕血清,用于后续Factor C的活性测定。
2.6 重组Factor C的活性鉴定

图6 正常家蚕幼虫和病毒感染后的家蚕幼虫Fig. 6 Normal silkworm larvae and infected silkworm larvae. (A)Normal silkworm larvae. (B)Silkworm larvae infected by recombinant virus after 72 h.
取病毒感染的家蚕血清稀释 100、500、1 000倍,测定其中Factor C的活性。结果显示5 d时收集的蚕血稀释500倍时检测的信噪比较高,且灵敏度较高 (表 2)。取病毒感染 5 d后的家蚕血清做500倍稀释,内毒素梯度为0.2、0.5、1、2、5、10 EU/mL,动态荧光法检测Factor C活性。结果显示,随着内毒素浓度的增加以及反应时间的延长,检测到的荧光信号增强(图7A)。以内毒素浓度和荧光强度做标准曲线,R2值为0.997,因而表达的重组Factor C可以用来检测内毒素,且灵敏度达到了 0.2 EU/mL(图 7B)。
3 讨论
重组鲎C因子具有LPS结合活性和丝氨酸蛋白酶活性,因而可作为新型内毒素检测试剂,解决鲎数量有限,鲎血中G因子旁路干扰[24],鲎试剂各批次不稳定性的缺点。早期有研究者在细菌,酵母中表达重组 C因子,均不能得到有丝氨酸酶活性的蛋白,后证实该重组蛋白在昆虫细胞中表达后具有完整的生物学活性[11]。昆虫表达系统具有容量大、周期短、表达量高、翻译后加工等优点。Ding等[25]在昆虫细胞 sf9中表达了重组C因子,用培养上清检测内毒素,灵敏度可到0.01 EU/mL,达到了高灵敏度的鲎试剂检测水平 (0.06–0.015 EU/mL)。但利用该方法产业化生产试剂,需要无血清,悬浮培养大量细胞,成本较高。Usami等[26]比较了多种重组蛋白在昆虫细胞 sf9和家蚕幼虫中的表达水平,结果显示,家蚕幼虫中重组蛋白的表达量比细胞表达量平均高达70倍。此外,利用家蚕为宿主,相比昆虫细胞具有成本低,易形成自主产业等优势。

表2 病毒感染家蚕幼虫不同时间点后 C因子相对活性的比较Table 2 Relative activity of Factor C at different times after infection by virus
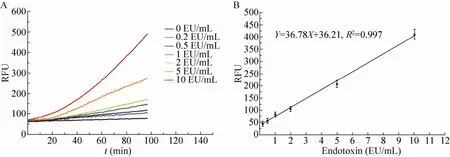
图7 重组Factor C的活性检测Fig. 7 Activity detection of recombinant Factor C. (A)Dynamic curve of endotoxin detection. (B)Standard curve of endotoxin detection.
本研究通过RT-PCR获得了东方鲎的factor C基因序列,利用Bac-to-Bac/BmNPV表达系统,首次在家蚕幼虫中表达了重组Factor C,并用动态荧光法检测到了Factor C的活性。由于家蚕血清中的某些丝氨酸蛋白酶也能非特异切割荧光底物,产生荧光信号,对血清进行稀释能降低干扰。研究显示,病毒感染的家蚕血清稀释100、500、1 000倍时均能够检测到重组Factor C的活性。其中,稀释 500倍时检测的信噪比较高,且具有较高灵敏度,表明了重组 Factor C在家蚕幼虫中有较高的表达。Factor C表达载体的N端带有6个组氨酸 (his),用重组病毒感染BmN细胞和家蚕幼虫,用抗 his-标签的抗体对细胞裂解液和血清做Western blotting分析。前者能检测到 100 kDa的目的带,后者未能检测到his标签,推测重组Factor C在家蚕幼虫中表达时N端的his标签随信号肽一起被切除后,蛋白分泌到血清中。由于环境中内毒素的存在,以及稀释倍数较高,表达的重组Factor C对LPS的灵敏度目前只能到0.2 EU/mL,但仍达到了普通鲎试剂的检测水平(0.5–0.125 EU/mL)。如何有效降低家蚕血清中的干扰,以及获得更高的检测灵敏度,还需要进一步的研究。本研究为开发低成本新型内毒素检测试剂奠定了基础。
[1]Morrison DC,Ulevitch RJ. The effects of bacterial endotoxins on host mediation systems. A review.Am J Pathol, 1978, 93(2): 526–618.
[2]Raetz CR, Whitfield C. Lipopolysaccharide endotoxins. Annu Rev Biochem, 2002, 71: 635–700.
[3]Levin J,Bang FB. The role of endotoxin in the extracellular coagulation of limulus blood. Bull Johns Hopkins Hosp, 1964, 115: 265–274.
[4]Hu JC, Yu WB, Ma YY. Research progress of endotoxin. Med Recapit, 2000, 5: 222–224 (in Chinese).胡金川, 于文彬,马越云. 细菌内毒素检测方法的研究进展. 医学综述, 2000, 5: 222–224.
[5]Wang L, Gao H, Cai T, et al. Research and development of tachypleus amebocyte lysate. Chin J Pharm Anal, 2007, 6: 938–942 (in Chinese).王莉, 高华, 蔡彤, 等. 鲎试剂的研究及应用进展. 药物分析杂志, 2007, 6: 938–942.
[6]Nakamura T, Tokunaga F, Morita T, et al.Intracellular serine-protease zymogen, Factor-C,from horseshoe-crab hemocytes-its activation by synthetic lipid-a analogs and acidic phospholipids.Eur J Biochem,1988, 176(1): 89–94.
[7]Tokunaga F, Miyata T, Nakamura T, et al.Lipopolysaccharide-sensitive serine-protease zymogen(factor C)of horseshoe crab hemocytes.Identification and alignment of proteolytic fragments produced during the activation show that it is a novel type of serine protease. Eur J Biochem,1987, 167(3): 405–416.
[8]Pui AWM, Ho B, Ding JL. Yeast recombinant Factor C from horseshoe crab binds endotoxin and causes bacteriostasis. J Endotoxin Res, 1997, 4(6):391–400.
[9]Roopashree SD, Chai C, Ho B, et al. Expression of Carcinoscorpius rotundicauda factor C cDNA.Biochem Mol Biol Int, 1995, 35(4): 841–849.
[10]Roopashree SD, Ho B, Ding JL. Expression of Carcinoscorpius rotundicauda Factor C in Pichia pastoris. Mol Mar Biol Biotechnol, 1996, 5(4):334–343.
[11]Wang J, Ho B, Ding JL. Functional expression of full length limulus Factor C in stably transformed Sf9 cells. Biotechnol Lett, 2001, 23(1): 71–76.
[12]Jarvis DL. Developing baculovirus-insect cell expression systems for humanized recombinant glycoprotein production. Virology, 2003, 310(1):1–7.
[13]Wei YL, Li YN, Zhang ZF, et al. Advance in research and application of baculovirus express system. Biotechnol Bull, 2010, 10: 1–7 (in Chinese).韦永龙,李轶女, 张志芳,等. 杆状病毒表达系统及其应用进展. 生物技术通报, 2010, 10: 1–7.
[14]Khodabandehloo M, Shamsi Shahrabadi M,Keyvani H, et al. Cloning and expression of simian rotavirus spike protein (VP4)in insect cells by baculovirus expression system. Iran Biomed J,2009, 13(1): 9–18.
[15]Li CL, Shen H, Lin MQ, et al. Expression of murine interleukin 12(mIL-12)in insect cells. Acta Biol Experim Sin, 1998, 31(2): 171–178 (in Chinese).李昌麟, 沈惠, 林明群, 等. 鼠白细胞介素12(mIL-12)在昆虫细胞中的表达. 实验生物学报,1998, 31(2): 171–178.
[16]Wu D, Murakami K, Liu N, et al. Expression of biologically active recombinant equine interferongamma by two different baculovirus gene expression systems using insect cells and silkworm larvae. Cytokine, 2002, 20(2): 63–69.
[17]Tao T, Su SK, Miao YG, et al. Expression of apalbumin1 of Apis cerana cerana in the larvae of silkworm, Bombyx mori. J Agric Food Chem, 2008,56(20): 9464–9468.
[18]Han J, Zang Y, Lu H, et al. A novel recombinant dual human SCF expressed in and purified from silkworm, Bombyx mori, possesses higher bioactivity than recombinant monomeric human SCF. Eur J Haematol, 2004, 72(4): 273–279.
[19]Motohashi T, Shimojima T, Fukagawa T, et al.Efficient large-scale protein production of larvae and pupae of silkworm by Bombyx mori nuclear polyhedrosis virus bacmid system. Biochem Biophys Res Commun, 2005, 326(3): 564–569.
[20]Yao LG, Liu ZC, Zhang XM, et al. A highly efficient method for the generation of a recombinant Bombyx mori nuclear-polyhedrosisvirus Bacmid and large-scale expression of foreign proteins in silkworm (B. mori)larvae. Biotechnol Appl Biochem, 2007, 48(Pt 1): 45–53.
[21]Zhang X, Shen W, Lu Y, et al. Expression of UreB and HspA of Helicobacter pylori in silkworm pupae and identification of its immunogenicity.Mol Biol Rep, 2011, 38(5): 3173–3180.
[22]Yue W, Miao Y, Li X, et al. Cloning and expression of manganese superoxide dismutase of the silkworm, Bombyx mori by Bac-to-Bac/BmNPV Baculovirus expression system. Appl Microbiol Biotechnol, 2006, 73(1): 181–186.
[23]Ding JL, Ho B. Assays for endotoxin: US,6645724. 2003-11-11.
[24]Seki N, Muta T, Oda T, et al. Horseshoe crab(1,3)-beta-D-glucan-sensitive coagulation factor G.A serine protease zymogen heterodimer with similarities to beta-glucan-binding proteins. J Biol Chem, 1994, 269(2): 1370–1374.
[25]Ding JL, Ho B. Endotoxin detection-from limulus amebocyte lysate to recombinant factor C. Subcell Biochem, 2010, 53: 187–208.
[26]Usami A, Ishiyama S, Enomoto C, et al.Comparison of recombinant protein expression in a baculovirus system in insect cells (Sf9)and silkworm. J Biochem, 2011, 149(2): 219–227.
