小鼠T-bet逆转录病毒载体的构建与功能验证
2014-10-31张雪洁张建华张伟郭洁周旭宇
张雪洁,张建华,张伟,郭洁,周旭宇
1 中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101
2 安徽大学生命科学学院,安徽 合肥 230039
T-bet是T-box基因家族的转录因子,于2000年被研究者发现,早期被认为只表达于 T细胞内[1]。近年的研究发现,T-bet还广泛表达于天然免疫系统及适应性免疫系统中的多种细胞之中。T-bet含530个氨基酸,包括一个由189个氨基酸组成的能与T盒DNA结合的结构域,其功能十分广泛而复杂。在适应性免疫应答中,T-bet对CD4+T细胞亚群的分化以及CD8+T细胞的功能维持均起重要作用。T-bet发挥功能的分子机制至今仍待进一步研究。
为研究T-bet的功能及其分子机制,本实验构建了含有小鼠T-bet基因Tbx21的逆转录病毒载体。该载体上含有Thy1.1报告基因,可与T-bet共同转录表达。Thy1.1表达于细胞表面,因此可以通过检测 Thy1.1的表达方便地鉴定出表达T-bet的细胞。此外,本实验还进一步证明了包装的病毒可以感染小鼠T细胞,并且外源表达T-bet后,可进一步激活T-bet的靶基因Ifng[2],从而引起γ干扰素 (IFN-γ)的表达。该方法可证明构建的载体具有表达功能正常的小鼠T-bet的能力。通过构建该载体,为在小鼠来源的细胞中进一步研究T-bet的功能与作用机制奠定了良好基础。
1 材料与方法
1.1 动物、细胞株、载体及测序
实验所用Tbx21基因敲除小鼠购于Taconic公司;Platinum-E逆转录病毒包装细胞株为本实验室保存;T-bet表达载体为本实验室保存;pGEM-T载体购于 Promega公司;pMSCVIRES-Thy1.1载体购于Addgene;感受态DH5α为本实验室自制;测序工作由 Invitrogen公司完成。
1.2 试剂与仪器
内切酶、连接酶及PCR相关酶购于TaKaRa公司;Fugene 6转染试剂为Promega公司产品;Anti-CD8α、Anti-CD3、Anti-CD28为 BioLegend公司产品;流式抗体 Anti-CD4-APC、Anti-CD8α-PerCP、Anti-Thy1.1-FITC、Anti-IFN-γ-PE为eBioscience公司产品;使用仪器主要为流式细胞仪BD FACSCalibur,购于BD公司。
1.3 含有酶切位点的T-bet基因的克隆和连接
以 T-bet-GFP表达质粒为模板,从 Tbx21 cDNA上游设计上游引物,引物5′端加入SalⅠ内切酶酶切位点,从 Tbx21基因下游设计下游引物,3′端加入BglⅡ内切酶酶切位点,扩增出带有酶切位点及Kozak序列的Tbx21基因。胶回收后与 pGEM-T载体连接,连接产物转化感受态DH5α,用蓝白斑筛选的方法初步筛选重组子。初步筛选阳性的重组子使用PCR及SalⅠ和BglⅡ双酶切两种方法进行鉴定,对两种方法鉴定均为阳性的重组子进行测序。
1.4 pMSCV逆转录病毒载体的构建
将上一步得到的经测序带有Tbx21基因的T载体使用 SalⅠ和 BglⅡ双酶切,胶回收 1.6 kb片段。同时,pMSCV-IRES-Thy1.1载体亦使用SalⅠ和 BglⅡ进行酶切,酶切后同样进行胶回收。SalⅠ和BglⅡ酶切位点均位于载体启动子后及IRES序列之前,可使插入序列与报告基因同时表达。将酶切回收后的 Tbx21片段与载体连接,连接产物转化感受态DH5α。抗性筛选阳性克隆同样使用PCR与SalⅠ和BglⅡ双酶切两种方法进行鉴定。
1.5 质粒的转染和逆转录病毒的包装
提取所构建的pMSCV-Tbet-IRES-Thy1.1质粒以及pMSCV-IRES-Thy1.1质粒,使用转染试剂Fugene 6转染Platinum-E逆转录病毒包装细胞系,转染后孵育48 h收集上清液,即为病毒悬液。使用Thy1.1荧光抗体对细胞进行染色,流式细胞术检测质粒转染效率。
1.6 逆转录病毒感染细胞系
使用上述病毒悬液分别感染贴壁细胞系NIH-3T3和悬浮小鼠杂交瘤细胞系D9,48 h后使用Thy1.1荧光抗体染色,流式细胞术检测感染效率。
1.7 逆转录病毒感染活化CD4+ T淋巴细胞
磁珠负选出CD4细胞,置于提前用CD3、CD28抗体包被好的24孔板中,加入200 U/mL的重组人IL-2,培养48 h后可供感染。
病毒悬液中加入终浓度为 8 μg/mL的聚凝胺,使用该病毒混合液重悬 T细胞后室温条件下1 800 r/min离心45 min进行感染,而后置于培养箱孵育 4 h,将病毒液更换为加有重组人IL-2的培养基,培养48 h。
1.8 逆转录病毒感染T细胞后T-bet表达检测和功能鉴定
感染48 h后,T细胞先进行表面染色,固定后加入破膜剂破膜,然后使用T-bet和IFN-γ荧光抗体进行胞内染色,染色完成后使用流式细胞术检测感染效率以及T-bet和IFN-γ的表达情况。
2 结果
2.1 pMSCV-Tbet-IRES-Thy1.1载体的构建
2.1.1 pGEM-T-Tbet载体的鉴定
将蓝白斑筛选出再经PCR鉴定正确的重组基因克隆,使用 SalⅠ和 BglⅡ进行酶切鉴定,其图谱与原设计相同,包含1.6 kb的目的基因条带及3 kb的载体条带。对重组基因进行序列测定,使用 M13与 T7引物分别从插入位点两端进行测序,并设计引物从Tbx21基因700 kb处进行测序,测序结果进行拼接后,与小鼠T-bet基因吻合,结果正确 (图1A)。
2.1.2 pMSCV-Tbet-IRES-Thy1.1载体的鉴定
将PCR鉴定正确的克隆经SalⅠ和BglⅡ双酶切鉴定,与原设计图谱相同,包含1.6 kb的目的基因条带及6 kb的载体条带 (图1B、C)。
2.2 逆转录病毒的包装
使用构建的pMSCV-Tbet-IRES-Thy1.1逆转录病毒载体转染逆转录病毒包装细胞系Platinum-E,并对细胞进行报告基因 Thy1.1的荧光抗体染色,从而利用流式细胞术检测转染效率。结果显示报告基因 Thy1.1表达率超过80% (图为84.4%),表明所构建载体可以高效转染包装细胞,并可同时转录表达目的基因及其报告基因,从而进行高效的重组逆转录病毒的包装(图 2)。
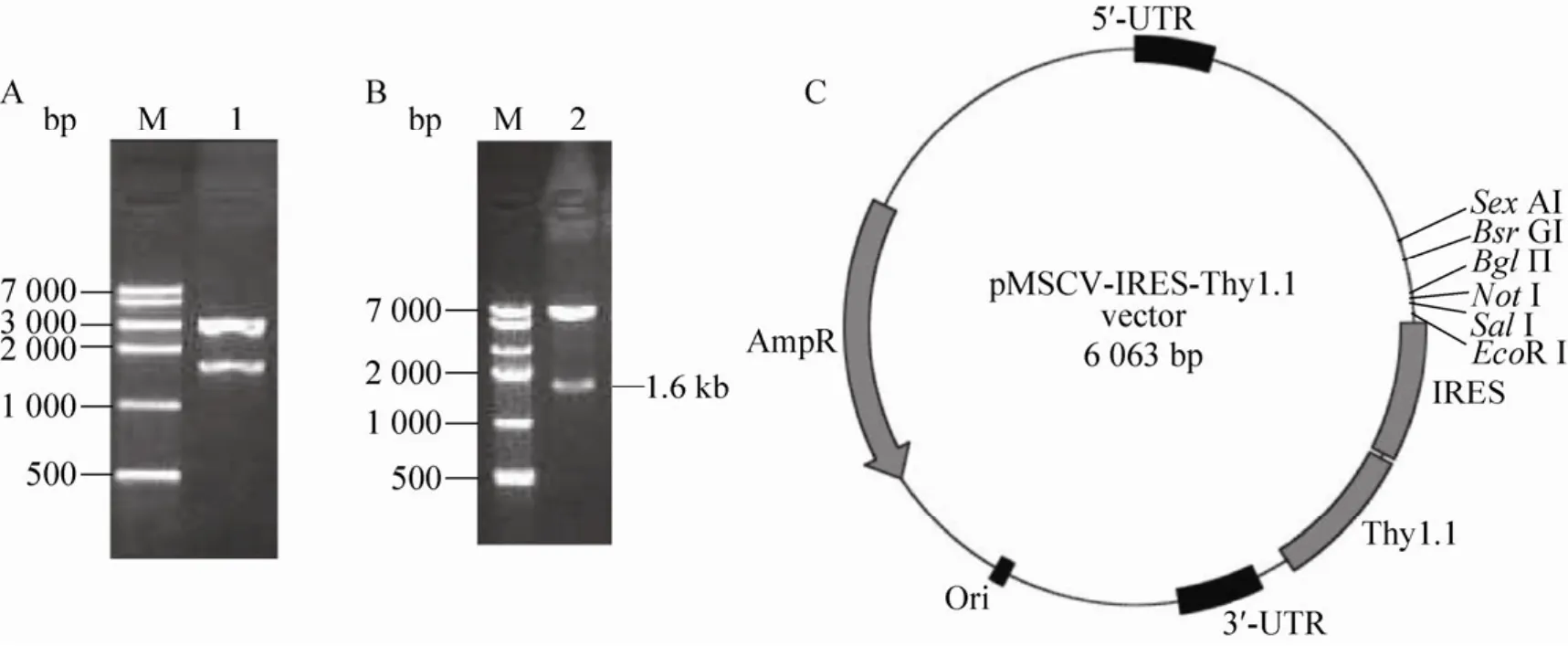
图1 pMSCV-Tbet-IRES-Thy1.1逆转录病毒载体的鉴定Fig. 1 Identification of pMSCV-Tbet-IRES-Thy1.1 retroviral vector. (A)M: TiangenTM DNA marker Ⅳ; 1:pGEM-T-Tbet digested with SalⅠand BglⅡ. (B)M: TiangenTM DNA marker Ⅳ; 2: pMSCV-Tbet-IRES-Thy1.1 digested with SalⅠand BglⅡ. (C)Map of pMSCV-IRES-Thy1.1 vector.
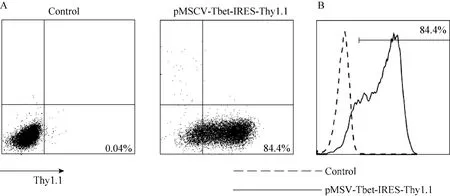
图2 pMSCV-Tbet-IRES-Thy1.1转染包装细胞系Platinum-E的效率Fig. 2 Transfection efficiency of pMSCV-Tbet-IRES-Thy1.1 transfected into Platinum-E. (A)Flow cytometry of untransfected Platinum-E cells (left)and cells transfected with pMSCV-Tbet-IRES-Thy1.1 recombinant retroviral vector (right). (B)Histogram overlay of untransfected Platinum-E cells (dotted line)and cells transfected with pMSCV-Tbet-IRES-Thy1.1 recombinant retroviral vector (solid line).
2.3 逆转录病毒感染细胞系
使用重组病毒感染 NIH-3T3及悬浮杂交瘤细胞D9,以检测重组逆转录病毒的感染能力,对感染后细胞进行报告基因Thy1.1的荧光抗体染色,并利用流式细胞术检测转染效率。结果显示所包装的重组病毒可以成功感染贴壁细胞系及悬浮细胞系,并具有较好的感染效率。两种细胞系的感染效率分别为 57.2%和 58.3%(图 3A、B)。
2.4 逆转录病毒感染活化的CD4+ T细胞及其T-bet表达情况检测
使用包装的T-bet重组逆转录病毒及空重组病毒分别感染活化的T-bet敲除的CD4+T细胞,对T细胞进行报告基因Thy1.1和 T-bet的荧光抗体染色并使用流式细胞术检测。结果发现,T-bet重组逆转录病毒感染的细胞,Thy1.1阳性细胞中的T-bet表达明显上升,证明包装载体能够有效地转录及表达目的基因和报告基因 (图4)。

图3 重组逆转录病毒感染NIH-3T3及D9细胞系的效率检测Fig. 3 Infection efficiency of NIH-3T3 and D9 cell lines with recombinant retrovirus. (A)Flow cytometry histogram overlay of uninfected NIH-3T3 cells (dotted line)and NIH-3T3 cells infected with pMSCV-Tbet-IRES-Thy1.1 recombinant retrovirus (solid line). (B)Flow cytometry histogram overlay of uninfected D9 cells (dotted line)and D9 cells infected with pMSCV-Tbet-IRES-Thy1.1 recombinant retrovirus (solid line).

图4 被重组逆转录病毒感染的T-bet敲除CD4+T细胞可表达T-betFig. 4 Expression of T-bet in T-bet knock out CD4+ T cells after infection of recombinant retrovirus. Flow cytometry histogram overlay of Thy1.1 negative T cells (dotted line)and Thy1.1 positive T cells (solid line). (A):T-bet knock out CD4+ T cell infected with pMSCV-IRES-Thy1.1 recombinant retrovirus. (B): T-bet knock out CD4+T cell infected with pMSCV-Tbet-IRES-Thy1.1 recombinant retrovirus.
2.5 逆转录病毒载体所表达T-bet的功能鉴定
对感染后的T-bet敲除的CD4+T细胞进行胞内 IFN-γ荧光抗体染色,使用流式细胞术检测。结果显示,被T-bet重组病毒感染后的细胞,Thy1.1阳性细胞 IFN-γ的表达水平增强,高于未被感染的 Thy1.1阴性细胞和被不含 T-bet的空重组病毒感染的细胞,表明所构建的逆转录病毒表达的T-bet可在小鼠细胞内发挥自身转录因子功能,从而调控其下游靶基因的表达(图 5A、B)。
3 讨论
T-bet作为免疫系统中重要的转录因子,其功能多样。早期研究发现T-bet在naive T细胞向Th1方向分化时具有重要的作用[1,3]。Th1细胞又称为炎症性T细胞,主要分泌IL-2、IFN-γ和TNF-α等细胞因子,在抗胞内病原体 (病毒、细菌)的感染中发挥重要作用,并与细胞毒和局部炎症有关的免疫应答相关。随着对T-bet研究的不断深入,研究人员发现T-bet亦广泛的在其他一些 T细胞亚群中,以复杂的机制发挥着多种调控功能[4-5],并对CD4+T细胞亚群的分化[6]以及CD8+T细胞的功能维持[7]均起重要作用。如T-bet可以促进naive T细胞向Th1细胞分化[8],并抑制其向Th2[9]、Th17[10]等其他亚群的分化过程;同时,也可以通过与转录因子Bcl-6的相互相作用[11]而抑制 naive T向 Tfh细胞的分化过程[12]。T-bet同样也可在调节性T细胞中表达,并对免疫反应产生相应的调节作用[13]。此外,T-bet对CD8+T细胞发挥免疫效应也起着重要作用[14]。近年的研究还发现,T-bet还表达于天然免疫系统及适应性免疫系统中的多种细胞之中,如T-bet在自然杀伤性细胞[15-17]以及天然淋巴样细胞(ILCs)的形成中起着决定性作用[18-22]。因此,作为天然免疫与适应性免疫的纽带[23],T-bet再次成为研究的热点。

图5 被重组逆转录病毒感染后,T-bet敲除CD4+ T细胞的IFN-γ表达量显著上调Fig. 5 Upregulation of IFN-γ expression in T-bet knockout CD4+ T cell after infection of recombinant retrovirus. (A)Flow cytometry of T-bet knock out CD4+T cells infected with empty recombinant retrovirus (left)and pMSCV-Tbet-IRES-Thy1.1 recombinant retrovirus (right), respectively. (B)Proportion of IFN-γ positive cells among CD4+ T cells. Empty: T-bet knock out CD4+ T cells infected with empty recombinant retrovirus; T-bet: T-bet knock out CD4+ T cells infected with pMSCV-Tbet-IRES-Thy1.1 recombinant retrovirus; *P=0.0338 compared with Thy1.1 negative group.
在临床研究中,对T-bet的研究同样受到重视。目前,T-bet已被证明与病原体导致的炎症反应、哮喘、Ⅰ型糖尿病、克罗恩氏病以及其他一些自身免疫性疾病等均有重要联系[24]。对T-bet功能及其分子机制的研究可为相关研究提供理论指导,具有重要的意义。
在以往对T-bet的研究中,国内研究者先后构建了 T-bet的真核表达载体[25]以及腺病毒载体[26],但真核表达载体无法直接转染动物细胞,腺病毒载体包装体系较为复杂且重组效率较低,因此,构建比较简单的逆转录病毒表达载体不失为良好的解决办法。
本研究通过构建T-bet逆转录病毒载体,可以在各种可增殖细胞中表达T-bet,解决了原代细胞或其他一些特殊细胞系不易转染的问题。同时,由于T-bet的流式染色效果并不十分理想,而我们构建的载体目的基因后含有IRES-Thy1.1序列,可以在表达T-bet的同时表达报告基因 Thy1.1,通过检测细胞表面的Thy1.1表达情况即可方便地鉴定出外源性T-bet表达阳性的细胞。
此外,载体构建通常都会使用免疫印迹技术或者流式细胞术直接检测目的蛋白的方法在细胞系中进行表达验证,但这种方法有一定的缺陷。首先,载体蛋白表达可能受到细胞种类的限制。其次,抗体结合是基于所表达蛋白的特定结构域,这种验证方法只能证明表达蛋白具有可被抗体结合结构域,并无法鉴定其功能是否正常。尤其是在涉及到突变体载体构建时,可能会出现突变体只影响抗体结合结构域而并不影响特定功能的情况,反之,也可能存在突变体影响了蛋白功能但并不影响抗体结合结构域的情况。因此,在可以体现表达蛋白功能的原代细胞中对其相关功能进行检测,能更好地判断目的蛋白的表达与功能情况。本研究中,我们采用了一种新方法对构建载体表达T-bet的功能进行了鉴定,可准确显示表达的目的基因T-bet是否具有正常功能。采用本实验方法与免疫印迹法或者流式细胞术直接检测目的蛋白的方法共同验证载体,可以更好地对载体的蛋白表达情况进行确认。
综上,本实验构建了带有报告基因的 T-bet重组逆转录病毒载体,并使用两种方法验证了所构建的载体的目的基因表达情况。该载体可以方便地在各种细胞中表达小鼠T-bet,为进一步研究T-bet发挥功能的分子机制奠定了良好的实验基础。
[1]Szabo SJ, Kim ST, Costa GL, et al. A novel transcription factor, T-bet, directs Th1 lineage commitment. Cell, 2000, 100(6): 655–669.
[2]Lee DU, Avni O, Chen L, et al. A distal enhancer in the interferon-γ locus revealed by genome sequence comparison. J Biol Chem, 2004, 279(6):4802–4810.
[3]Oestreich KJ, Weinmann AS. Transcriptional mechanisms that regulate T helper 1 cell differentiation. Curr Opin Immunol, 2012, 24(2):191–195.
[4]Miller SA, Weinmann AS. Molecular mechanisms by which T-bet regulates T-helper cell commitment. Immunol Rev, 2010, 238: 233–246.
[5]Lewis MD, Miller SA, Miazgowicz MM, et al.T-bet's ability to regulate individual target genes requires the conserved T-box domain to recruit histone methyltransferase activity and a separate family member-specific transactivation domain.Mol Cell Biol, 2007, 27(24): 8510–8521.
[6]Oestreich KJ, Weinmann AS. T-bet employs diverse regulatory mechanisms to repress transcription. Trends Immunol, 2012, 33(2): 78–83.
[7]Kao C, Oestreich KJ, Paley MA, et al,Transcription factor T-bet represses expression of the inhibitory receptor PD-1 and sustains virusspecific CD8+ T cell responses during chronic infection. Nat Immunol, 2011, 12(7): 663–671.
[8]Szabo SJ, Sullivan BM, Stemmann C, et al, Distinct effects of T-bet in TH1 lineage commitment and IFN-gamma production in CD4 and CD8 T cells.Science, 2002, 295(5553): 338–342.
[9]Hwang ES, Szabo SJ, Schwartzberg PL, et al, T helper cell fate specified by kinase-mediated interaction of T-bet with GATA-3. Science, 2005,307(5708): 430–433.
[10]Lazarevic V, Chen X, Shim JH, et al. Transcription factor T-bet represses Th17 differentiation by preventing Runx1-mediated activation of the RORγt gene. Nat Immunol, 2011, 12(1): 96–104.
[11]Oestreich KJ, Huang AC, Weinmann AS. The lineage-defining factors T-bet and Bcl-6 collaborate to regulate Th1 gene expression patterns. J Exp Med, 2011, 208(5): 1001–1013.
[12]Johnston RJ, Poholek AC, DiToro D, et al. Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation.Science, 2009, 325(5943): 1006–1010.
[13]Koch MA, Glady's Tucker-Heard, Perdue NR, et al.The transcription factor T-bet controls regulatory T cell homeostasis and function during type 1 inflammation. Nat Immunol, 2009, 10(6): 595–602.
[14]Sullivan BM, Juedes A, Szabo SJ, et al.Antigen-driven effector CD8 T cell function regulated by T-bet. Proc Natl Acad Sci USA, 2003,100(26): 15818–15823.
[15]Townsend MJ, Weinmann AS, Matsuda JL, et al.T-bet regulates the terminal maturation and homeostasis of NK and Vα14i NKT cells.Immunity, 2004, 20(4): 477–494.
[16]Daussy C, Faure F, Mayo K, et al. T-bet and Eomes instruct the development of two distinct natural killer cell lineages in the liver and in the bone marrow. J Exp Med, 2014, [Epub ahead of print].
[17]Gordon SM, Chaix J, Rupp LJ, et al. The transcription factors T-bet and eomes control key checkpoints of natural killer cell maturation.Immunity, 2012, 36(1): 55–67.
[18]Sciumé G, Hirahara K, Takahashi H, et al. Distinct requirements for T-bet in gut innate lymphoid cells.J Exp Med, 2012, 209(13): 2331–2338.
[19]Powell N, Walker AW, Stolarczyk E, et al. The transcription factor T-bet regulates intestinal inflammation mediated by interleukin-7 receptor+innate lymphoid cells. Immunity, 2012, 37(4):674–684.
[20]Maloy KJ, Uhlig HH. ILC1 populations join the border patrol. Immunity, 2013, 38(4): 630–632.
[21]Rankin LC, Groom JR, Chopin M. The transcription factor T-bet is essential for the development of NKp46+innate lymphocytes via the Notch pathway. Nat Immunol, 2013, 14(4):389–395.
[22]Hoyler T, Connor CA, Kiss EA. T-bet and Gata3 in controlling type 1 and type 2 immunity mediated by innate lymphoid cells. Curr Opin Immunol, 2013,25(2): 139–147.
[23]Lazarevic V, Glimcher LH, Lord GM. T-bet: a bridge between innate and daptive immunity. Nat Rev Immunol, 2013, 13(11): 777–789.
[24]Lazarevic V, Glimcher LH. T-bet in disease. Nat Immunol, 2011, 12(7): 597–606.
[25]Tan WP, Mai YG, Huang JL, et al. Construction of murine T-bet cDNA eukaryotic expression vectors.Guangdong Med J, 2005, 26(10): 1332–1335 (in Chinese).檀卫平, 麦友刚, 黄嘉凌, 等. 小鼠T-bet基因真核表达载体的构建. 广东医学, 2005, 26(10):1332–1335.
[26]Tan WP, Huang JL, Liu RY, et al. Construction of murine T-bet cDNA recombinant Adenovirus vectors and its identification. J SUN Yet-san Univ: Med Sci,2004, 25(6): 546–548 (in Chinese).檀卫平, 黄嘉凌, 刘然义, 等. 小鼠T-bet基因重组腺病毒载体的构建. 中山大学学报:医学科学版, 2004, 25(6): 546–548.
