一种新的海洋微藻病毒丝氨酸蛋白酶基因的克隆表达及其活性分析
2014-10-27李丽华邱健健蔡艺钦于鹏刘静雯
李丽华,邱健健,蔡艺钦,于鹏,刘静雯*
(1.集美大学 食品与生物工程学院,福建 厦门361021;2.福建省高校食品微生物与酶工程技术研究中心,福建 厦门361021)
1 引言
海洋微藻类病毒广泛分布于自然海域。病毒的裂解是导致浮游植物死亡和种群数量减少的主要因素之一,并控制着浮游植物群落的多样性和丰度[1]。病毒和宿主在不断相互作用过程中,通过相互竞争并协同进化以防止自身的灭亡[2]。从阻止病毒DNA的注入到干扰病毒DNA的复制、RNA转录以及子代病毒的形成,宿主进化出了一系列的防御机制来破坏病毒的感染系统。相应地,为了实现自身的最大增殖,病毒也形成许多策略逃避宿主的防御系统,如在感染宿主后,病毒将自身基因组携带的基因或是从上个宿主细胞中获得的基因整合到宿主基因组中——即基因横向转移,这些基因表达的蛋白能够阻止宿主细胞凋亡、抑制细胞内激酶的降解、刺激细胞生长,从而为自身复制创造便利条件[1,3]。
海洋球石藻Coccolithophores是一类生活于海洋中的单细胞微型浮游植物,广泛分布在世界范围的近海和大洋水域中,尤其是亚极地较高纬度海区的优势种类,也是该海域典型的赤潮种。大量研究证实病毒感染是终止球石藻Emilianiahuxleyi赤潮的一个重要因素[4]。目前已分离到十多株海洋球石藻病毒,均为双链DNA病毒,已被确定为双链DNA病毒科中的一个新属——Coccolithovirus[5—6]。对海洋球石藻病毒(E.huxleyivirus)Eh V86基因组测序注释结果发现,该基因组包含472个编码基因,其中85%的基因被预测为编码膜蛋白,但其确切功能未知,仅有约14%的基因在数据库中具有功能归属[7]。该病毒编码的功能基因主要包括:参与细胞氧化还原反应的硫氧还蛋白(Trx)基因、构成病毒颗粒的基本组成单元的主要外壳蛋白(MCP)基因和介导鞘脂类物质代谢的鞘脂类物质合成基因(SBP)等[7]。另外一些基因编码的蛋白酶可能与病毒吸附、宿主识别、Caspase介导的凋亡途径、信号级联通路、活性氧的调控、成熟病毒组装和释放等功能紧密相关[7]。目前,在Eh V86基因组中,有5种被预测为编码丝氨酸蛋白酶的基因,分别为ehv021、ehv361、ehv447、ehv151和ehv160,其中ehv021、ehv151和ehv160被预测为胰蛋白酶超家族[7—8]。微阵列分析这些基因的转录情况表明,除了ehv361外,所有病毒编码的丝氨酸蛋白酶均在感染过程中表达[7—8]。但丝氨酸蛋白酶基因的表达与病毒感染之间的相互关联尚不清楚。
丝氨酸蛋白酶(serine proteinase,Sp)是一类以丝氨酸为活性中心的重要的蛋白水解酶,广泛存在于动物、植物、细菌、病毒、真菌中,参与生命的各种反应如蛋白质翻译后的加工、细胞分裂、病原体感染、宿主的防御、组织降解及细胞凋亡等,它们通过对蛋白酶原的激活或抑制而起调节因子作用[9]。研究发现ATP依赖的丝氨酸蛋白酶具有一个保守的生理功能,即作为分子伴侣,不仅起到水解的作用,还具有蛋白组装及蛋白复合体降解等功能[10],从而介导一系列控制热激反应、噬菌体的生命周期和细胞程序性死亡(PCD)等过程的蛋白质的降解[11—12]。有些致病性真菌在感染宿主过程中自身分泌的内源性蛋白酶包含有丝氨酸蛋白酶以破坏宿主细胞正常的生理代谢功能,同时也刺激宿主应激性地产生丝氨酸蛋白酶作为信号分子诱导宿主防御系统基因的表达,从而对抗病原菌的侵染[13]。海洋微藻类病毒与其宿主是否也存在类似的相互作用尚未见报道。目前报道的丝氨酸蛋白酶有很多,诸如参与植物器官衰老的植物丝氨酸蛋白酶[14],也有利用基因工程技术克隆表达的微生物丝氨酸蛋白酶,如稻瘟病原菌丝氨酸蛋白酶[13],以研究其结构与功能。
本研究以海洋球石藻E.huxleyi病毒Eh V99B1为研究对象。从Eh V99B1基因组中克隆Sp基因,对该基因序列进行系统的生物信息学分析,并于大肠杆菌中进行重组表达及活性分析,为进一步研究Eh V99B1-Sp在微藻病毒与宿主相互作用过程中的调节作用及其功能与应用奠定基础。
2 材料与方法
2.1 实验材料
2.1.1 海藻和病毒
实验用海洋球石藻Emilianiahuxleyi株系为Eh-BOF92;病毒株为Eh V99B1,均分离自挪威海域,由挪威卑尔根大学生物系Gunnar教授赠送。
2.1.2 菌种与试剂
TaqDNA聚合酶、T4DNA连接酶、核酸内切酶EcoR I和NotI均购自Ta Ka Ra公司产品,p MD19-T载体购自碧云天生物技术研究所,DNA凝胶回收试剂盒和质粒提取试剂盒为TIANGEN公司产品,大肠杆菌菌株Top10、E.coilBL21和p ET32a表达载体均为本实验室保存,琼脂糖为西班牙进口分装,测序由广州英骏生物技术有限公司完成,鲤鱼肌肉丝氨酸蛋白酶(MBSP)抗体由集美大学生物工程学院曹敏杰教师实验室自制,其余试剂均为进口分装或国产分析纯。
2.2 实验方法
2.2.1 引物设计
根据GenBank上报道的Eh V86病毒基因组的丝氨酸蛋白酶序列,采用GeneDoc软件和Primer Premier5.0软件设计引物。本实验所用引物为:
F∶5’-CGGAATTCATTTCAAGAGTATTGGCAGT CG-3’(划线部分为EcoR I酶切位点);R∶5’-ATTGCGGCCGCTTATTGTATGTGATTCGTT -3’(划线部分为NotI酶切位点)。
2.2.2 病毒DNA的提取
采用CTAB法提取病毒基因组DNA[15]。
2.2.3 Eh V99B1-Sp基因的PCR扩增
以提取的病毒基因组DNA为模板,在25μL反应体系中(无菌dd H2O 7.5μL,Taq预混液12.5 μL,模板3μL,引物F和R各1μL)进行PCR,反应条件为:95℃预变性3 min,95℃ 30 s,50℃ 60 s,72℃90 s,扩增30个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶检测,使用DNA凝胶回收试剂盒回收。
2.2.4 感受态细胞的制备
制备方法参照《分子克隆实验指南(第3版)》[16]。
2.2.5 Eh V99B1-Sp基因的克隆
(1)T克隆的构建
按照T载体:PCR产物=1∶5~8的比例,取回收的PCR产物4μL,T载体1μL和T4DNA ligest solutionⅠ5μL混合,于16℃连接16 h。
(2)转化感受态细胞
将10μL T克隆连接产物加入到200μL的感受态细胞中,冰浴30 min,42℃热激90 s,冰浴2 min。加入到含有800μL LB培养基(1%蛋白胨,0.5%酵母膏,1%NaCl,p H 7.0)的试管中混匀,37℃培养1 h。取未离心菌液200μL涂布含氨苄青霉素(终浓度为0.1 mg/mL)的LB固体平板(1%蛋白胨,0.5%酵母提 取 物,1%NaCl,p H 7.0,预先涂有40μL 20 mg/mL的X-gal与4μL 200 mg/mL的IPTG),同时将剩余菌液于8 000 r/min离心1 min,分别取上清、沉淀各200μL涂布平板(同上),于37℃倒置培养约12 h。
(3)重组质粒p MD19-T-Eh V99B1-Sp的筛选与鉴定
用灭菌的牙签挑取白斑,接种于含有氨苄青霉素(终浓度0.1 mg/mL)的LB液体培养基中37℃摇床上振荡培养约12 h。质粒小量抽提试剂盒提取质粒,经1%琼脂糖凝胶电泳检测确定重组质粒。重组质粒经PCR和双酶切验证,双酶切采用20μL体系:10×H buffer 2μL,0.1%BSA 2μL,EcoRI 1μL,NotI 1 μL,重组质粒14μL,37℃反应3.5 h,1%琼脂糖凝胶电泳检测;阳性克隆送至广州英骏生物技术有限公司测序。
2.2.6 Eh V99B1-Sp生物信息学分析
利用DNAStar、Blast等软件对测序结果进行分析并预测其一级结构;利用MEGA4.1分析软件建立系统进化树;然后再利用GeneDoc、Clustal X、Raswin等软件和http//www.expasy.ch/tools/protparam.html、http//espript.ibcp.fr/ESPript/ESPript/index.php、http//swissmodel.expasy.org等在线软件对其二级和三级结构进行预测,并利用Ex PASy网站的Prot Scale程序分析蛋白疏水性结构(http://us.expasy.org/cgi-bin/protscale.pl)、蛋白质跨膜结构(http://www.ch.embnet.org/soft ware/TMPRED-for m.html)及信号肽区域(http://www.cbs.dtu.dk/services/Signal P/)。
2.2.7 p ET32a-Eh V99B1-Sp重组质粒的构建
提取p MD19-T-Eh V99B1-Sp克隆质粒和表达载体p ET32a,用EcoRI及NotI分别对p MD19-TEh V99B1-Sp克隆质粒和表达载体p ET32a进行双酶切,酶切产物用DNA凝胶回收试剂盒回收,T4 DNA ligest sol ution I对回收产物进行连接(连接反应为10μL体系:回收目的基因4μL,p ET32a载体1μL,T4DNA ligest sol utionI 5μL,于16℃连接16 h);转化感受态细胞大肠杆菌Top10,提取质粒,进行PCR和酶切鉴定;阳性重组表达质粒(p ET32a-Eh V99B1-Sp)转化E.coliBL21(过程同1.2.5.2),进行菌落PCR验证(挑取固体平板上的单菌落,重悬于20μL无菌水中,100℃煮沸10 min,离心取上清;取3μL上清作为模板进行PCR扩增,反应条件为:95℃预变性3 min,95℃30 s,50℃60 s,72℃90 s,扩增30个循环,72℃延伸10 min,PCR产物经1%琼脂糖凝胶电泳检测。
2.2.8 重组菌株(BL21/p ET32a-Eh V99B1-Sp)的活性检测
将阳性重组菌(BL21/p ET32a-Eh V99B1-Sp)和实验对照菌株(BL21/p ET32a)分别接种于含有氨苄青霉素(终浓度0.1 mg/mL)的1%脱脂牛奶平板(包括1%脱脂奶粉,1%琼脂溶于蒸馏水),37℃培养24 h,观察菌落水解情况。
2.2.9 p ET32a-Eh V99B1-Sp在E.ColiBl21诱导表达
将阳性重组菌株(BL21/p ET32a-Eh V99B1-Sp)和实验对照菌株(BL21/p ET32a)分别接种于含有氨苄青霉素(终浓度0.1 mg/mL)的LB液体培养基中(包括1%蛋白胨、0.5%酵母膏、1%Na Cl,p H 7.0),37℃ 振荡培养至OD600达 到 0.7 左 右,从IPTG 浓度(0.3 mmol/L、0.5 mmol/L、0.8 mmol/L、1.0 mmol/L)、诱导温度(18℃、25℃、30℃、37℃)和诱导时间(3 h、5 h、7 h、10 h、12 h)等三方面进行表达条件优化,离心收集菌体并重悬于PBS中,超声波破碎,4℃、12 000 r/min离心,将沉淀重悬于等体积的PBS中,分别取全细胞、上清和沉淀进行SDS-PAGE。
2.2.10 重组蛋白 Eh V99B1-Sp的纯化和 Westernbloting检测
经IPTG诱导表达后的菌体经超声波破碎,4℃、15 000 r/min离心20 min,取上清过 Ni-NATagarose柱,用含250 mmol/L咪唑的洗脱缓冲液洗脱目的蛋白(参照Qiagen公司镍离子亲和层析柱操作说明),SDS-PAGE检测目的蛋白的纯度。用 Western-bloting检测目的蛋白的特异性,Western-bloting中所用的一抗为鲤鱼肌肉丝氨酸蛋白酶(MBSP),稀释比例1∶100,二抗为辣根过氧化物酶标记的兔抗鼠Ig G,稀释比例1∶200,用DAB显色。
3 结果
3.1 Eh V99B1-Sp的扩增
以Eh V99B1基因组为模板,PCR扩增获得大小约为1 110 bp的DNA片段(GenBank,登陆号:KC161207)。构建p ET32a-Eh V99B1-Sp重组表达载体并转化大肠杆菌BL21,PCR和双酶切鉴定结果如图1。
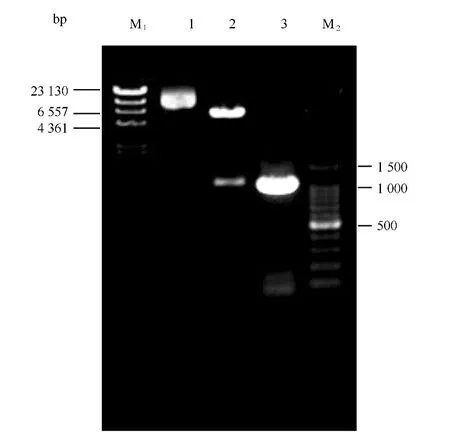
图1 Eh V99B1-Sp重组载体双酶切产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of the digest product of the p ET32a-Sp recombinant plasmid Lane
3.2 Eh V99B1-Sp基因的分子生物学特征
3.2.1 Eh V99B1-Sp的同源性比对及系统发育关系分析
多重同源性比对发现:该克隆片段与GenBank中Eh V86分离株(登陆号:NC_007346)的同源性为95%,氨基酸序列的同源性为97%,而与其他物种的Sp氨基酸序列同源性仅为28%~32%。系统发育分析结果显示,Eh V之间的Sp自成一支且与Ctenocephalidesf elis猫栉首蚤的距离最近,与其他种类从低级至高级越来越远(见图2)。
3.2.2 Eh V99B1-Sp生化特性和结构分析
用在线软件分析表明,该基因编码的蛋白质有368个氨基酸,相对分子量约为39.6 k Da,理论等电点(pI)为6.255,其包含36个碱性氨基酸,33个酸性氨基酸,115个疏水性氨基酸,128个极性氨基酸。跨膜结构分析该蛋白是一个二次跨膜蛋白,具有典型的LTAGHC(组氨酸活性位点区域)和AICNGDSGGPLF(丝氨酸活性位点区域)两个丝氨酸蛋白酶水解催化活性位点的氨基酸基序;其二级结构中包含2个α螺旋,15个β折叠(见图3a)。
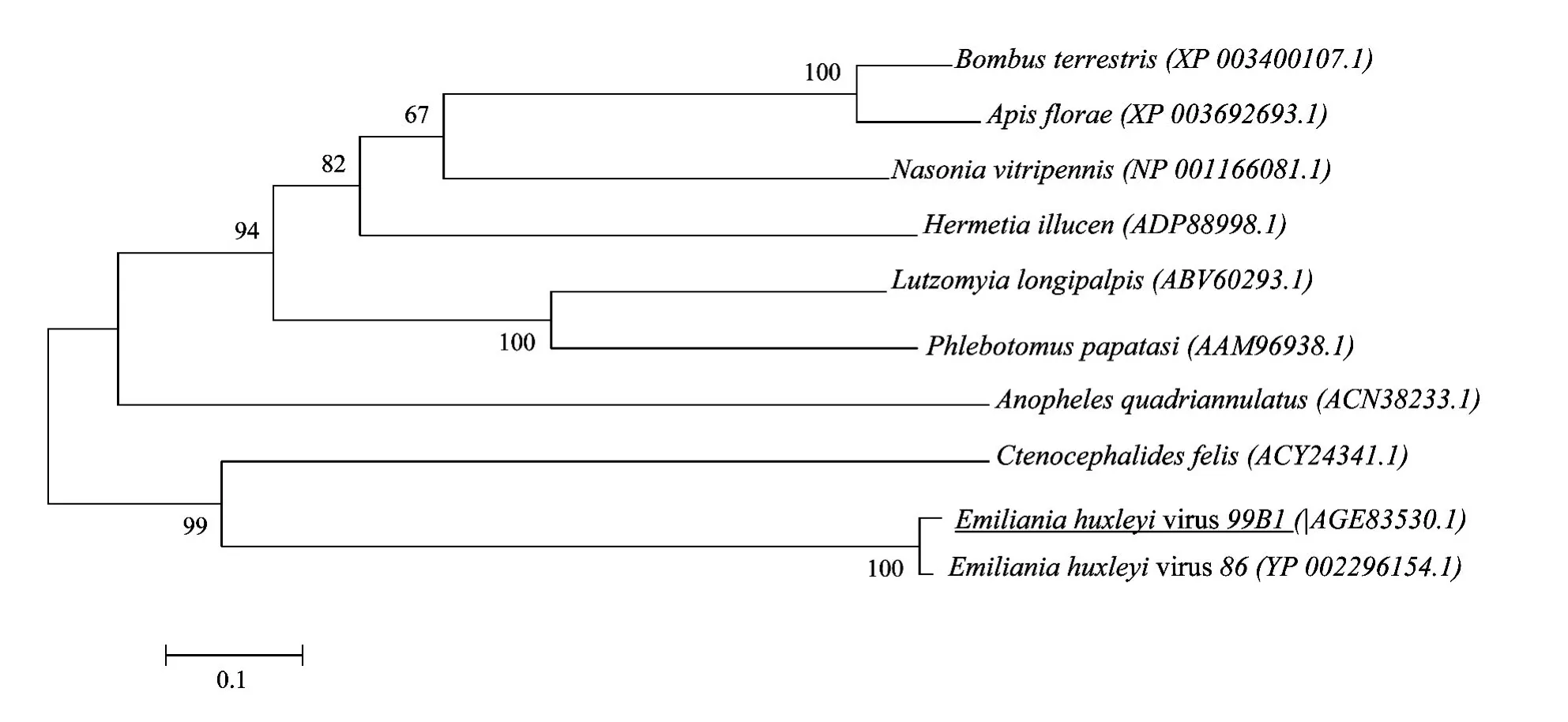
图2 基于Eh V99B1-Sp和GeneBank中其他9种物种Sp氨基酸序列构建的系统发育树Fig.2 Phylogenetic inference tree based on the amino acid sequences of Sp from different organisms in GenBank
以物种blackrat(PDB登录号:1ANE)为模板预测Eh V99B1-Sp的三级结构,两个物种的丝氨酸蛋白酶的三级结构都具有一个疏水口袋(活性部位),AICNGDSGGPLF位于该酶催化活性部位的核心位置,其周围的α螺旋和β折叠区域展开形成口袋结构,His87、Asp187和Ser245组成催化三联体结构(见图3b)。
3.3 p ET32a-Eh V99B1-Sp的活性检测
在1%脱脂牛奶平板上,对照BL21-p ET32a不形成降解牛奶的水解圈,而 BL21-p ET32a-Eh V99B1-Sp则降解牛奶形成明显的水解圈,表明其分泌的蛋白酶具有生物学活性(见图4)。
3.4 p ET32a-S p在E.coli BL21中的表达及纯化的电泳检测
p ET32a表达载体融合了Trx和His标签蛋白,标签的大小为20.5 k Da,目的基因表达的蛋白在39.5 k Da左右,融合蛋白的预计分子量约为60 k Da。通过优化诱导表达条件,最终用终浓度为0.5 mmol/L的IPTG在18℃诱导10 h获得了高效表达,可溶性蛋白占总蛋白的23.4%。经Ni-NATagarose亲和层析获得纯化的重组蛋白(见图5a)。
3.5 Western-bloting检测目的蛋白的特异性
取少量纯化蛋白和未诱导菌体蛋白(阴性对照)进行SDS-PAGE,电转移至NC膜。用鲤鱼肌肉MBSP作为一抗,HRP标记的兔抗鼠Ig G作为二抗,DAB显色后在预期大小(60 k Da)处可见清晰染色条带,分子量为60 k Da(见图5b),表明重组表达蛋白为丝氨酸蛋白酶。
4 讨论
丝氨酸蛋白酶是一类以丝氨酸为活性中心的重要的蛋白水解酶,在生物有机体中发挥着重要的生理作用,具有广泛的研究和应用价值[9]。丝氨酸蛋白酶超家族成员具有多种多样的生理功能,在机体很多致病过程以及细胞内的信号转导等方面起着重要作用。在长期的进化过程中,丝氨酸蛋白酶氨基酸序列产生了很大的差异,丝氨酸蛋白酶超家族成员的某些蛋白质序列的相似度甚至低于20%,但该蛋白质的活性结构域却极其保守,都具有一个类似于口袋状的核心催化结构域 Asp-His-Ser[17]。由于丝氨酸蛋白酶在结构上的微小变化,导致其在功能上的进化。本实验从Eh V99B1中克隆获得了Eh V99B1-Sp基因,表达产物经Western-bloting检测,显示纯化获得的蛋白为丝氨酸蛋白酶,分子量大小与预期的相符合,生物信息学分析与其他物种的Sp蛋白的同源性很低,只有28%~32%,但其蛋白结构域中也保留了LTAGHC和AICNGDSGGPLF两个非常保守的水解酶催化活性位点的氨基酸基序。说明球石藻病毒的Sp在结构与功能上与其他物种之间存在着一定的差异,可能是丝氨酸蛋白酶家族的一个新成员。


图3 Eh V99B1-Sp蛋白结构预测图Fig.3 Predictions of the structures of Eh V99B1-Sp.

图4 1%脱脂牛奶平板检测重组菌BL21-p ET32a-Eh V99B1-Sp的蛋白酶酶活Fig.4 Analysis of Eh V99B1-Sp protease activity on the 1%degreased milk plate
基因横向转移是指遗传物质从一个生物体转移到另一个不同的生物体中,或者单个细胞内部的细胞器之间进行遗传物质的交流,生物个体之间进行遗传物质的转移没有亲缘关系以及方向的界限[18]。基因横向转移现象广泛存在于噬菌体、真核病毒以及一些普通的转导粒子。大量的研究表明病毒能够利用基因横向转移影响宿主的新陈代谢、免疫能力和分布情况,最为典型的例子要属蓝藻病毒,其基因组携带有来自宿主的光合作用基因(如psbA和psbD),这些基因在强光下可诱导表达,被认为是在蓝藻病毒裂解周期中用于延长光合作用效应来维持该病毒质子泵系统的运转[19],类似的现象也在痘病毒和Mi mi病毒中被发现[20—21]。另外,研究发现海洋红细菌Rhodobacter和玫瑰杆菌Rosebacterlitor alis的普遍转导子可以作为载体将宿主基因包裹在其病毒颗粒内,通过洋流横向转移给其他生态系统的细菌,促使同一类群细菌基因组协同进化[22—23]。因此,基因横向转移现象其实质是宿主与病毒相互作用的结果。在Eh V基因组中存在7个预测编码SBP关键催化酶的基因,这些基因不存在于其他已知的病毒中,但是存在于宿主基因组中,证实SBP基因在病毒和真核生物之间进行了横向转移[24]。本研究获得的Eh V99B1-Sp基因与宿主的Sp基因同源性只有34.2%,因此,我们推测该病毒的Sp基因并非从宿主细胞直接通过基因横向转移获得,而可能是在长期进化过程中由病毒自身携带或者从其他生物逐步转移而来。
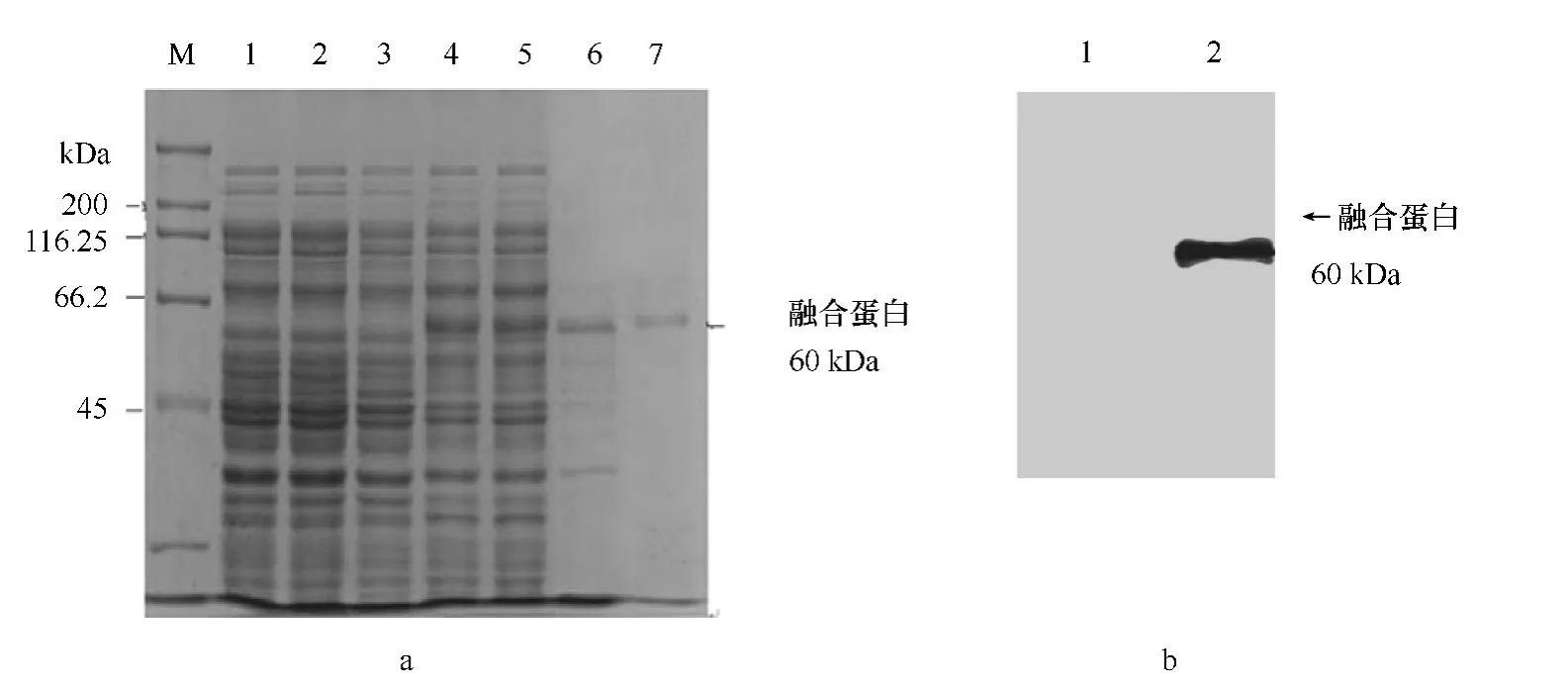
图5 p ET32a-Eh V99B1-Sp重组蛋白表达的SDS-PAGE分析及 Western-blot分析Fig.5 Analysis of p ET32a-Eh V99B1-Sp fusion protein expressed in E.coli by SDS-PAGE and Western-blot
大量的研究证实丝氨酸蛋白酶具有促进细胞凋亡的作用[12—14]。Eh V感染可以诱导宿主细胞PCD并伴随着Metacaspase的高活性表达,而且PCD被认为可能是该病毒调控其宿主死亡的重要方式[25]。丝氨酸蛋白酶不仅可以作为内切酶对肽链中部起催化作用,还具有切除靶蛋白链末端氨基酸残基的功能[10]。Eh V99B1的全基因组已经测序[26],我们对Eh V99B1中另外3种假定的蛋白酶(ehv109类似于半胱氨酸蛋白酶,ehv133ATP依赖的丝氨酸蛋白酶水解亚基,ehv349半胱氨酸蛋白酶)进行胰凝乳蛋白酶酶切位点预测,发现这3种蛋白酶中有两种蛋白酶被预测存在胰凝乳蛋白酶酶切位点,且分值大于0.5,表明这两种假定的蛋白酶可能被Eh V99B1-Sp进行特异的切割。同时,生物信息分析显示Eh V99B1-Sp是一个二次跨膜蛋白,因此,其可能作为信号通路中的一个调节因子参与Metacaspase酶原的激活,从而参与宿主细胞PCD进程。另外,系统发育分析结果显示,Eh V99B1-Sp与Ctenocephalidesf elis丝氨酸蛋白酶的同源性较高,而C.f elis丝氨酸蛋白酶可以通过蛋白酶水解切割受体蛋白,使其构象发生改变,从而介导受体的定位和激活,进而启动跨膜信号转导级联通路[25],进一步为我们的观点提供了证据。而且有趣的是,Eh V感染宿主过程中伴随着神经酰胺的合成,而蛋白酶酶原的激活与神经酰胺介导的凋亡途径紧密相关[7]。神经酰胺作为神经鞘脂类物质的主要成员之一,是机体调节各种细胞活动重要的第二信使,其在胞内的合成水平能够影响多种细胞活动,特别是细胞凋亡和生长抑制活动[27]。因此,丝氨酸蛋白酶作为迄今已知的最大的蛋白酶家族之一,在神经酰胺的合成过程中可能发挥重要的作用。
丝氨酸蛋白酶是一类重要的蛋白水解酶,人们对其结构和功能已经进行了深入的研究,并有不少种类的丝氨酸蛋白酶已应用于医药等领域。在这些研究成果的基础上人们可以通过丝氨酸蛋白酶基因的克隆、重组、表达以及蛋白互作等技术有效提高其产量,为丝氨酸蛋白酶的应用提供了新的思路。Eh V99B1-Sp在大肠杆菌中的高表达可能与下面两个因素有关:第一,低温条件下诱导能够降低蛋白的合成速度,促进蛋白质的正确折叠。第二,Eh V99B1-Sp获得可溶性表达可能是由于其N端融合了Trx标签,帮助表达蛋白形成二硫键,从而使蛋白溶解性及活性得到增强。采用革兰氏阴性大肠杆菌BL21(蛋白酶缺陷型)作为受体菌,证实克隆基因的表达产物具有明显的蛋白酶活性。我们用胰蛋白酶的特异性底物Boc-Phe-Ser-Arg-MCA 和 Boc-Leu-Lys-Arg-MCA 分 析Eh V99B1-Sp的底物特异性,结果显示 Boc-Phe-Ser-Arg-MCA和 Boc-Leu-Lys-Arg-MCA 不能被 该酶分解,表明该酶可能是不具有胰蛋白酶特性的丝氨酸蛋白酶。本研究结果为进一步探讨Eh V99B1-Sp在球石藻病毒与宿主相互作用过程中的调节作用以及该病毒Sp的功能与应用奠定了基础。
[1]Rohwer F,Thurber R V.Vir uses manipulate the marine environ ment[J].Nature,2009,459(7244):207-212.
[2]Lindell D,Jaffe J D,Coleman M L,et al.Genome-wide expression dynamics of a marine virus and host reveal features of co-evolution[J].Nature,2007,449(7158):83-86.
[3]Bidle K D,Varid A.A chemical ar ms race at sea mediates algal host-virus interactions[J].Curr Opin Microbiol,2011,14(4):449-457.
[4]Vardi A,Van Mooy B A S,Fredricks H F,et al.Viral glycosphingolipids induce lytic infection and cell deat h in marine phytoplankton[J].Science,2009,326(5954):861-865.
[5]Castberg T,Thyr haug R,Larsen A,et al.Isolation and characterization of a virus that infectsEmilianiahuxleyi(Haptophyta)[J].J Phycol,2002,38(4):767-774.
[6]Si mpson A A,Nandhagopal N,Van Etten J L,et al.Structural analyses ofPhycodnaviridaeandIridovir dae[J].Acta Crystallogr,Sect D:Biol Crystallogr,2003,59(12):2053-2059.
[7]Kegel J U,Blaxterm,Allen M J,et al.Transcriptional host-virus interaction ofEmilianiahuxleyi(Haptophyceae)and Eh V-86 deduced from combined analysis of expressed sequence tags and microarrays[J].Eur J Phycol,2010,45(1):1-12.
[8]Wilson W H,Schroeder D C,Allen M J,et al.Complete genome sequence and lytic phase transcription profile of aCoccolithovirus[J].Science,2005,309(5737):1090-1092.
[9]汪世华,王文勇,黄益洲,等.丝氨酸蛋白酶的研究进展[J].福建农业学报,2007,22(4):453-456.
[10]Suzuki C K,Rep M,Van Dijl J M,et al.ATP-dependent proteases that also chaperone protein biogenesis[J].Trends Biochem Sci,1997,22(4):118-123.
[11]Kalisz H M.Microbial proteinases[J].Adv Biochem Eng/Biotechnol,1988,36:1-65.
[12]Gottesman S,Maurizi M R.Regulation by proteolysis:energy-dependent proteases and their targets[J].Microbiol Rev,1992,56(4):592-621.
[13]Nier man W C,Pain A,Anderson M J,et al.Genomic sequence of the pathogenic and allergenic filamentous fungusAsper gillusf umigatus[J].Nature,2005,438(7071):1151-1156.
[14]崔士超,谢利娟,吴红芝.丝氨酸蛋白酶与植物器官衰老关联的研究进展[J].安微农业科学,2010,38(15):7742-7743,7745.
[15]张彦锋,刘静雯,张稚兰,等.海洋球石藻(Emilianiahuxleyi)病毒硫氧还蛋白(TRX)基因的克隆及生物信息学分析[J].海洋与湖沼,2010,41(2):293-300.
[16]Sambrook J,Russell D W.分子克隆实验指南[M].3版.黄培堂,译.北京:科学出版社,2002.
[17]季星来,孙之荣.基于结构的丝氨酸蛋白酶超家族进化分析[J].电子学报,2001,29(12 A):1756-1758.
[18]黄娟,杨维青,赵祖国.细菌生物被膜菌群间遗传物质的转移[J].中国抗生素杂志,2013,38(2):98-101.
[19]Lopez J F,Shi Y,Tyson G W,et al.Microbial community gene expression in ocean surface waters[J].Proc Natl Acad Sci USA,2008,105(10):3805-3810.
[20]La Scola B,Desnues C,Pagnier I,et al.The virophage as a unique parasite of the giant mimivirus[J].Nature,2008,455(7209):100-104.
[21]González J M,Esteban M.A poxvirus Bcl-2-like gene family involved in regulation of host immune response:sequence similarity and evolutionary history[J].Virol J,2010,7:59-70.
[22]Solioz M,Yen H C,Marris B.Release and uptake of gene transfer agent byRhodopseudomonascapsulata[J].J Bacteriol,1975,123(2):651-657.
[23]Biers E J,Wang K,Pennington C,et al.Occurrence and expression of gene transfer agent genes in marine bacterioplankton[J].Appl Environ Microbiol,2008,74(10):2933-2939.
[24]Monier A,Pagarete A,Vargas C,et al.Horizontal gene transfer of an entire metabolic pathway bet ween a eukaryotic alga and its DNA virus[J].Genome Res,2009,19(8):1441-1449.
[25]Bidle K D,Haramaty L,Ramos J B,et al.Viral activation and recruit ment of metacaspases in the unicellularcoccolithophore,Emilianiahuxleyi[J].Proc Natl Acad Sci USA,2007,104(14):6049-6054.
[26]Pagarete A,Lanzen A,Puntervoll P,et al.Genomic sequence and analysis of Eh V-99B1,a newCoccolithovir usfrom the Nor wegain Fjords[J].Intervirology,2013,56(1):60-66.
[27]Gaines P J,Sampson cm,Rushlow K E,et al.Cloning of a family of serine protease genes from the cat fleaCtenocephalidesf elis[J].Insect Mol Biol,1999,8(1):11-22.
