3种海洋硅藻不同培养阶段挥发性成分的比较分析
2014-10-27陈姣徐继林李艳周成旭严小军
陈姣,徐继林*,李艳,周成旭,严小军
(1.宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波315211)
1 引言
海洋微藻是海洋中最主要的光合生物,硅藻是海洋有机物的主要生产者之一,提供了约40%的海洋初级生产力[1],其在培养过程中的变化对海洋生态环境、海区生产力、全球碳循环等方面起着重要的作用[2—3]。研究表明,藻类代谢物直接影响着贝类对微藻的滤食速率和摄食选择性,而这些代谢物相当部分为藻类挥发性组分[4]。另外,藻类培养过程中产生的某些短链醛与其自身防御及诱导桡足类的繁殖失败密切相关[5],因此对硅藻中不同培养阶段挥发性成分的分析显得尤为重要。
挥发性物质是嗅觉感知的一类化合物组分,包括香气物质和香味物质,其特点是易挥发,含量极低,对食品挥发性风味物质的研究较多涉及茶叶、肉制品、酒类、乳制品[6—9],目前已有涉及一些如鱼肉制品等海产品风味成分研究[10—11],对一些大型藻的挥发性成分也有一些报道[5,12],也有一些对海洋微藻挥发性成分的研究报道[13],但是目前对硅藻处于不同生长阶段的挥发性成分对作为很多鱼虾贝蟹饵料化学成分的组成及生态作用的研究还未被报道过。
威氏海链藻Thal assiosir aweissf logii、小新月菱形藻Nitzschiaclosterium、角毛藻Chaetoceroscalcitrons是最常见的饵料硅藻,本文借助顶空固相微萃取-气相色谱-质谱联用技术(HS-SPME-GC/MS),对处于不用培养阶段3种硅藻挥发性成分进行测定,并利用SIMCA-P分析软件对其变化和差异进行详细分析,为实际海洋生物养殖过程中饵料微藻投喂种类、投喂时机的选择提供参考数据,并为海洋硅藻繁殖对海洋生态的影响以及对海洋硅藻的进一步开发利用提供重要参考依据。
2 材料和方法
2.1 仪器和试剂
QP2010气相色谱-质谱分析仪,带AOC-20自动进样器(日本SHIMADZU公司),vocol色谱柱(60 m×0.32 mm×0.18μm,美国Supelco公司),冷冻干燥机(美国LABCONCO公司),固相微萃取(SPME)系统和75μm DVB/CAR/PDMS萃取头(美国Supelco公司),颗粒粒度计数分析仪(德国Casy公司),试剂均为国产分析纯。
2.2 样品处理
3株海洋硅藻藻种由宁波大学海洋生物实验室藻种室提供,分别为:威氏海链藻、小新月菱形藻、角毛藻。培养海水(盐度25)经0.45μm醋酸纤维滤膜过滤后煮沸冷却,培养液采用“NML3号”配方(100 mg/L KNO3,10 mg/L KH2PO4,20 mg/L Na2Si O3,0.25 mg/L MnSO4.H2O,2.50 mg/L Fe-SO4.7 H2O,10 mg/L EDTA-Na2,6μg/L VB1,0.05 μg/L VB12)。藻种在5 000 mL锥形瓶中于日光灯光照下培养,每个样品平行培养5瓶,光照强度45~55μmol/(m2·s),光暗周期12∶12(h/h),培养温度为(20±2)℃,每两天用颗粒粒度计数分析仪[14—15]测量硅藻密度,当微藻培养到达指数生长期、平台期、衰败期时在4℃,4 000 r/min下分别对3种硅藻离心收集。分析前,藻粉冷冻干燥后置于-80℃超低温冰箱收藏。
样品预处理:称取微藻样品200 mg于15 mL SPME顶空瓶中,顶空瓶放置于30℃恒温水浴中。75 μm DVB/CAR/PDMS萃取头于气相进样口(210℃)老化30 min,用SPME装置的针头刺穿瓶盖内聚四氟乙烯密封垫,推出萃取头暴露于顶空中,固定深度3 cm,萃取40 min,20℃室温下平衡20 min,取出萃取头立即插入210℃气相色谱仪进样口,脱吸附5 min,进行GC/MS分析,所有样品结果取均值。
2.3 色谱质谱条件
GC条件:采用不分流进样模式,进样口温度210℃,载气为高纯氦气,柱流速1.99 mL/min,柱前压83.5 k Pa,柱起始温度35℃,保持3.5 min,以3℃/min升至40℃,保持1 min,再以5℃/min,升至100℃后以10℃/min升至210℃,保持25 min。
MS条件:用电子轰击(electron impact,EI)源分析,电子能量为70 e V,离子源温度200℃,接口温度210℃,选取全程离子碎片扫描(SCAN)模式,质量扫描范围为45~1 000,溶剂延迟0.6 min。
2.4 数据处理
原始数据根据GC-MS总离子流图中各组分的离子碎片质量图谱,通过对NIST库和WILEY库检索结合有关文献[16—17]进行化合物定性,用面积归一法计算出各挥发性成分的百分含量,对5个平行组的样品建立一个包含样品种类名称、每一样品的峰数量(基于保留时间和对应质荷比)和归一化后的峰面积数据库,并将此数据库导入SI MCA-P+11.5软件(瑞典Umetrics AB公司)进行主成分分析(PCA)和正交偏最小二乘法辨别分析(OPLS-DA)。
3 结果与讨论
以威氏海链藻为例,从微藻3个培养阶段藻粉样品挥发性成分GC-MS总离子流图可见(见图1),本方法能得到微藻样品丰富的挥发性成分信息,并可直观该微藻不同繁殖阶段挥发性成分的显著差异。
通过GC分析,从威氏海链藻的指数生长期、平台期、衰败期分别分离出122、92、107种物质,对分离出的组分进行MS分析,分别鉴定出84、60、65种物质,占有效峰面积的90.23%、94.86%、88.04%;小新月菱形藻在3个培养阶段分别分离出130、88、76个信号峰,分别鉴定出77、62、58种物质,占有效峰面积的88.92%、94.39%、89.93%。角毛藻在3个培养阶段分别分离出133、96、68种物质,分别鉴定出78、60、46种 物 质,占 有 效 峰 面 积 的 87.62%、93.10%、86.16%。对不同硅藻不同培养阶段进行峰面积积分,将相关数据导入SI MCA-P进行PCA分析,可得到各样品在第一主成分和第二主成分构成的平面上的投影得分图(见图2),每一标注点代表每一种硅藻的一个样品。PCA得分图可以在二维空间上显示物质聚类,从而可直观显示样品间的相似或非相似性[18]。
以威氏海链藻PCA分析为例,从其得分图可见(见图2),处于不同时期的平行组样品明显分成了3组,表明在不同培养阶段威氏海链藻的挥发性成分显著不同。为了了解哪些成分发生了显著变化,继续对其3个阶段分别进行OPLS-DA分析,从其S载荷图(见图3)中可鉴定出在指数生长期与平台期(见表1)、平台期与衰败期显著变化的物质,取权重前20种化合物(VIP值前20)进行分析讨论。利用同样的方法,小新月菱形藻和角毛藻在培养过程中变化显著的物质进行鉴定,鉴定结果见表1~表6。
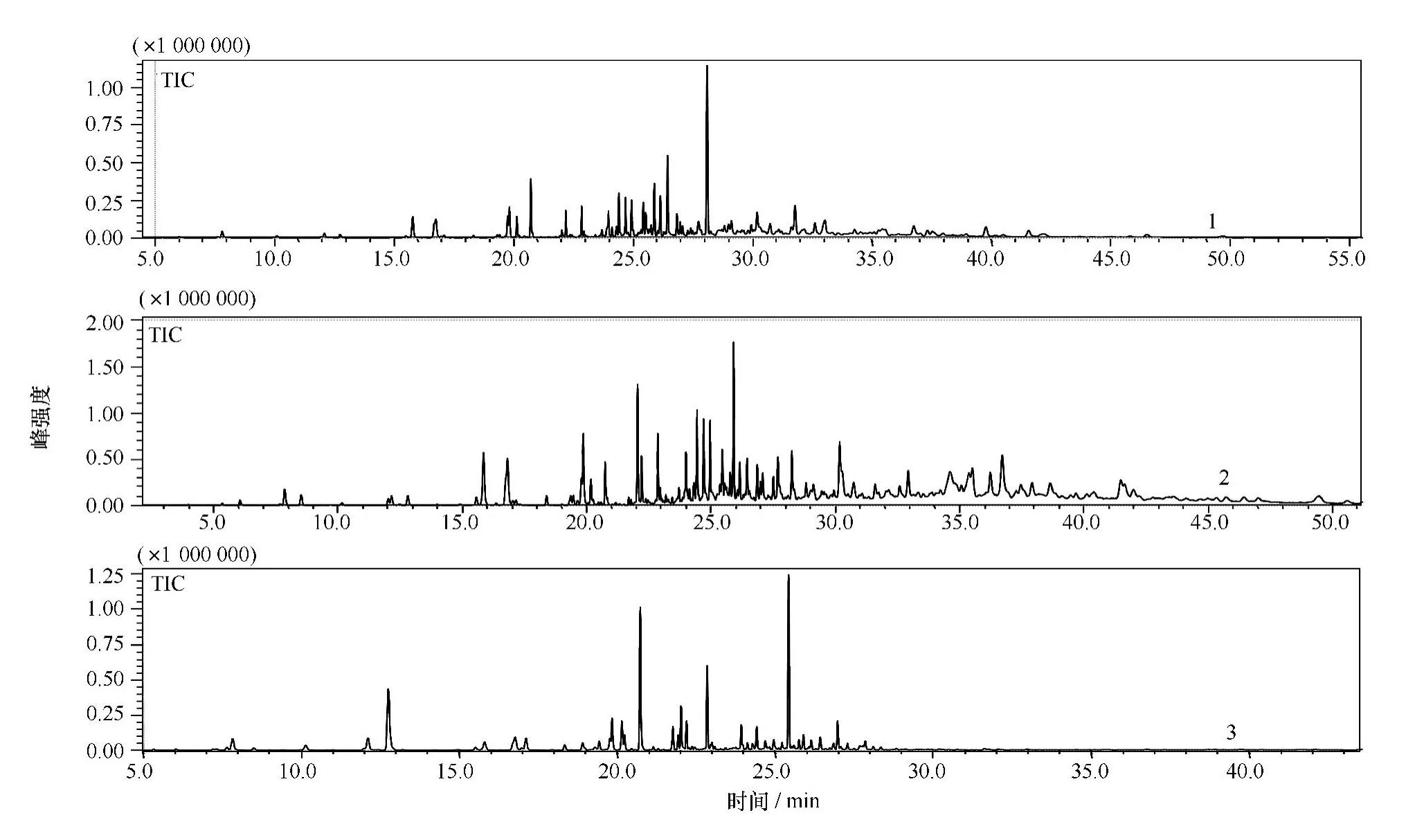
图1 威氏海链藻3个培养时期(Thalassiosira weissf logii,NMBguh021)挥发性成分的GC-MS总离子流图Fig.1 GC-MS total ion chromatogram of volatile components in Thalassiosir a weissf logii of three different growth phases
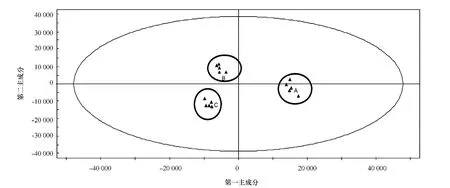
图2 处于3个不同时期的威氏海链藻挥发性成分的PCA得分图Fig.2 PCA score plot of Thalassiosir a weissf logii for the analysis of volatile components in three different growth phases

图3 指数生长期和平台期(A)、平台期和衰败期(B)威氏海链藻样品进行OPLS-DA的分析结果Fig.3 Orthogonal projection to latent structures discriminant anaylsis(OPLS-DA)to the exponential phase and stationary phase(A),stationary phase and declining phase(B)of Thalassiosira weissf logii
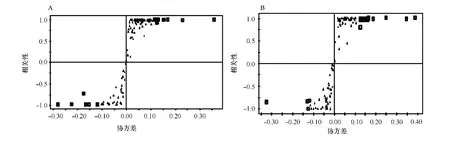
图4 指数生长期和平台期(A)、平台期和衰败期(B)威氏海链藻样品进行OPLS-DA分析对应的S载荷图Fig.4 OPLS loadings S-plot of Thalassiosira weissf logii comparing the exponential phase versus stationary phase(A),stationary phase versus declining phase(B)
3.1 硅藻培养的指数生长期至平台期挥发性成分的变化
从变化差异权重前20的挥发性物质中可以看出(见表1、2、3),威氏海链藻、小新月菱形藻、角毛藻在指数生长期与平台期相比变化较大的主要为烷烯烃类、醛类、醇类和酮类物质,表中相关性系数为正的物质表示在平台期该物质的含量增加,系数为负表示在平台期该物质的含量降低。
在变化差异权重前20的挥发性物质中,醛类物质在威氏海链藻、小新月菱形藻、角毛藻中分别占据3种、5种、4种。威氏海链藻、小新月菱形藻、角毛藻在指数生长期时,所有醛类物质占总挥发性物质百分比分别为28.95%、14.62%、10.35%(见表7),鉴定出的醛类物质分别有:23种、19种、17种;当3种硅藻培养到达平台期时,所有醛类物质占总挥发性物质百分比分别为32.33%、21.66%、29.20%,鉴定出的醛类物质分别有14种、12种、18种,醛类物质相对含量有明显增加。
饱和直链醛如己醛、庚醛、辛醛、壬醛、癸醛等通常呈现出一些令人不愉快的草味和辛辣的刺激性气味,低级饱和脂肪醛一般具有强烈的刺鼻气味,随着链长的增加其刺激性气味逐渐减弱[19],而这些饱和直链醛的感觉阈值很低(感觉阈值是评价气味常用的最重要的参数,浓度一定时,感觉阈值越低的化合物越容易被感知[20]),因此对硅藻特定风味的产生起着重要作用。有研究表明[21],壬醛对鱼肉的风味形成起着重要的作用,在3种硅藻由生长指数期进入平台期时所鉴定出的标志物中,变化最大的醛类物质均为壬醛,且均呈升高的趋势。威氏海链藻、小新月菱形藻、角毛藻中壬醛的相对百分含量分别由3.16%、1.86%、0.68% 升 高 至 9.01%、8.01%、5.48%。因此,硅藻在培养过程中感觉阈值低的醛类物质在不断升高,其整体气味会受醛类物质的影响愈来愈明显。

表1 威氏海链藻指数生长期与平台期变化差异权重前20种的挥发性物质Tab.1 Top 20 volatile components which significantly determine differences in Thalassiosira weissf logii samples bet ween exponential phase and stationary phase
不饱和醛大多有愉快的香气[22],如2-己烯醛呈现青草气味[23],而2,4-庚二烯醛被认为具有鱼腥味和金属味[24],2-辛烯醛、2-戊烯醛等不饱和醛已从有些鱼肉中检出且被认为与鱼腥味的产生有着密切的关系[3],这些是与生鲜鱼类气味相关的成分,对新鲜鱼烹饪后的气味产生重要作用,是其最终的风味化合物或风味前体。在小新月菱形藻中,2,4-庚二烯醛、2-壬烯醛在培养过程中含量明显增加,而在角毛藻中,2,4-辛二烯醛也是重要的生物标志物,由指数生长期的未被检出升高到2.09%(见表7)。在生物体内,很多醛类物质来自多不饱和脂肪酸的酶解反应[25],一些多不饱和醛类物质如2,4-辛二烯醛的产生量与十六碳三烯酸含量有很大的相关性[26],事实上,研究表明,硅藻中十六碳三烯酸在微藻中含量较高[27]。这些不饱和醛类物质在小新月菱形藻由生长对数期进入平台期时,对小新月菱形藻的风味有着重要的影响。
在变化差异权重前20的挥发性物质中,烷烯烃类物质在威氏海链藻、小新月菱形藻、角毛藻中分别占8种、7种、10种。3种硅藻在指数生长期时,烷烯烃类物质占总挥发性物质相对百分含量最高,分别为39.86%、59.58%、62.32%(见表7),鉴定出的物质种类分别有29种、31种、32种;当3种硅藻培养到达平台期时烷烯烃类物质百分含量明显减少,所占百分比分别为26.31%、37.14%、35.84%,鉴定出的物质种类分别有16种、18种、21种。可见,无论是种类还是相对含量,3种硅藻在两个时期减少最大的均为烷烯烃类物质。比如十三烷是3种硅藻中变化最大的物质,威氏海链藻、小新月菱形藻、角毛藻相对百分含量在指数生长期分别达11.60%、5.12%、9.49%,而到达平台期时,除了角毛藻含量为0.51%外,在威氏海链藻和小新月菱形藻中均未被检测到。角毛藻处于指数培养期时,挥发性烷烯烃类物质主要为一些饱和烃类C12-C17,而当培养进入平台期时,除十五烷含量略有升高之外,十二烷和十三烷都未检测到,作为标志物出现的其他长链烷烃类物质含量也均呈减少的趋势。在此时期,8-十七烯这种烯烃类物质则出现在角毛藻的挥发性成分中,在小新月菱形藻和威氏海链藻中未被检测到。
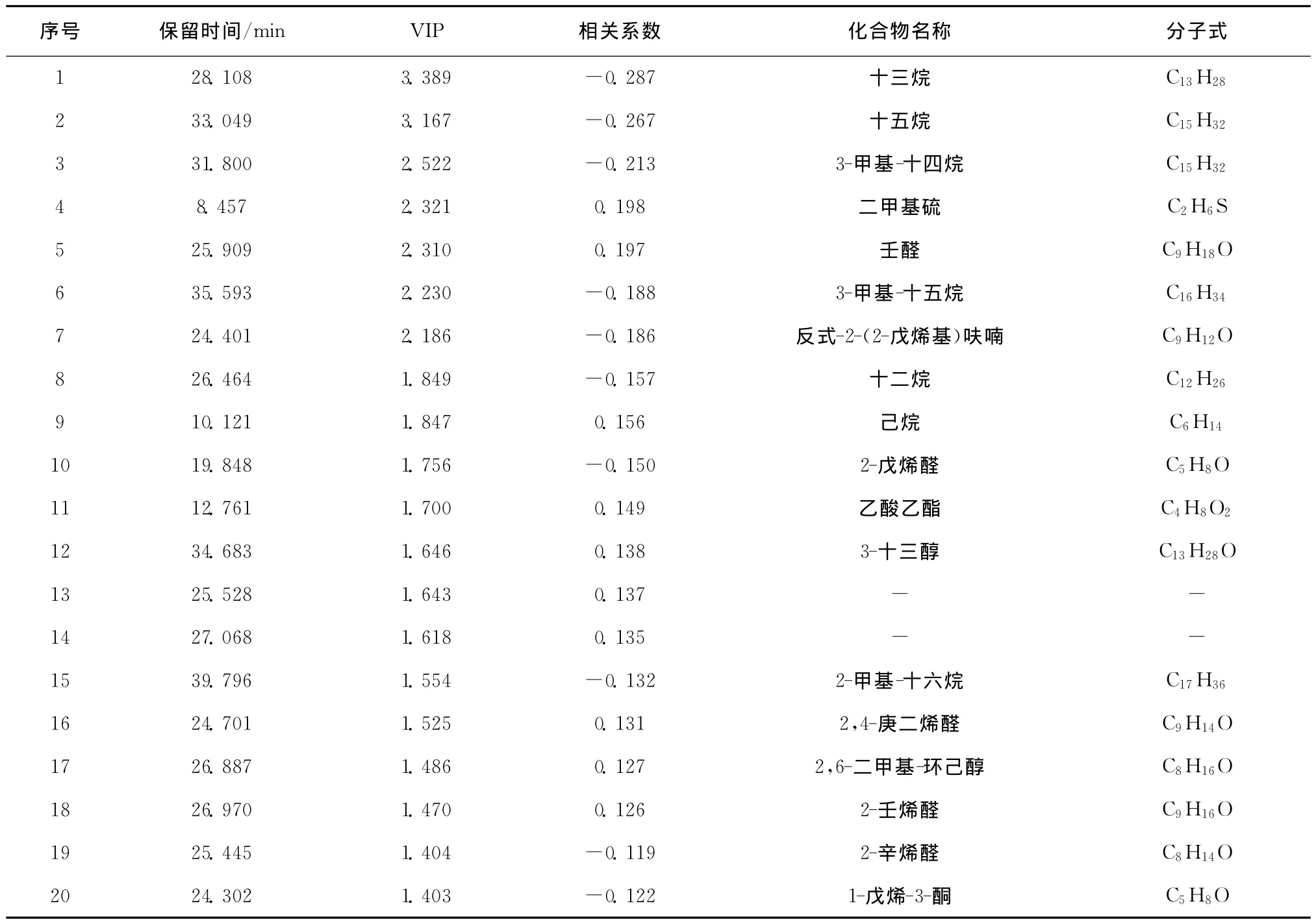
表2 小新月菱形藻指数生长期与平台期变化差异权重前20种的挥发性物质Tab.2 Top 20 volatile components which significantly determine differences in Nitzschia closterium samples bet ween exponential phase and stationary phase
与大型藻相比,海洋微藻中硅藻的挥发性烷烯烃类物质是以饱和烃类为主,虽然角毛藻在平台期检测到8-十七烯,但是饱和烃类的相对百分含量远高于烯烃类,而坛紫菜、条斑紫菜的研究中8-十七碳烯的含量分别高达65.82%、50.64%[12]。烷烯烃类主要来源于脂肪酸烷氧自由基的均裂[28],有些烷烯烃类是在一定条件下裂解之后产生腥味的潜在物质[20]。这些饱和或不饱和脂肪酸的感觉阈值较醛类高,一般对香气影响不大,所以,虽然烷烯烃类在硅藻培养的指数生长期到稳定期时变化显著,但是对硅藻整体风味影响并不如醛类物质影响大。
一般来说,挥发性醇表现出的气味品质较为柔和[29—30]。饱和脂肪醇类化合物的阀值大都较高,如果含量不高,对鱼肉的香气贡献一般较小;相对而言,不饱和脂肪醇的阀值较低,对香气贡献较大,对食物风味的形成具有一定的作用[31]。醇类物质在威氏海链藻、小新月菱形藻、角毛藻由指数生长期进入平台期时其相对百分含量分别由10.72%、4.89%、6.92%变化为9.79%、10.04%、13.49%,其中,饱和脂肪醇类 化 合 物 分 别 从 1.90%、0.63%、2.66% 变 化 为3.91%、6.45%、3.89%,而不饱和脂肪醇类化和物从8.82%、4.26%、4.26% 变 化 为 5.88%、3.59%、9.60%。在角毛藻中,1-己烯-3-醇作为生物标志物存在,该醇的气味主要为青草味[32]。当3种硅藻的生长到达平台阶段时,角毛藻醇类物质含量最高且种类最多。
在鉴定出的酮类生物标志物中,威氏海链藻和角毛藻中均有1-戊烯-3-酮的存在。烯酮类化合物一般具有青叶芳香[33],这种物质会对威氏海链藻的整体风味中芳香产生有利的影响。此外,一种含硫化合物二甲基硫的含量在小新月菱形藻培养的指数生长期(0.33%)到平台期时(6.70%)显著增加,二甲基硫是一些海产品加热后的重要风味化合物,在牡蛎肉和蛤肉中被检测到[34],它可能是由二甲基-β-胱氨酸的热分解形成,而二甲基-β-胱氨酸由浮游植物合成、通过食物链转移至其他生物体中。二甲基硫也是产生类似海滨气味的重要物质,在浓度较低时产生蟹香味[35],同时二甲基硫对于硫的海气交换作出了巨大的贡献[36]。说明在小新月菱形藻培养过程中,相对于指数生长期来说,二甲基硫对其整体风味的影响也在不断加强,而相对于威氏海链藻和角毛藻的二甲基硫含量来说,小新月菱形藻产生二甲基硫的能力更大,对硫的海气通量作出了更大的贡献。
通过对3种硅藻培养的前两个阶段研究可知,在指数生长期到平台期过程中,因一些醛类物质、醇类物质等感觉阈值较低、含量较高的物质比指数培养期更丰富,而由于醛类物质相对于其他挥发性成分来说阈值较低,因此会对摄食者的摄食行为产生更大的影响。

表3 角毛藻指数生长期与平台期变化差异权重前20种的挥发性物质Tab.3 Top 20 volatile components which significantly determine differences in Chaetoceros calcitrons samples bet ween exponential phase and stationary phase
3.2 硅藻培养的平台期至衰败期挥发性成分的变化
威氏海链藻、小新月菱形藻和角毛藻平台期与衰败期的挥发性成分相比变化最大的均除烷烯烃类、醛类、醇类之外还有带苯环的烃类化合物、乙酸乙酯等,在硅藻培养的衰败期这些对环境不利的挥发性成分含量均有增加的趋势。
在变化差异权重前20的挥发性物质中,威氏海链藻和小新月菱形藻在两个培养阶段挥发性成分变化种类最多的为醛类物质(见表4、5),分别有7种和6种。威氏海链藻和小新月菱形藻中,所有醛类物质占总挥发性成分的相对百分含量由平台期的32.33%、21.66%升高至46.80%、38.14%,其中2,4-戊二烯醛和2-辛烯醛这两种不饱和醛在威氏海链藻和小新月菱形藻衰败期取代壬醛成为含量最高的醛类物质,威氏海链藻中分别高达12.18%、10.20%,小新月菱形藻中分别达到9.10%和8.58%。有研究证明,不饱和醛类物质含量过高会对桡足类的饲养产生不利的影响[11],因此,相比较前两个阶段,处于衰败期的威氏海链藻和小新月菱形藻因不饱和醛类过高并不适合桡足类的饵料。此外值得注意的是,在平台期相对百分含量显著的壬醛,威氏海链藻中由9.01%下降到1.29%,小新月菱形藻中却从8.01%下降到2.01%。
其他挥发性物质中,小新月菱形藻和角毛藻中1-戊烯-3-醇在衰败期的相对百分含量也有明显降低,从而对这两种藻的整体风味产生一定不利的影响[28]。此外,到衰败期,小新月菱形藻中二甲基硫含量继续升高(见表5),而角毛藻中二甲基硫的含量几乎没有变化,说明各种硅藻产生二甲基硫的能力和变化并非一致。

表4 威氏海链藻指数平台期与衰败期变化差异权重前20种的挥发性物质Tab.4 Top 20 volatile components which significantly determine differences in Thalassiosira weissf logii samples bet ween stationary phas and declining phase

表5 小新月菱形藻指数平台期与衰败期变化差异权重前20种的挥发性物质Tab.5 Top 20 volatile components which significantly determine differences in Nitzschia closterium samples between stationary phas and declining phase
与威氏海链藻和小新月菱形藻不同的是,角毛藻在进入衰败期时,醛类物质的含量并没有呈现升高的趋势,壬醛仍然是含量最高的醛类物质,但醛类物质的总含量仅为13.06%。在此时期,角毛藻的风味受其他物质的影响更为明显,其中在衰败期挥发性成分变化较大的主要是酯类、烷烯烃类和一些苯环类化合物(表6)。在变化差异权重前20的挥发性物质中,酯类物质占了2种,分别为2-甲基-2-丙酸甲酯和乙酸乙酯,且这两类酯在衰败期时含量很高。烷烯烃类物质占了8种,随着角毛藻的培养进入衰败阶段,烷烯烃类物质的含量在不断地降低。特别要注意的是,3种硅藻在衰败期乙酸乙酯含量都有显著升高,角毛藻中2-甲基-2-丙酸甲酯的相对百分含量更是高达11.16%。酯是由醇和酸在微生物作用下酯化而成[37],所以3种硅藻在衰败期时由于微生物的大量滋长,对硅藻的风味特性会产生较大的影响。
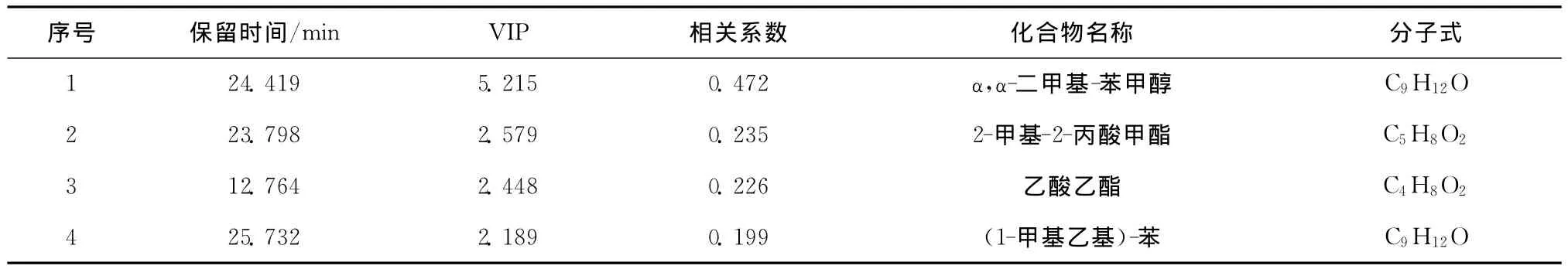
表6 角毛藻指数平台期与衰败期变化差异权重前20种的挥发性物质Tab.6 Top 20 volatile components which significantly determine differences in Chaetoceros calcitrons samples bet ween stationary phas and declining phase
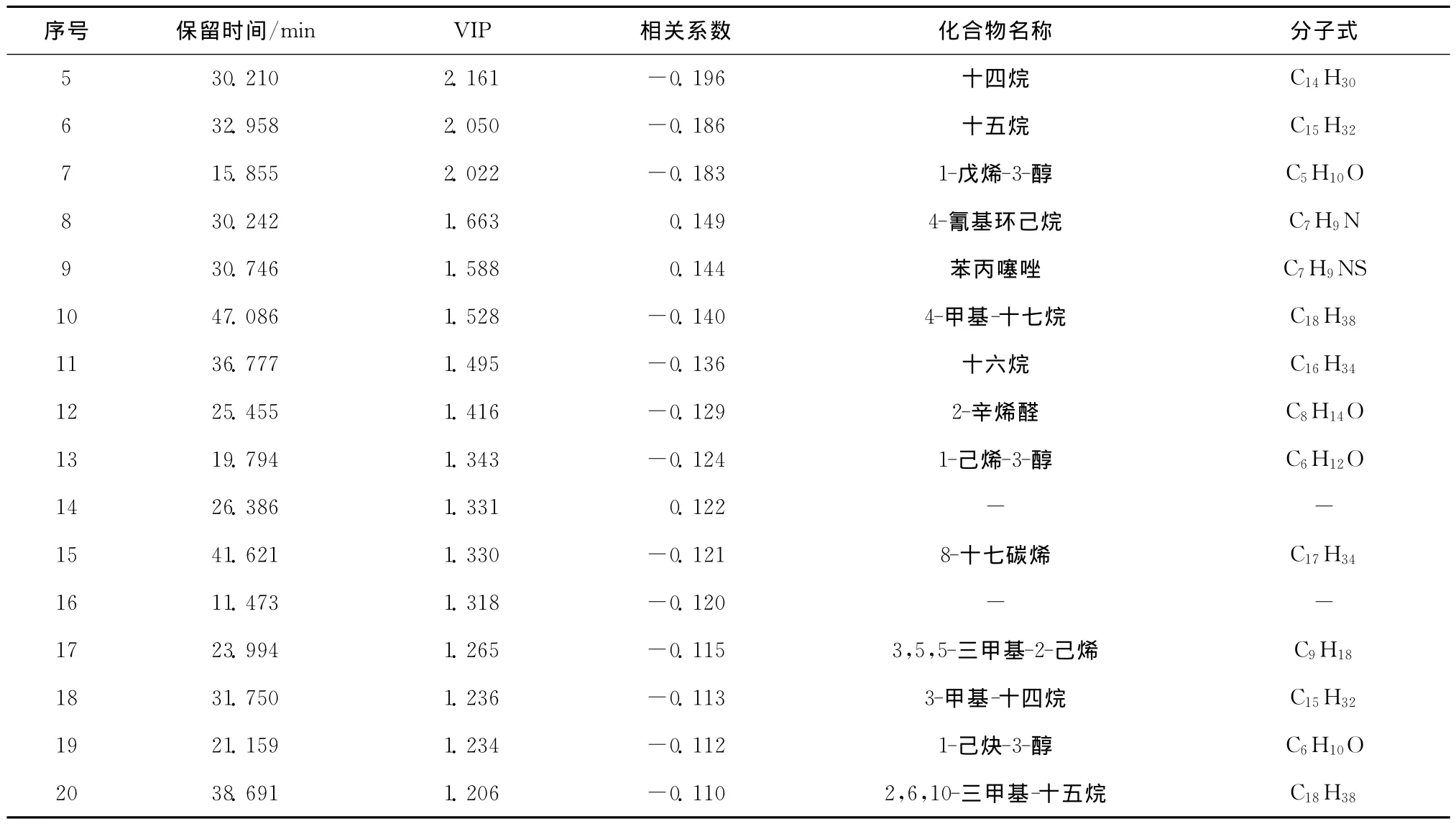
续表6
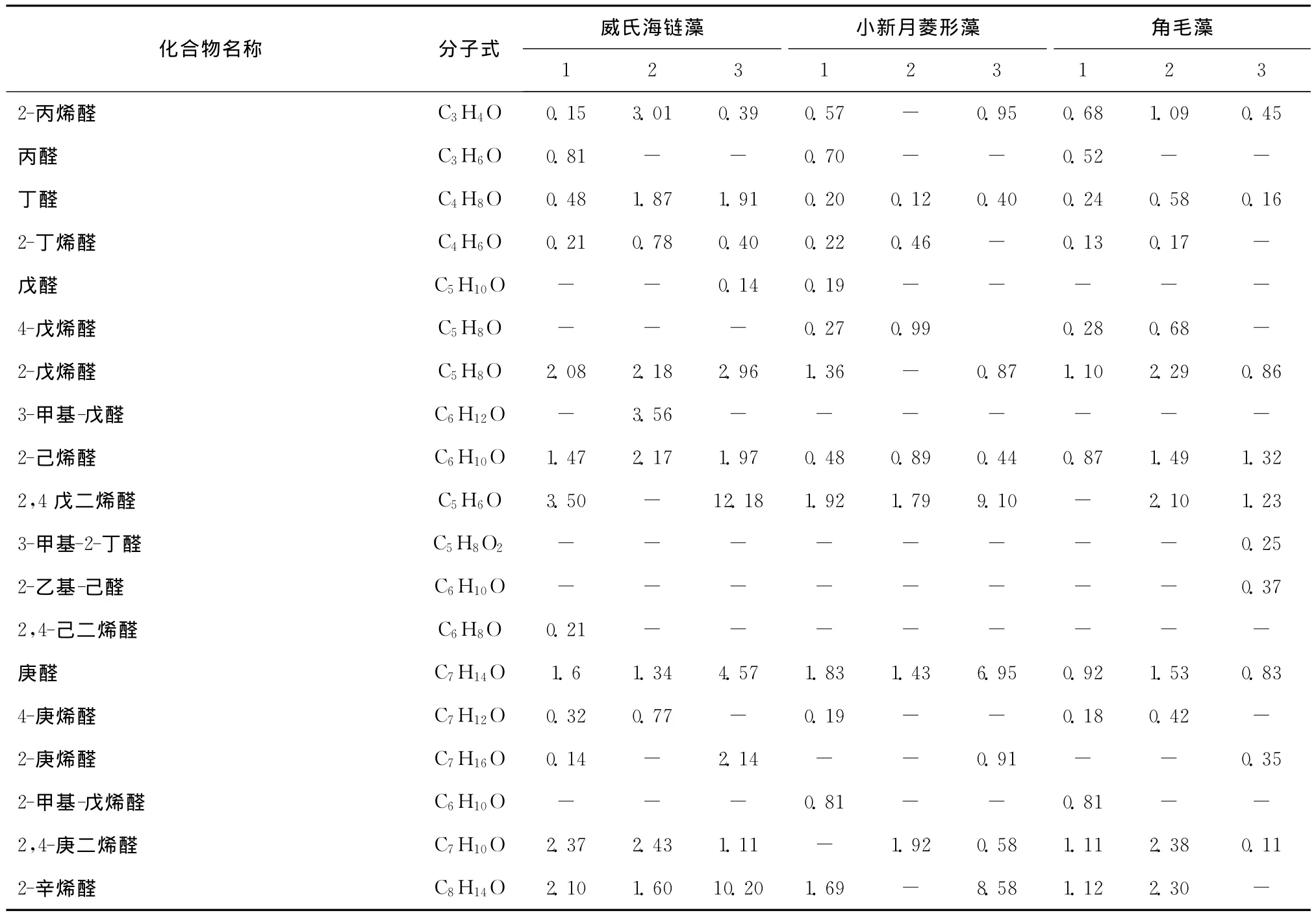
表7 小新月菱形藻、威氏海链藻、角毛藻不同培养阶段挥发性成分的鉴定结果Tab.7 The volatile components of Nitzschia closterium,Thalassiosir a weissf logii and Chaeteros calcitrons samples in different phases

续表7
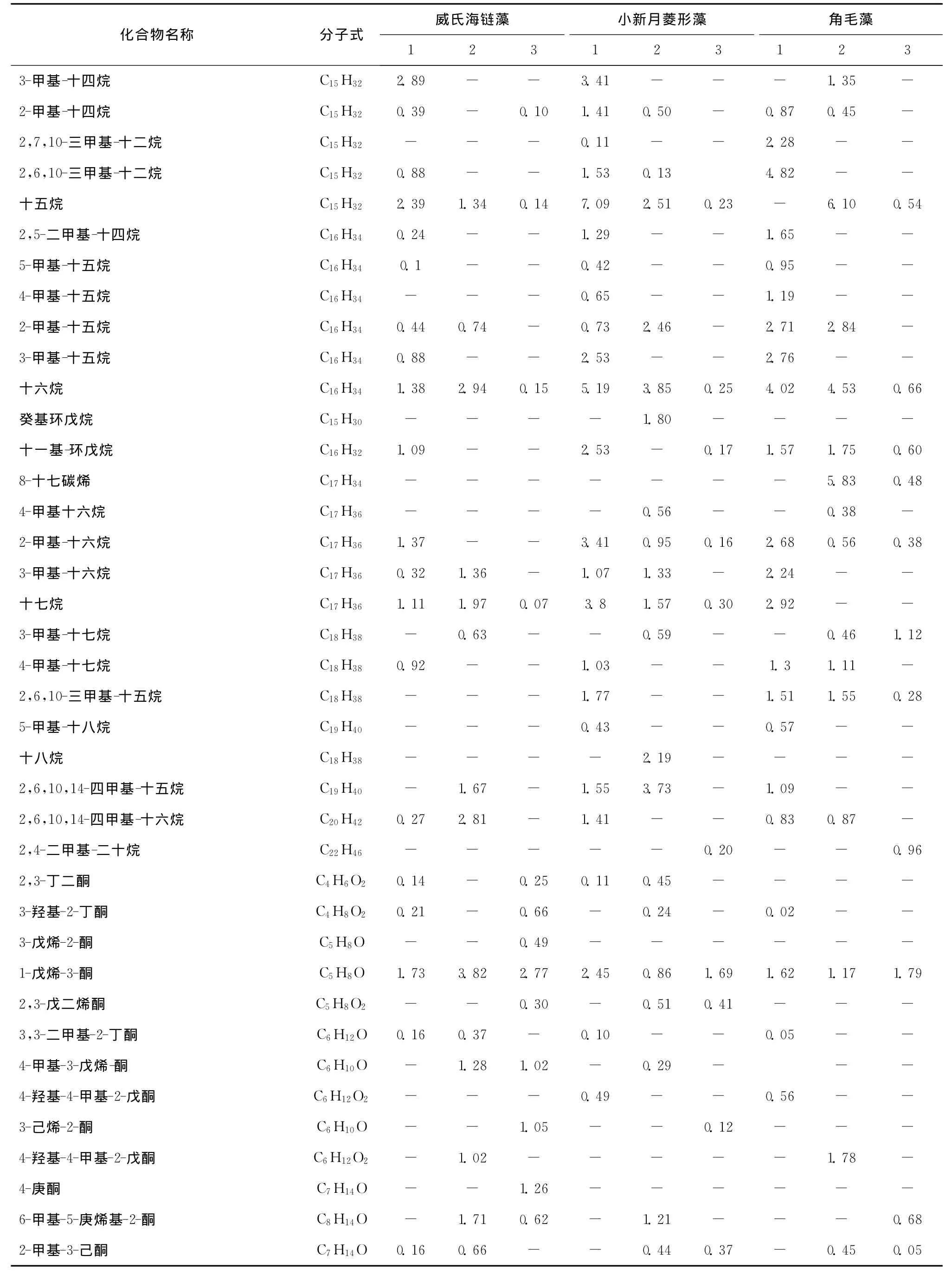
续表7

续表7
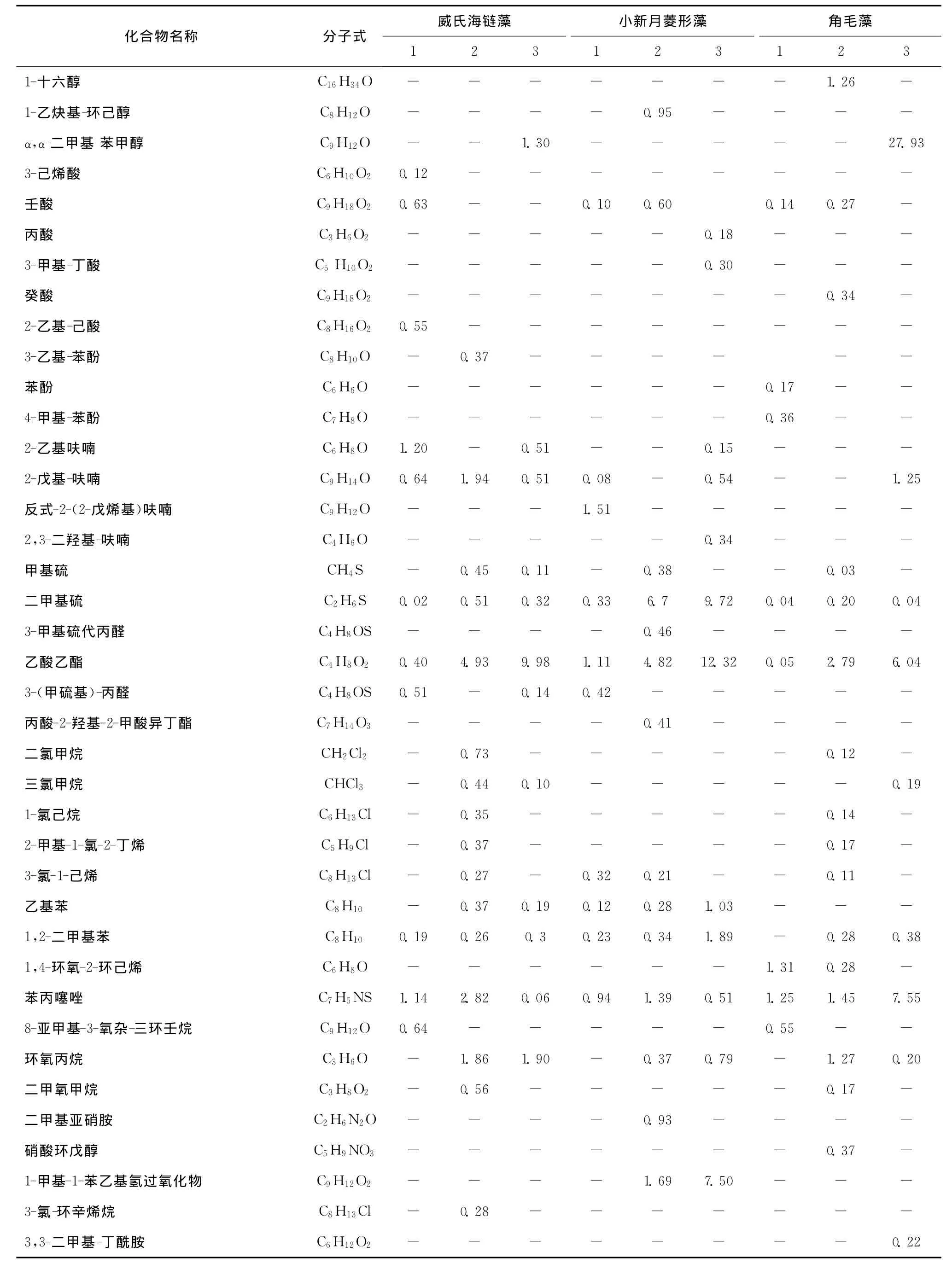
续表7

续表7
[1]Field C B,Behrenfeld M J,Randerson J T,et al.Primary Production of the Biosphere:Integrating terrestrial and oceanic components[J].Science,1998,281(5374):237-240.
[2]Sacchetti G,Maietti S,Muzzoli M,et al.Comparative evaluation of 11 essential oils of different origin as functional antioxidants,antiradicals and antimicrobials in foods[J].Food Chemistry,2005,91(4):621-632.
[3]Laturnus F,Wiencke C,Klöser H.Antarcticmacroalgae-sources of volatile halogenated organic compounds[J].Marine Environ mental Research,1996,41(2):169-181.
[4]Ward J E,Targett N M.Influence of marine microalgal metabolites on the feeding behavior of the blue musselMytil usedulis[J].Marine Biology,1989,101(3):313-321.
[5]Bouarab K,Adas F,Gaquerel E,et al.The innate immunity of a marine red alga involves oxylipins from both the eicosanoid and octadecanoid pathways[J].Plant Physiology,2004,135(3):1838-1848.
[6]赵龙飞,徐亚军,周红杰.微生物固态发酵提高普洱茶品质风味的研究[J].食品研究与开发,2006,27(4):155-156.
[7]谷向春,肖东光,邹静,等.气相色谱外标法测定荔枝酒中的风味物质[J].酿酒科技,2006(11):99-100,103.
[8]袁华根,高峰,徐骏,等.鸡肉挥发性风味化合物分析[J].江西农业学报,2006,18(5):139-141.
[9]李锋,华欲飞.大豆酸奶的风味物质研究[J].中国乳品工业,2004,32(12):19-22.
[10]江健,王锡昌,陈西瑶.顶空固相微萃取与GC-MS联用法分析淡水鱼肉气味成分[J].现代食品科技,2006,22(2):219-222.
[11]伊纪峰,朱建一,韩晓磊,等.HS-SPME-GC/MS联用检测红毛菜中的挥发性成分[J].南京师大学报(自然科学版),2009,32(2):103-107.
[12]王秀娟,徐继林,严小军.2种海藻中半挥发性物质的成分分析[J].海洋科学,2010,34(1):25-28.
[13]Van Dur me J,Goiris K,De Winne A,et al.Evaluation of the volatile composition and sensory properties of five species of microalgae[J].Journal of Agriculture and Food chemistry,2013,61(46):10881-10890.
[14]茅华,许海,刘兆普.温度、光照、盐度及p H对旋链角毛藻生长的影响[J].生态科学,2007,26(5):432-436.
[15]Su Xiaoling,Xu Jilin,Yan Xiaojun,et al.Lipidomic changes during different growth stages of Nitzschia closteriu m f.Minutissi ma[J].Metabolomics,2013,9(2):300-310.
[16]汪秋安.海藻等水产品的香气成分分析[J].海洋科学,1997(2):26-29.
[17]吴薇,陶宁萍,顾赛麒.鱼肉特征性气味物质研究进展[J].食品科学,2013,34(11):381-385.
[18]Van Vliet E,Morath S,Eskes C,et al.A novelinvitrometabolomics approach for neurotoxicity testing,proof of principle for methyl mercury chloride and caffeine[J].Neuro Toxicology,2008,29(1):1-12.
[19]Jiye A,Trygg J,Gullberg J,et al.Extraction and GC/MS analysis of the human blood plasma metabolome[J].Analytical Chemistry,2005,77(24):8086-8094.
[20]谢笔钧.食品化学[M].3版.北京:科学出版社,2011:120-132.
[21]王怡娟,娄永江,陈梨柯.养殖美国红鱼鱼肉中挥发性成分的研究[J].水产学报,2009,28(6):303-307.
[22]Ianora A,Miralto A,Poulet S A,et al.Aldehyde suppression of copepod recruit ment in blooms of a ubiquitous planktonic diatom[J].Nature,2004,429(6990):403-407.
[23]Jónsdóttir R,Ólafsdóttir G,Chaine E,et al.Volatile compounds suitable for rapid detection as quality indicators of cold smoked sal mon(Sal mosalar)[J].Food Chemistry,2008,109(1):184-195.
[24]Varlet V,Knockaert C,Prost C,et al.Comparison of odor-active volatile compounds of fresh and smoked sal mon[J].Journal of Agricultural and Food Chemistry,2006,54(9):3391-3401.
[25]Kawai T,Sakaguchi M.Fish flavor[J].Critical Reviews in Food Science and Nutrition,1996,36(3):257-298.
[26]Morita K,Kubota K,Aishima T.Comparison of aroma characteristics of 16 fish species by sensory evaluation and gas chromatographic analysis[J].Journal of the Science of Food and Agriculture,2003,83(4):289-297.
[27]徐继林,严小军.脂类分析在海洋微藻化学分类学上的研究进展[J].海洋通报,2004,23(2):65-72.
[28]Dru mm T D,Spanier A M.Changes in the content of lipid autoxidation and sulf ur-containing compounds in cooked beef during storage[J].Journal of Agriculture and Food Chemistry,1991,39(2):336-343.
[29]章超桦,平野敏行,铃木健,等.鲫的挥发性成分[J].水产学报,2000,24(4):354-358.
[30]何雄,薛长湖,杨文鸽,等.罗非鱼鳃组织中脂肪氧合酶的性质研究[J].水产科学,2005,24(7):15-19.
[31]Refsgaard H H,Haahr A M,Jensen B.Isolation and quantification of volatiles in fish by dynamic headspace sampling and mass spectrometry[J].Journal of Agricultural and Food Chemistry,1997,47:1114-1118.
[32]Josephson D B,Lindsay R C,Stuiber D A.Identification of compounds characterizing the aroma of fresh whitefish(Coregonuscl upeafor mis)[J].Journal of Agricultural and Food Chemistry,1983,31(2):326-330.
[33]宋钢.调味技术概论[M].北京:化学工业出版社,2009:167-175.
[34]Frank D,Poole S,Kirchhoff S,et al.Investigation of sensory and volatile characteristics of far med and wild barramundi(Latescalcarif er)using gas chromatography-olfactometry mass spectrometry and descriptive sensory analysis[J].Journal of Agricultural and Food Chemistry,2009,57(21):10302-10312.
[35]Alasalvar C,Taylor K D A,Shahidi F.Comparison of volatiles of cultured and wild sea bream (Sparusaurata)during storage in ice by dynamic headspace analysis/gas chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry,2005,53(7):2616-2622.
[36]周成旭,徐继林,严小军,等.海洋微藻培养液中二甲基硫与二甲基硫丙酸的同步分析[J].分析化学,2009,32(9):1308-1312.
[37]夏延斌.食品风味化学[M].北京:化学工业出版社,2008:195-198.
