CT引导下脊髓射频热凝术治疗脊髓损伤性神经病理性疼痛
2014-10-25倪家骧
王 琦 倪家骧
(首都医科大学宣武医院疼痛科,北京100053)
流行病学研究[1]表明,脊髓损伤(spinal cord injury,SCI)的发病率约为每百万人25例。至少80%的SCI患者存在慢性疼痛,其中1/3为重度疼痛。
神经病理性疼痛(neuropathic pain,NP)是SCI慢性疼痛的重要组成部分。SCI是NP最常见的病因之一,SCI继发性NP的发病率为40% ~50%[2]。
对于口服镇痛药物无效或不良反应无法耐受,以及既往手术治疗无效的完全性SCI继发性NP患者,笔者采用CT引导下脊髓射频热凝术(spinal cord radiofrequency thermocoagulation,SCRT),取得了一定疗效。SCRT是针对特定患者而设计的手术治疗方案,中西文文献检索未见类似报道,现介绍如下。
1 资料和方法
1.1 病例资料
纳入标准:完全性下胸段(T8以下平面)或腰段SCI,下肢运动、感觉及括约肌功能均已完全丧失;经病史采集、体格检查及 DN4量表[3]测定,证实存在NP;NP病史超过3个月;既往曾接受多种药物镇痛治疗,无效或不良反应不能耐受。
排除标准:T8以上平面SCI;下肢运动、感觉和括约肌功能部分保留的不完全性SCI;不伴有NP的SCI疼痛;不适合手术或不适合进行X线引导的其他情况。
根据以上标准,在2005年5月至2012年8月时间段内纳入完全性SCI继发性NP患者43例,其中男性患者26例(60.5%),女性患者17例(39.5%);患者年龄28~71岁,平均年龄(48.6±12.6)岁。
患者均为外伤性SCI:损伤平面为下胸段或腰段(T10-L3),其中30例为下位胸髓SCI(9例为T10,13例为T11,8例为T12),13例为腰髓SCI(8例为L1,3例为L2,2例为L3)。
患者 SCI病程为1~33年,平均病程(12.8±7.9)年,SCI继发性NP病程为0.4~32年,平均病程(10.5±8.4)年;从发生SCI到出现NP的时间为0~12年,平均(2.4±3.1)年。
患者均为双侧疼痛,其中8例(18.6%)患者主诉右侧疼痛较左侧为重,其余35例(81.4%)患者主诉双侧疼痛差异无统计学意义。
患者均曾接受椎体(腰椎/胸椎)内固定手术;12例患者曾接受椎管切开减压术,7例患者曾接受脊神经根切断术,5例患者曾接受脊髓电刺激镇痛术,3例患者曾接受颅骨钻孔皮质毁损术。
1.2 手术方法
1)术前准备:通过体格检查确定入组患者感觉减退/消失部位及相对应的脊髓平面,将感觉减退/消失平面头侧两个节段作为毁损脊髓平面。
2)术中定位:CT平扫定位相,根据脊柱序列确定毁损平面的准确位置,然后进行1 mm层厚的CT断层扫描(图1),以确定最佳穿刺路径。
“最佳穿刺路径”的选择标准是:①尽可能利用棘突间隙和椎板间隙进行穿刺,穿刺路径上尽可能避开椎板等骨性结构;②部分患者因为椎体内固定器、严重骨质增生等原因,毁损脊髓平面上椎板间隙消失,则通过CT断层扫描确定椎板骨质最薄弱的层面;③进针点、进针角度和深度的选择原则是确保穿刺针能够经脊髓背角到达脊髓前角。

图1 CT平扫定位相Fig.1 Topogram of plain CT scan localization
3)术中操作:患者取侧卧位,持续缓慢静滴乳酸林格液。穿刺前常规单次入壶氟哌利多5 mg及盐酸丁丙诺啡0.3 mg。按照CT扫描确定的最佳路径(穿刺平面、穿刺点、穿刺角度和深度)进行穿刺。采用长度6 cm的
14G穿刺套管穿刺进入硬膜外腔后,向脊髓内刺入长度为10 cm的9G射频针(PMF 20-100-5,Baylis Medical Company Inc),穿刺进入脊髓背角后继续进针,直至穿刺针进入脊髓前角。在穿刺过程中,如果需要,随时进行CT扫描确认穿刺针位置并引导穿刺。9例(20.9%)患者拟毁损脊髓平面上椎板间隙消失,则按照CT扫描确定的最佳穿刺路径(椎板骨质最薄弱的层面),采用长度为6 cm的14G穿刺套管进针抵至椎板,用自动保护骨钻(PY-GZ-1,天津鹏志医疗设备厂)进行椎板钻孔(图2),然后经穿刺套管向脊髓内刺入射频针。

图2 椎板钻孔Fig.2 Drilling on the vertebral lamina
CT扫描确认射频针的最终位置满意(图3),然后给予丙泊酚持续微量静脉泵注及盐酸丁丙诺非0.3 mg入壶,并进行SCRT。
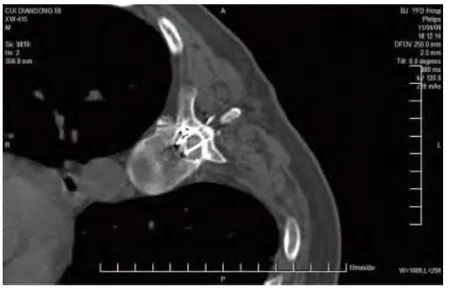
图3 最终的射频针位置Fig.3 Final position of the radiofrequency needle
4)SCRT方案:采用Baylis射频仪(Model:PMG-230-TD,Baylis Medical Company Inc),热凝温度设定为85℃;从脊髓前角开始进行热凝,每个毁损点完成一个周期后(120 s×2次)退针约3 mm,继续进行热凝,直至射频针退出脊髓背角。
1.3 疗效评价
1)视觉模拟评分(visual analogue scale,VAS):分别采集患者入院时、手术后、手术后3、6、12、24和36个月的VAS值,并进行加权处理得到 VAS加权值(VAS weighted value,VAS-WV)。
VAS-WV=(A-B)/A;A=入院VAS,B=随访VAS。
根据VAS-WV将疗效分为“治愈”“有效”和“无效”3种;认为VAS-WV≥75%为“治愈”,25%≤VASWV<75%为“有效”,VAS-WV<25%为“无效”。
2)简式McGill疼痛评分表(short from-McGill pain questionnaire,SF-MPQ):在患者入院和出院时分别进行SF-MPQ评分,并选择疼痛分级指数(pain rating index,PRI)总分(PRI-T)及现有疼痛强度(present pain intensity,PPI)作为评价指标。
1.4 统计学方法
采用PASW Statistics18.0软件对手术前后和随访期内的疗效评价指标(VAS,SF-MPQ)进行配对样本T检验(Paired-sample T Test)。
2 结果
2.1 镇痛效果评价
1)43例患者全部完成了术后VAS及SF-MPQ评分:VAS-WV显示,37例(86.0%)患者疗效评价为“治愈”,5例(11.7%)患者为“有效”,1例(2.3%)患者为“无效”。
患者术前及术后VAS、PRI-T及PPI比较,差异具有统计学意义(P<0.01),详见表1。
表1 患者术前及出院时疼痛评价指标的比较Tab.1 Comparison of the patients'preoperative and postoperative pain evaluation indexes (±s)
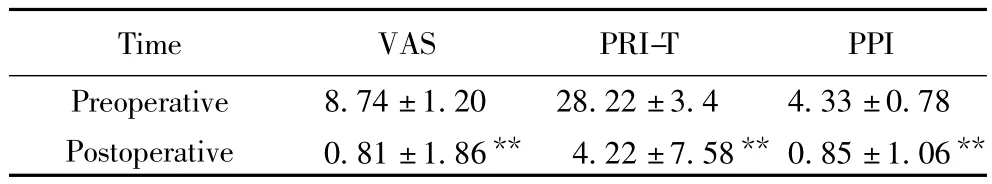
表1 患者术前及出院时疼痛评价指标的比较Tab.1 Comparison of the patients'preoperative and postoperative pain evaluation indexes (±s)
** P<0.01 vs preoperative;VAS:visual analogue scale;PRI-T:total pain rating index;PPI:present pain intensity.
Time VAS PRI-T PPI Preoperative 8.74±1.20 28.22±3.4 4.33±0.78 Postoperative 0.81±1.86** 4.22±7.58** 0.85±1.06**
2)术后不同随访期内的疗效评价:分别于术后3、6、12、24和36个月对纳入的病例进行门诊或电话随访;1例患者于术后6个月至36个月失随访;2例患者于术后24个月至36个月失随访。剔除失随访和未到随访期病例后,术后3、6、12、24和36个月的实际随访病例数分别为43例、40例、35例、28例和21例;各随访期的疼痛缓解率(治愈率+有效率)分别为97.7%、97.5%、94.3%、92.9%和90.5%;各随访期的无效率分别为2.3%、2.5%、5.7%、7.1%和9.5%,详见表2。
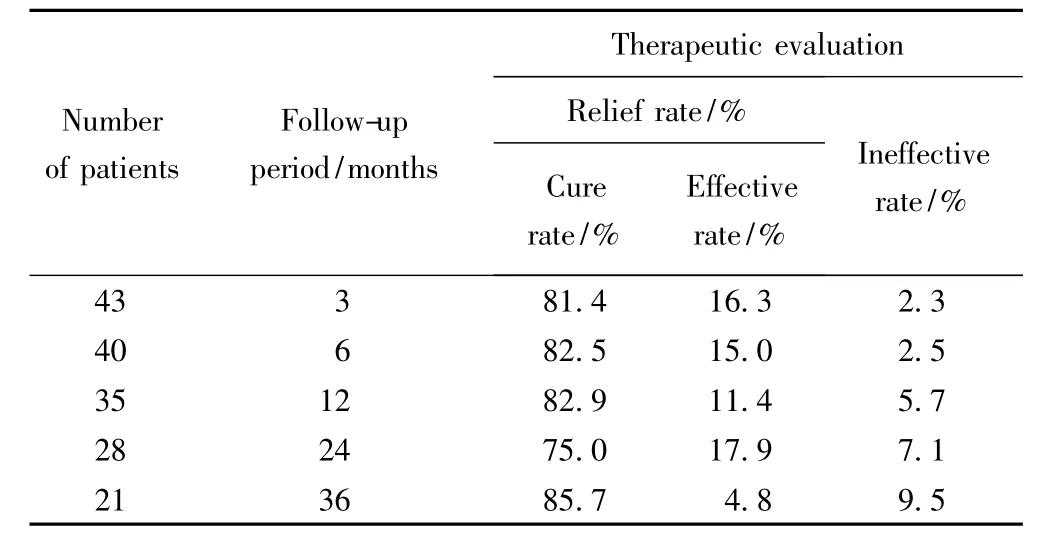
表2 不同随访期内患者人数和疗效评价Tab.2 Number of patients at different periods of follow-up and the associated therapeutic evaluation
2.2 合并症
患者术后均出现感觉消失平面上移;但因为纳入标准为完全性下胸段/腰段SCI,未出现下肢感觉、运动和括约肌功能的进一步破坏。
8例(18.6%)患者出现硬膜刺破后头痛,经静脉补液治疗后,均于3日内完全缓解;5例(11.6%)出现轻度腹痛,未予特殊处理,7日内完全缓解;所有患者出院时均未残留头痛或腹痛症状;随访期内未见手术相关合并症报告。
3 讨论
SCRT是对毁损平面上脊髓神经结构进行的范围广泛而彻底的毁损,因此,其适应证存在局限:1)SCRT不适用于下肢运动、感觉或括约肌仍存在功能的不完全性SCI患者,因为手术会对患者残留的运动、感觉和括约肌功能产生进一步破坏;2)SCRT不适用于颈髓或T8以上胸髓SCI的患者,因为对颈髓和上中段胸髓的毁损可能产生严重合并症;3)SCRT不适用于SCI继发性伤害性疼痛,因为口服药物(非甾体类镇痛药、阿片类药物等)、物理治疗等保守疗法对大多数伤害性疼痛能够有效镇痛;绝大多数患者不需要进行手术镇痛。这是所有手术治疗(开放性/微创)的共同点,即手术镇痛仅适用于口服药物无法控制疼痛或不良反应无法耐受的顽固性疼痛患者。
SCI继发性NP以双侧疼痛为主,本研究中未见单侧疼痛病例;如果SCI继发性NP患者主诉单侧疼痛,笔者依然建议进行双侧同时毁损,理由如下:1)SCRT毁损平面是患者感觉减退/消失平面以上两个节段,是未受损伤的健康脊髓。在脊髓一侧进行射频热凝时,对侧神经结构可能因为热传导而受到损害,应该避免医源性不完全性SCI并继发疼痛;2)部分脊髓后角细胞的轴突可以进入对侧脊髓内形成上行纤维束。因此,上传的痛觉信号可以沿着同侧脊髓传导,也可以交叉进入对侧脊髓后上传,必须进行双侧毁损以确保全面阻断痛觉信号上传。
SCI继发性NP的治疗包括药物治疗和手术治疗。Baastrup等[4]对SCI继发性NP的药物治疗进行了荟萃分析,结果显示,尽管采用多种药物联合治疗,最好的治疗结果也只是轻度至中度的疼痛缓解。迄今为止,只有加巴喷丁、普瑞巴林和阿米替林已经通过随机研究证实能够有效治疗SCI继发性NP[5-8]。
背根入髓区(dorsal root entry zone,DREZ)切断术(DREZotomy)、运动皮质刺激(motor cortex stimulation,MCS)、脊髓电刺激(spinal cord stimulation,SCS)和深部脑刺激(deep brain stimulation,DBS)是目前治疗SCI继发性NP常用的手术方法。
MCS、SCS和DBS的共同原理是通过在中枢神经系统相应的部位(硬膜外腔、丘脑腹侧核、内囊后肢等)放置电极并进行持续/间断性电刺激,从而阻滞疼痛信号的上传和表达。MCS、SCS和DBS对植入设备定位精度要求高,对神经导航系统、电生理监测系统等高端设备和专业技术人员有极高的依赖性,且植入设备费用昂贵。MCS、SCS和DBS的合并症主要表现为植入物感染、穿刺损伤硬膜、神经根损伤、运动性发作(部分/全身性)[9-10]等。
无论采用开放性手术还是射频/激光毁损手术,DREZ的判定均是DREZotomy的重点,也是规避手术合并症的难点。Kanpolat等[11]对44例NP患者进行DREZotomy,平均随访期达72个月(6个月~20年)。术前和随访期的VAS和Karnofsky评分表明,77%的NP患者出现疼痛缓解;手术致死1例(2.2%),有2例(4.4%)患者出现了一过性肌无力,2例(4.4%)形成了慢性脑脊液漏。
SCRT与其他镇痛手术相比,有如下特点:1)适应证受限:SCRT需要对双侧脊髓进行广泛彻底的毁损;不完全性SCI及T8以上脊髓损伤的患者应该考虑进行MCS、SCS和DBS等神经调制手术,也可以考虑进行DREZotomy。2)疗效满意:本研究中,36个月随访期内的缓解率(治愈率+有效率)范围是90.5% ~97.7%,此初步数据优于文献报道[9-12]的MCS、SCS和DREZotomy及其他非药物方法的缓解率。3)安全性高:合并症仅见一过性硬膜刺破后头痛(18.6%)和腹痛(11.6%),均于术后7日内完全缓解;随访期未出现手术相关合并症;未出现死亡病例,未出现慢性脑脊液漏[11]等严重合并症。4)实用性强:SCRT的关键在于选择正确的穿刺平面和穿刺路径,手术中仅需数次CT扫描即可精确地引导穿刺;不需要神经导航系统、电生理监测系统等高端设备和专业技术人员,更无需昂贵的植入设备。SCRT在实用性、经济性、医生培训和技术推广方面,与其他手术相比存在显著优势。5)其他:MCS、SCS、DBS以及 DREZotomy无效的顽固性病例可以考虑进行SCRT。
SCRT的后续研究包括:1)扩大适应证:研究SCRT治疗非外伤性(髓内肿瘤、椎管内肿瘤等)SCI继发性NP;在患者残留的运动、感觉和括约肌功能对日常生活不产生实际功能性意义,并且患者充分知情同意的前提下,研究SCRT治疗不完全性SCI继发性NP。2)远期疗效:进一步扩大病例数量、延长随访时间并进行纵向追踪研究。
结论:SCRT是治疗SCI继发性NP有效、安全的微创手术方法,在实用性、经济性、医生培训和技术推广等方面,与其他手术方法相比具有显著优势。但是,SCRT在临床应用中必须严格限定适应证和禁忌证。
[1]Cruz-Almeida Y,Martinez-Arizala A,Widerstrom-Noga E G.Chronicity of pain associated with spinal cord injury:A longitudinal analysis[J].J Rehabil Res Dev,2005,42(5):585-594.
[2]Tan A M,Zhao P,Waxman S G,et al.Early microglial inhibition preemptively mitigates chronic pain development after experimental spinal cord injury[J].J Rehabil Res Dev,2009,46(1):123-133.
[3]Bouhassira D,Attal N,Alchaar H,et al.Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire[DN4][J].Pain,2005,114(1 -2):29-36.
[4]Baastrup C,Finnerup N B.Pharmacological management of neuropathic pain following spinal cord injury[J].CNS Drugs,2008,22(6):455-475.
[5]Rintala D H,Holmes S A,Courtade D,et al.Comparison of the effectiveness of amitriptyline and gabapentin on chronic neuropathic pain in persons with spinal cord injury[J].Arch Phys Med Rehabil,2008,88(12):1547-1560.
[6]Vranken J H,Dijkgraaf M G,Kruis M R,et al.Pregabalin in patients with central neuropathic pain:a randomized,double-blind,placebo-controlled trial of a flexible-dose regimen[J].Pain,2008,136(1 -2):150-157.
[7]Norrbrink C,Lundeberg T.Tramadol in neuropathic pain after spinal cord injury:a randomized,double-blind,placebocontrolled trial[J].Clin J Pain,2009,25(3):177-184.
[8]Siddall P J,Cousins M J,Otte A,et al.Pregabalin in central neuropathic pain associated with spinal cord injury:a placebo-controlled trial[J].Neurology,2006,67(10):1792-1800.
[9]Delavallee M,Abu-Serieh B,de Tourchaninoff M,et al.Subdural motor cortex stimulation for central and peripheral neuropathic pain:a long-term follow-up study in a series of eight patients[J].Neurosurgery,2008,63(1):101-105.
[10]Kumar K,Taylor R S,Jacques L,et al.The effects of spinal cord stimulation in neuropathic pain are sustained:a 24-month follow-up of the prospective randomized controlled multicenter trial of the effectiveness of spinal cord stimulation[J].Neurosurgery,2008,63(4):762-770.
[11]Kanpolat Y,Tuna H,Bozkurt M,et al.Spinal and nucleus caudalis dorsal root entry zone operations for chronic pain[J].Neurosurgery,2008,62(3 Suppl 1):235-242.
[12]Norrbrink Budh C,Kowalski J,Lundeberg T.A comprehensive pain management programmed comprising educational,cognitive and behavioural interventions for neuropathic pain following spinal cord injury[J].J Rehabil Med,2006,38(3):172-180.
