血管紧张素1-7降低脂肪细胞氧化应激增加脂联素表达
2014-10-25杨芳远张雪莲袁明霞杨金奎
刘 畅 曹 曦 杨芳远 张雪莲 袁明霞 杨金奎
(首都医科大学附属北京同仁医院内分泌科,北京100730)
近十年来,关于肾素-血管紧张素(renin-angiotensin system,RAS)系统抑制剂的研究都是围绕着其在高危人群中延缓2型糖尿病发生的临床作用[1]。同时,RAS的几个新的成员血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2),血管紧张素(1-7)[angiotension(1-7),Ang-(1-7)]、Mas受体等也陆续被发现。2002年,研究者[2]发现了Ang-(1-7)的特异性受体Mas,使RAS从传统的ACE-AngⅡ-AT1轴扩展出新的ACE2-Ang-(1-7)-Mas轴,为心血管疾病及糖代谢异常疾病的治疗提供了新的靶点。ACE2可以降解AngⅡ为Ang-(1-7)对于传统的RAS系统有负性调节的作用,Ang-(1-7)通过Mas受体与AngⅡ起相反的作用。
在外周组织中,AngⅡ可以通过增加氧化应激的发生从而诱导胰岛素抵抗[3]。AngⅡ可以刺激胞质中NADPH氧化酶的表达增加从而增加细胞中活性氧(ROS)的水平[4-5]。同时AngⅡ可以降低脂肪细胞及骨骼肌细胞中胰岛素受体底物(insulin receptor substrate,IRS-1)依赖的胰岛素通路的表达,通路中各蛋白磷酸化激活及促进葡萄糖转运体4(GLUT-4)的膜转位[6]。最近的研究[7-8]表明 Ang-(1 -7)可以对抗AngⅡ的作用从而增加胰岛素诱导的Akt的磷酸化。Santos等[7]报道Mas受体敲除小鼠更易进展为代谢综合征,出现代谢紊乱的临床表现。以上研究表明Ang-(1-7)在改善胰岛素抵抗及维持葡萄糖稳态中起到重要作用。然而Ang-(1-7)在脂肪组织和骨骼肌组织中对于氧化应激及其相关的葡萄糖代谢的作用尚未有报道。
本研究中,笔者检测了ACE2-Ang-(1-7)-Mas轴在对抗氧化应激的损伤及增加脂肪细胞胰岛素敏感性因子脂联素的表达中的作用。Mas受体的拮抗剂A779可以抵消Ang-(1-7)的作用。
1 材料与方法
1.1 脂肪细胞培养及预处理
3T3-L1脂肪细胞的诱导分化及培养:将3T3-L1前脂肪细胞按80%密度接种在12孔板中,用含有10%FBS的DMEM高糖培养基在37℃、5%CO2条件下的细胞孵箱中培养。待细胞生长至完全融合2 d后开始诱导:含有0.5 mmol/L IBMX、1 μmol/L地塞米松和5 mg/L INS、10%FBS的高糖DMEM培养基中培养72 h,更换为含有5 mg/L INS、10%FBS的高糖DMEM培养基继续培养72 h,之后用含有10%FBS的高糖DMEM培养基,以后每48 h换液1次。诱导8~10 d后90%以上细胞呈脂肪细胞表型,细胞内充满大小不等的脂滴,可用于后续实验。实验分组:①对照组;②Ang-(1 -7)10-9组;③Ang-(1 -7)10-9﹢ A779 10-6组;④葡萄糖氧化酶(GO)50 mU/mL;⑤GO 100 mU/mL;⑥GO 100 mU/mL+Ang-(1 -7)10-9组。
1.2 活性氧(ROS)荧光探针-DHE检测细胞ROS的表达
本实验采用ROS荧光探针-DHE,应用流式细胞仪检测INS-1细胞ROS的表达。流式细胞分析操作方法为采用480~535 nm波长激发,测定590 nm~610 nm以上的发射,细胞可以分成2个亚群:ROS阴性细胞仅有很低的荧光强度,ROS阳性细胞有较强的红色荧光。其工作浓度为1 μmol/L。
DHE染色步骤:①准备好上述细胞及DHE染色液。用PBS溶液将DHE原液稀释至工作浓度,为1 μmol/L。②上述细胞用PBS液漂洗2~3次后,除空白对照组外,其余各组均加入2 mL的DHE工作液,37℃温育20 min。空白对照组用于流式检测的背景对照。③吸去染色液,PBS漂洗2~3次,每孔加入400 μL胰蛋白酶细胞消化液,消化1~2 min。④每孔加入预冷PBS 1 mL,终止消化反应,吹打混匀。⑤集细胞悬液,离心,弃上清。⑥管样品加入500 μL PBS溶液,上机检测。
1.3 NBT还原实验检测活性氧
NBT还原实验检测活性氧法作用原理:淡黄色的四氮唑基经还原后可以变成紫黑色的甲月簪基,可检测其吸光度。
细胞接种在12孔细胞培养板中,分为以下几组:①对照组;②Ang-(1 -7)10-9组;③Ang-(1 -7)10-9﹢A779 10-6组,每组4个副孔。每组细胞在含0.2%NBT的磷酸盐缓冲液PBS中避光孵育90 min。然后加入50%冰醋酸溶液,用酶标仪检测560 nm各组的吸光度OD值。在倒置显微镜下显色并拍照。
1.4 提取RNA,反转录及实时定量PCR
1)RNA提取:将细胞培养瓶从孵箱取出,镜下观察细胞分化程度、状态等,吸出培养液。用PBS洗3次。Trizol 1 mL吹起细胞,移至无RNA酶的EP管中,室温5 min,充分裂解。加入氯仿0.2 mL用手用力震荡 15 s,冰上静置 10 min。4离心 12 000 g,15 min。小心吸上清于新管中,0.5 mL的异丙醇轻轻颠倒震荡冰上静置 15 min。4℃离心 12 000 g,15 min。弃上清,沉淀中加75%的乙醇(溶于DEPC水中)颠倒混匀,4℃离心7 400 g,10 min。弃上清,风干沉淀5~10 min去乙醇。重新溶解沉淀于15~20 μL DEPC水中。-70℃保存。
2)反转录:RNA的热变性:RNase Free H2O210 μL;Oligo(dT)20(10 pmol/ μL)1 μL;Total RNA 2 μg;65 ℃,5 min;置于冰上。
反应液配置:第1步变性后的RNA溶液12 μL;5× RT Buffer 4 μL;dNTP Mixture(各 10 mmol/L)2 μL;RNase Inhibitor(10U/ μL)1 μL;Rever Tra Ace 1 μL;总体积 20 μL。
反转录反应:30℃ 10 min→42℃ 20 min→99℃ 5 min→4℃ 5 min→ 瞬间离心。片段较长时,可适当延长此步骤时间(20~60 min)。由于反转录酶在反应后和cDNA结合,所以在99℃下进行5 min的热处理。
3)实时定量PCR
反应液的配制:蒸馏水16 μL,SYBR®Green Realtime PCR Master Mix 25 μL,上游引物(10 μmol/L)2 μL,下游引物(10μmol/L)2μL,样品溶液 5 μL,总体积 50 μL,体系:15 μL(两步法,退火/延伸温度 60℃),PCR循环(×40循环):95℃ 15 s→60℃ 60 s。
4)所用引物:
TNF-α:5'-CGTCGTAGCAAACCACCAAG-3';5'-TTGAAGAGAACCTGGGAGTAGACA-3';IL-6:5'-TGGGAAATCGTGGAAATGAG-3'; 5'-CTCTGAAGGACT CTGGCTTTG-3';Adiponectin:5'-TGGAGAGAAGGGAGAGAAAGG-3';5'-TGGTCGTAGGTGAAGAGAACG-3';18S:5'-TCAAGAACGAAAGTCGGAGG-3';5'-GGACATCTAAGGGCATCACA-3'。
1.5 统计学方法
所有数据资料均采用SPSS 10.0进行统计处理。实验数据以均数±标准差(±s)表示,组间差异采用One-way ANOVA分析检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Ang-(1-7)减少成熟脂肪细胞ROS水平
DHE探针结合后经流式细胞术的方法检测成熟脂肪细胞中ROS水平,结果显示:Ang-(1-7)可以减少成熟脂肪细胞中的荧光强度即ROS水平,差异有统计学意义(P<0.01),而Mas受体拮抗剂A779可以逆转这种作用(P<0.01)(图1,表1)。
表1 各组脂肪细胞DHE染色荧光强度Tab.1 DHE intensity of each group(±s)(n=3)
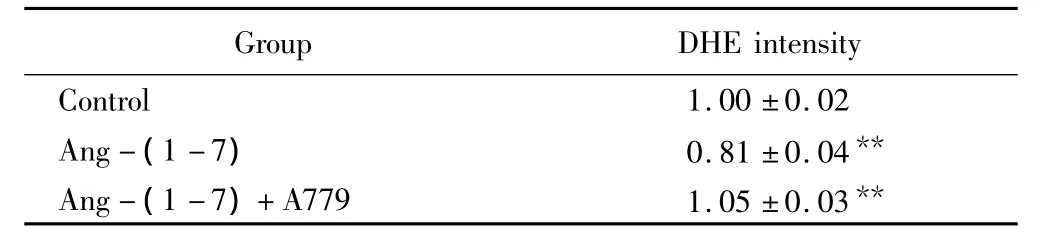
表1 各组脂肪细胞DHE染色荧光强度Tab.1 DHE intensity of each group(±s)(n=3)
**P <0.001 vs control group;DEH:dihydroethidium.
Group DHE intensity Control 1.00 ±0.02 Ang- (1 -7) 0.81 ±0.04**Ang-(1 -7)+A779 1.05 ±0.03**
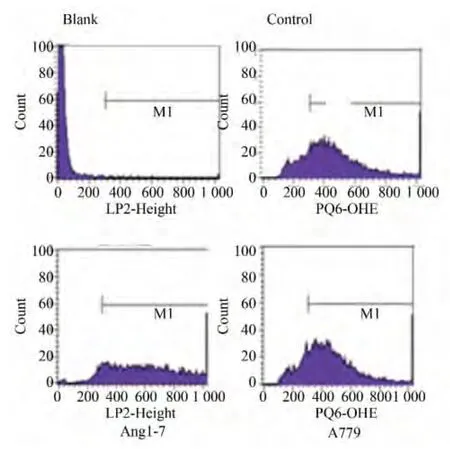
图1 各组脂肪细胞DHE染色荧光强度Fig.1 DHE intensity of each group(n>3)
经NBT还原实验的方法检测NBT还原后的吸光度,结果显示,Ang-(1-7)可以减少成熟脂肪细胞NBT还原后的吸光度即ROS的产生水平(P<0.001),而Mas受体拮抗剂A779可以逆转这种作用(P <0.05)(图2,表2)。

图2 各组脂肪细胞NBT染色OD(560)值Fig.2 NBT reduction OD(560)of each group(n=7)NBT:tetranitroblue tetrozolium chloride.

表2 各组脂肪细胞NBT染色OD(560)值Tab.2 NBT reduction OD(560)of each group (x ± s,n=7)
2.2 氧化应激降低脂联素的mRNA表达
分别在分化成熟的脂肪细胞中加入50 mU/mL及100 mU/mL的GO培养12 h建立氧化应激的浓度梯度模型。定量PCR的方法检测脂联素的表达,结果显示,脂联素的表达随GO浓度的增加而降低,差异有统计学意义。氧化应激损伤降低了脂联素的表达从而减少脂肪细胞的胰岛素敏感性增加胰岛素抵抗(图3)。

图3 各组脂肪细胞中脂联素mRNA表达Fig.3 Adiponectin relative expression of each group(n=8)
2.3 Ang-(1-7)通过降低氧化应激水平从而增加脂联素的mRNA表达
在已建立的氧化应激模型中加入Ang-(1-7)及A779分别检测脂联素的表达。结果显示,GO浓度为100 mU/mL条件下脂联素表达降低72%(P<0.05),同时加入Ang-(1-7)后可以逆转脂联素表达的减低,脂联素的表达升高了10倍(P<0.05)。单独加入Ang-(1-7)组脂联素的表达较空白对照组升高了9.27倍,差异有统计学意义(P<0.05)。同时加入Ang-(1-7)及A779组脂联素的表达显著下降(P<0.05)(图4)。
2.4 Ang-(1-7)对炎性反应因子IL-6和 TNF-α的mRNA表达的影响

图4 各组脂肪细胞中脂联素mRNA表达Fig.4 Adiponectin relative expression of each group (n=3)
实时定量PCR方法检测Ang-(1-7)及A779对其他与脂肪细胞氧化应激及葡萄糖摄取相关炎性反应因子IL-6和TNF-α的mRNA水平表达的影响。结果显示,Ang-(1-7)及 A779对于 IL-6和 TNF-α的mRNA水平表达没有显著性影响(P>0.05)(图5、6,表3、4)。
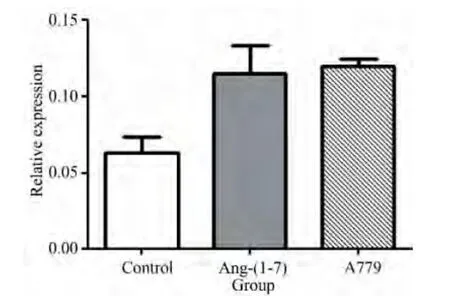
图5 各组脂肪细胞中炎性反应因子IL-6 mRNA表达Fig.5 IL-6 relative expression of each group(n=3)
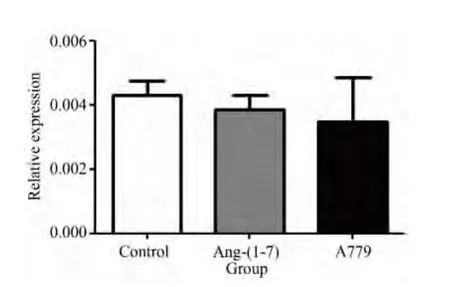
图6 各组脂肪细胞中炎性反应因子TNF-α mRNA表达Fig.6 TNF-α relative expression of each group(n=3)

表3 各组脂肪细胞中炎性反应因子IL-6 mRNA表达Tab.3 IL-6 relative expression of each group(x ± s,n=3)

表4 各组脂肪细胞中炎性反应因子TNF-α mRNA表达Tab.4 TNF-α relative expression of each group(x ± s,n=3)
3 讨论
氧化应激在2型糖尿病的发生和发展中起到关键作用[9-10]。多项临床和亚临床的研究[11-12]指出氧化应激在2型糖尿病发生的病理过程中起关键作用。氧自由基和过氧化氢作为两个强氧化剂被称为活性氧(ROS),在血糖失衡及靶器官损伤中起作用。氧化应激可以减低外周组织对胰岛素的敏感性并且降低血糖的代谢利用。在本研究中,笔者首次提出外源性的Ang-(1-7)处理可以减少分化成熟的脂肪细胞中ROS的水平。
胰岛素抵抗是细胞或组织对于胰岛素作用低于正常生理水平的状态,也是2型糖尿病的特征[13-14]。脂肪组织是餐后血糖首先作用的器官[15-16]。最近一项研究[7]表明Mas受体敲除小鼠更易出现以胰岛素敏感性降低为特征的胰岛素抵抗,葡萄糖耐量受损及脂肪组织葡萄糖摄取率下降。提示Ang-(1-7)/Mas轴可作为胰岛素增敏剂而起作用。
虽然TNF-α和IL-6的mRNA水平表达没有显著性变化,但是Ang-(1-7)处理组显示出脂联素mRNA水平显著性的增高。脂联素是一种血浆细胞因子,它在脂代谢、胰岛素敏感性及抗炎过程中起到调节的作用[17-18]。降低的血清的脂联素水平是在人和动物体内出现肥胖和胰岛素抵抗的共同特征[19]。这些结果指出了Ang-(1-7)可以通过增加脂联素的基因表达水平从而改善脂肪细胞的胰岛素抵抗。另外,分化成熟的脂肪细胞表现出随着过氧化氢浓度增高脂联素表达降低的状态,并且氧化损伤对于脂联素的表达起到负调节作用[20]。
在本研究中,笔者提出Ang-(1-7)抵抗氧化应激并同时升高脂联素的表达水平。由葡萄糖氧化酶有诱导的轻微的氧化损伤可以显著的降低脂联素的mRNA水平表达,并且这种降低是剂量依赖性的。因此,Ang-(1-7)通过增加脂联素的表达从而对抗氧化应激损伤也可能成为Ang-(1-7)改善胰岛素抵抗的一个可能机制。
脂肪组织作为一个重要的内分泌器官在糖类及脂代谢过程中起到关键的作用[21],很多RAS通路的成员都在脂肪组织中表达[22]。研究[23]表明 Ang-(1-7)可以对抗Ang-II的作用,并且作为ACE的抑制剂。Ang-II可以诱导氧化应激增加胰岛素抵抗。Ang-(1-7),在RAS中作为Ang-II的对抗剂,有可能参与到抗氧化应激减少胰岛素抵抗的过程中,并在其中起到保护的作用。另外,Ang-(1-7)/Mas轴可以在脂肪组织、肝脏、骨骼肌、内皮细胞及心脏中激活磷酸肌醇-3激酶 (PI3K)/Akt信号通路,此信号通路的激活也可能成为Ang-(1-7)/Mas轴的作用机制。Ang-(1-7)/Mas轴可以诱导脂肪组织中Akt苏氨酸(308)和丝氨酸 (473)位点磷酸化,从而激活胰岛素作用通路,增加葡萄糖的摄取。选择性Mas受体拮抗剂A779可以阻断Ang-(1-7)诱导活化的PI3K/Akt信号通路。对果糖喂养的代谢综合征大鼠模型进行慢性持续注射Ang-(1-7)治疗,可以重新激活脂肪细胞中IR/IRS-1/PI3K/Akt信号通路,使其正常化。这些结果表明,Ang-(1-7)增加葡萄糖摄取的机制中包括其对于胰岛素作用信号通路的激活。
总之,本研究表明Ang-(1-7)可以通过Mas受体对抗氧化应激损伤从而增加脂肪细胞脂联素的表达,最终增加外周组织脂肪细胞的敏感性。其主要机制包括Ang-(1-7)可以通过Mas受体降低ROS的产生及促进胰岛素敏感性因子脂联素的表达。结合文献报道[7]Mas受体敲除小鼠易发生胰岛素抵抗和本研究结果,可以得出Ang-(1-7)通过Mas受体可以对抗氧化应激,其机制至少包括对抗氧化应激和增加脂联素表达过程两方面。
[1]No authors listed.Correction:effects of an angiotensinconverting-enzyme inhibitor,ramipril,on cardiovascular events in high-risk patients[J].N Engl J Med,2000,342(18):1376.
[2]Alenina N,Bader M,Walther T.,et al Imprinting of the murine MAS protooncogene is restricted to its antisense RNA[J].Biochem Biophys Res Commun,2002,290(3):1072-1078.
[3]Strazzullo P,Galletti F.Impact of the renin-angiotensin system on lipid and carbohydrate metabolism[J].Curr Opin Nephrol Hypertens,2004,13(3):325-332.
[4]Muscogiuri G,Chavez A O,Gastaldelli A,et al.The crosstalk between insulin and renin-angiotensin-aldosterone signaling systems and its effect on glucose metabolism and diabetes prevention[J].Curr Vasc Pharmacol,2008,6(4):301-312.
[5]Wei Y,Sowers J R,Nistala R,et al.Angiotensin II-induced NADPH oxidase activation impairs insulin signaling in skeletal muscle cells[J].J Biol Chem,2006,281(46):35137-35146.
[6]Giani J F,Gironacci M M,Munoz M C,et al.Angiotensin-(1 7)stimulates the phosphorylation of JAK2,IRS-1 and Akt in rat heart in vivo:role of the AT1 and Mas receptors[J].Am J Physiol Heart Circ Physiol,2007,293(2):H1154-1163.
[7]Santos S H,Fernandes L R,Mario E G,et al.Mas deficiency in FVB/N mice produces marked changes in lipid and glycemic metabolism[J].Diabetes,2008,57(2):340-347.
[8]Niu M J,Yang J K,Lin S S,et al.Loss of angiotensinconverting enzyme 2 leads to impaired glucose homeostasis in mice[J].Endocrine,2008,34(1 -3):56-61.
[9]GiaccoF,Brownlee M.Oxidative stress and diabetic complications[J].Circ Res,2010,107(9):1058-1070.
[10]Sarfstein R,Gorzalczany Y,Mizrahi A,et al.Dual role of Rac in the assembly of NADPH oxidase,tethering to the membrane and activation of p67phox:a study based on mutagenesis of p67phox-Rac1 chimeras[J].J Biol Chem,2004,279(16):16007-16016.
[11]WeyerC,Funahashi T,Tanaka S,et al.Hypoadiponectinemia in obesity and type 2 diabetes:close association with insulin resistance and hyperinsulinemia[J].J Clin Endocrinol Metab,2001,86(5):1930-1935.
[12]Wu X,Motoshima H,Mahadev K,et al.Involvement of AMP-activated protein kinase in glucose uptake stimulated by the globular domain of adiponectin in primary rat adipocytes[J].Diabetes,2003,52(6):1355-1363.
[13]Hattori Y,Akimoto K,Gross S S,et al.Angiotensin-II-induced oxidative stress elicits hypoadiponectinaemia in rats[J].Diabetologia,2005,48(6):1066-1074.
[14]崔常清.胰岛素抵抗的机制与临床研究进展[J].中国煤炭工业医学杂志,2012,15(7):1119-1121.
[15]Fukuoka H,Iida K,Nishizawa H,et al.IGF-I stimulates reactive oxygen species(ROS)production and inhibits insulin-dependent glucose uptake via ROS in 3T3-L1 adipocytes[J].Growth Horm IGF Res,2010,20(3):212-219.
[16]杨晶,裴丽娜,都健,等.胰岛素抵抗大鼠脂肪组织chemerin mRNA的表达和意义[J].中国医科大学学报,2012,41(1):35-37.
[17]Munoz M C,Giani J F,Dominici F P.Angiotensin-(1-7)stimulates the phosphorylation of Akt in rat extracardiac tissues in vivo via receptor Mas[J].Regul Pept,2010,161(1-3):1-7.
[18]南楠,金泽宁,杨泽.脂联素基因多态性与2型糖尿病合并冠心病的关联研究[J].首都医科大学学报,2012,33(4):6-11.
[19]Sampaio W O,Souza dos Santos R A,Faria-Silva R,et al.Angiotensin-(1 - 7)through receptor Mas mediates endothelial nitric oxide synthase activation via Akt-dependent pathways[J].Hypertension,2007,49(1):185-192.
[20]Furukawa S,Fujita T,Shimabukuro M,et al.Increased oxidative stress in obesity and its impact on metabolic syndrome[J].J Clin Invest,2004,114(12):1752-1761.
[21]Nakanishi S,Yamane K,Kamei N,et al.A protective effect of adiponectin against oxidative stress in Japanese Americans:the association between adiponectin or leptin and urinary isoprostane[J].Metabolism,2005,54(2):194-199.
[22]Newsholme P,Haber E P,Hirabara S M,et al.Diabetes associated cell stress and dysfunction:role of mitochondrial and non-mitochondrial ROS production and activity[J].J Physiol,2007,583(Pt 1):9-24.
[23]Ferreira A J,Santors R A.Cardiovasular actins of angiotensin-(1 -7)[J].Braz J Med Biol Res,2005,38(4):499-507.
