三种形貌静电纺丝膜片的制备及其与牙周膜细胞的相容性
2014-10-19李文星侯文婕刘月华
李文星,陈 静,侯文婕,刘月华
(1.同济大学附属口腔医院口腔生物医学及转化医学实验室,上海 200072;2.同济大学附属口腔医院正畸科,上海 200072)
静电纺丝是一种利用聚合物熔体或溶液,在强电场作用下形成喷射流,从而制备极高比表面积、高孔隙率、相互连通的三维网络状纤维的技术[1-2]。利用该技术所制备的电纺薄膜,在组织工程领域广泛应用。本研究通过控制纺丝溶液成分、空气湿度和温度、流速,制备具有不同微观结构和形貌的静电纺丝薄膜[3-5],并以此作为人牙周膜细胞(periodontal ligament cells,PDLCs)的载体支架[6-9],进行体外符合培养,探讨膜片的微观结构和形貌的改变对材料细胞相容性的影响。
1 材料与方法
1.1 主要材料和仪器
聚己内酯(polycaprolactone,PCL)相对分子质量1×105,购自美国Sigma-aldrich公司;液体胶原购自加拿大Stemcell公司;a-MEM培养基、胎牛血清购自美国Gibco公司;DAPI购自上海碧云天公司;MTT细胞活力和增殖检测试剂盒,购自上海复蒙基因生物有限公司;Calcein-AM/PI荧光标记死活细胞染色试剂盒,购自南京同仁化学研究所;细胞培养瓶及孔板购自美国Corning公司。Quanta 200 FEG场发射环境扫描电子显微镜;尼康TE2000倒置荧光显微镜。
1.2 方法
1.2.1 静电纺丝制备膜片 通过控制纺丝溶液成分、空气湿度和温度、流速,制成3种静电纺丝膜片。条件1:PCL按质量比8%溶于氯仿,纺丝流速0.7 ml/h,环境温度38℃,空气湿度18%。条件2:纺丝流速1.2 ml/h,环境温度35℃,空气湿度28%。条件3:液体胶原和PCL各按质量比4%溶于氯仿,磁力搅拌3 h,超声振荡5 h,纺丝流速0.7 ml/h,环境温度38℃,空气湿度18%。纺丝电压均为15 kV,聚合物溶液带电喷射成丝后落在铝箔上,喷丝头与铝箔水平距离15 cm。所得材料置于干燥箱内干燥2 d,揭下铝箔上的薄膜即为静电纺丝膜片。裁剪,双抗水漂洗,紫外线正反面照射消毒备用。乙醇梯度脱水,临界点干燥,表面喷金后进行扫描电镜观察。
1.2.2 PDLCs细胞培养和接种 人牙齿拔除后立即置于含双抗(青霉素-链霉素),10%血清的α-MEM培养液中。无菌条件下用含双抗PBS缓冲液充分洗涤3次,刮取根中l/3的健康牙周膜,将细碎组织块移入25 ml培养瓶中,倒置培养瓶于5%CO2,37℃培养箱中2 h后,加入上述培养液中,正置放入培养箱继续培养。每隔3 d换液1次,约l周后有原代细胞爬出。2.5 g/L胰蛋白酶消化,培养液终止消化并重悬细胞,静置于培养箱培养。至细胞长满瓶底80%时常规传代。第3~5代细胞留用。将细胞接种在材料表面,接种密度10万/cm2。
1.2.3 DAPI染色 在PDLCs接种在纺丝膜片的第4、7天,吸干培养液后,用4%多聚甲醛固定细胞20 min。固定好的细胞材料复合体用PBS缓冲液漂洗3次,避光加入配好的DAPI染色液染色20 min。吸干,用PBS缓冲液漂洗6次。用载玻片和盖玻片制样,避光冷冻保存。样本尽快在显微镜下观察。
1.2.4 MTT 将材料裁切为接近96孔孔径大小,置于孔底,以每孔3000个细胞接种,每孔体积200 μl。同一培养条件,分别培养 1.5、4、7、9、11 d。每孔加 MTT 溶液(5 mg/ml)20 μl,继续孵育 4 h,终止培养。小心吸弃孔内上清液,每孔加 150 μl DMSO,振荡10 min,使结晶物充分融解。在酶标仪上测定各孔光吸收值(490 nm波长)。以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.2.5 Calcein-AM/PI活-死细胞染色 加 10 μl Calcein-AM储备液和 15 μl PI储备液至 5 ml PBS中配制成染色溶液。Calcein-AM的终浓度为2 μmol/L,PI的终浓度为 4 μmol/L,避光保存。吸弃培养基,PBS缓冲液清洗6次。加入染色液,在37℃培养细胞30 min。用PBS缓冲液洗涤3次。显微镜下观察活细胞和死亡细胞的细胞核形态。
1.3 统计学处理
实验数据使用SPSS 17.0软件包进行单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 不同静电纺丝膜片形貌的扫描电镜观察
在PCL浓度8%,纺丝流速0.7 ml/h,环境温度38℃,空气湿度18%的条件下,制得传统的细长纤维状膜片。在PCL浓度8%,纺丝流速1.2 ml/h,环境温度35℃,空气湿度28%的条件下,制得液滴状与纤维状穿插混合的膜片。在液体胶原和PCL各占比4%的条件下制得圆盘状与纤维状穿插混合的膜片,见图1。
2.2 DAPI染色观察PDLCs在纺丝膜片的生长
在细胞与材料共培养的第4天,在三种薄膜材料上的细胞密度差异无统计学意义;而第7天,圆盘状与纤维状穿插混合的膜片的细胞数量显著高于另外两种薄膜,见图2。
2.3 MTT细胞增殖检测
在培养第 1.5、4、7、9天,细胞的数目不断增高,而到了第11天,细胞的数目开始下降。在 第1.5天及第4天,三种薄膜上的细胞数目相比,差异无统计学意义(P>0.05)。而在第7、9、11天,在圆盘状与纤维状穿插混合的膜片上的细胞数量显著高于另外两种薄膜,差异有统计学意义(P<0.01),见图 3。

图1 三种静电纺丝膜片形貌的扫描电镜观察Fig.1 Scan electron microscopic observation of three kinds of electrospinning scaffolds
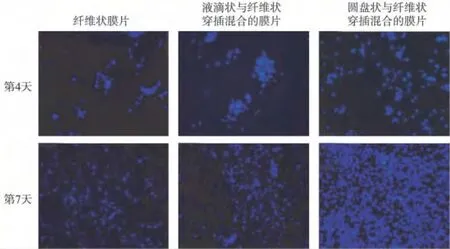
图2 DAPI染色观察PDLCs在纺丝膜片的生长Fig.2 Observation of PDLCs on three kinds of electrospinning scaffolds by DAPI staining

图3 MTT细胞增殖检测Fig.3 MTT cell proliferation assay
2.4 Calcein-AM/PI活-死细胞染色
明场条件下观察到细胞材料复合体。细胞与材料共培养的第11天,在圆盘状与纤维状穿插混合的膜片上,PDLCs细胞的活细胞(绿色)较多,死细胞(红色)较少;而另外两种薄膜上的死细胞明显多于圆盘状与纤维状穿插混合的膜片,见图4。
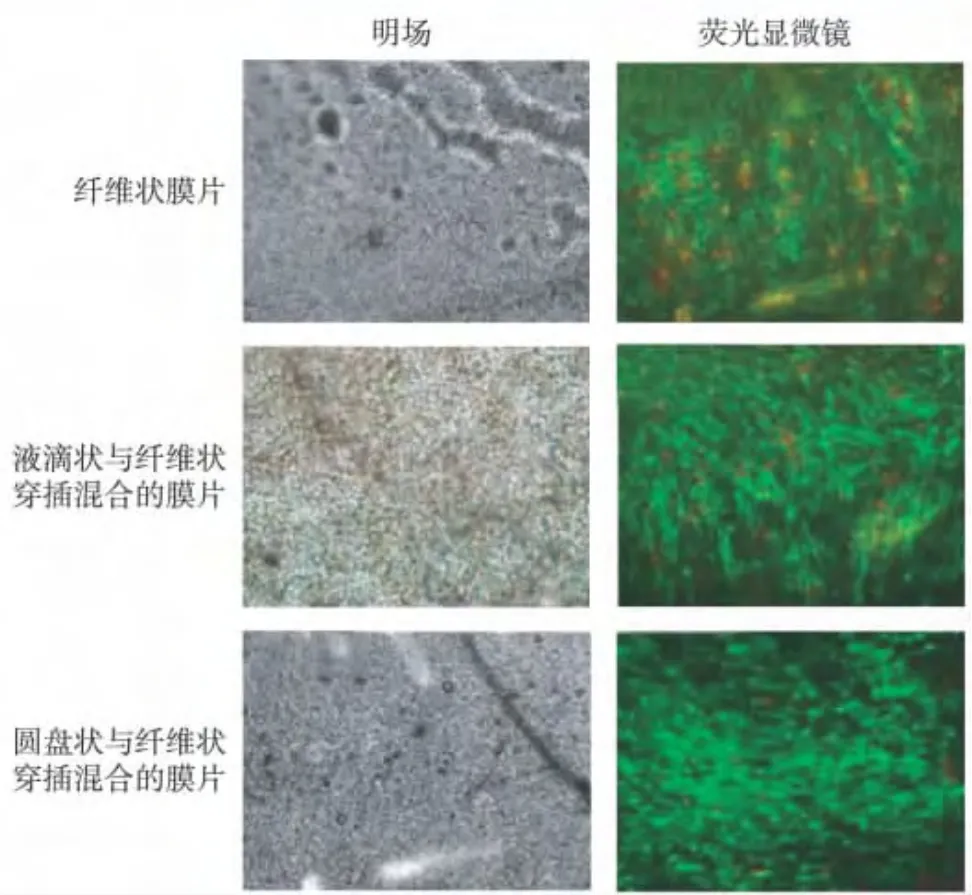
图4 Calcein-AM/PI活-死细胞染色Fig.4 Calcein-AM/PI live-dead cell staining
3 讨 论
本研究在流速较低、湿度较低、温度较高的条件下制得传统的细长纤维状的膜片,而在流速较高、湿度较高、温度较低的条件下制得液滴状与纤维状穿插混合的膜片;在增加胶原,且胶原成分不能完全溶解,而已悬浊状态分散在氯仿溶剂中时,制得圆盘状与纤维状穿插混合的膜片。通过控制纺丝溶液成分、空气湿度、流速,可以制成不同微观形貌的静电纺丝膜片。
在体外培养条件下,PDLCs在3种比例支架上均能生长。DAPI染色所示细胞与材料共培养的第4天,以及MTT检测所示,在第1.5、4天,三种薄膜上的细胞数目差异无统计学意义,都一致说明了三种纺丝的差异对细胞早期的黏附贴壁并无影响。而DAPI染色所示细胞与材料共培养的第7天,以及MTT检测所示,在第7、9、11天,在圆盘状与纤维状穿插混合的膜片上的细胞数量显著高于另外两种薄膜,也一致说明了三种纺丝的差异对细胞增殖产生了影响。MTT提示,在细胞与材料共培养的第11天,细胞数目下降,故选择该时间点做活-死细胞染色。结果显示,圆盘状与纤维状穿插混合的膜片上的细胞活性显著高于另外两种薄膜上的细胞。
静电纺丝膜片是一种在组织工程领域广泛应用的支架材料,通过调控静电纺丝的溶液成分[10]、空气湿度、温度及流速,可以改变纺丝膜片的微观结构和形貌,从而影响材料的细胞相容性。纺丝膜片的微观形貌和结构的变化,影响了PDLCs细胞的活性和增殖,其影响机制尚需进一步研究。而通过改变材料的微观结构,改善材料的细胞相容性,将为纺丝材料的优化提供广阔的空间。
[1]Li D,Xia Y.Electrospinning of nanofibers:reinventing the wheel[J].Adv Mater,2004,16(14):1151-1170.
[2]Greiner A, Wendorff JH. Electrospinning:a fascina-ting method for the preparation of ultrathin fibers[J].Angew Chem Int Ed Engl,2007,46(30):5670-5703.
[3]Liu F,Guo R,Shen MW,et al.Effect of processing variables on the morphology of electrospun poly[(lactic acid)-co-(glycolic acid)]nanofibers[J].Macromol Mater Eng,2009,294(10):666-672.
[4]Badami AS,Kreke MR,Thompson MS,et al.Effect of fiber diameter on spreading, proliferation, and differentiation of osteoblastic cells on electrospun poly(lactic acid)substrates[J].Biomaterials,2006,27(4):596-606.
[5]Di Mundo R,Gristina R,Sardella E,et al.Micro-/nanoscale structuring of cell-culture substrates with fluorocarbon plasmas[J].Plasma Processes Polymers,2010,7(3-4):212-223.
[6]贾骏,段螈螈,周建学,等.聚己内酯电纺纤维支架培养人牙周膜细胞的体外研究[J].牙体牙髓牙周病学杂志,2007,17(5):243-246.
[7]吴丽萍,孙鹏.酶消化组织块法原代培养兔牙周膜细胞[J].同济大学学报:医学版,2010,31(2):23-26.
[8]任谞挺,刘轶洋,刘宏伟.PLGA新型纳米支架的制备及其生物相容性[J].同济大学学报:医学版,2012,33(1):32-36.
[9]Shang S,Yang F,Cheng X,et al.The effect of electrospun fibre alignment on the behaviour of rat periodontal ligament cells[J].Eur Cells Mater,2010,19:180-192.
[10]Son WK,Youk JH,Lee TS,et al.The effects of solution properties and polyelectrolyte on electrospinning of ultrafine poly(ethylene oxide)fibers[J].Polymer,2004,45(9):2959-2966.
