Wnt信号通路参与实验性小鼠肝纤维化的研究
2014-10-19毕婉蓉邢海林金彩霞
毕婉蓉,邢海林,金彩霞
(1.同济大学附属同济医院分院消化内科,上海 200092;2.同济大学附属同济医院普外科,上海 200065;3.同济大学医学院干细胞研究中心,上海 200092)
慢性肝纤维化(hepatic fibrosis,HF)的发病机制尚不明确。Wnt蛋白是一组分泌型糖蛋白家族,由Wnt基因编码,其特征是含有保守的半胱氨酸残基,人 Wnt基因定位于染色体 12q13[1]。Wnt信号通路是一个多作用位点、多环节调控的信号通路,是调控细胞生长、发育和分化的关键途径,与控制胚胎发育、干细胞自我更新和分化调控密切相关,对于造血干细胞的自我更新、维持小肠组织的稳定性、调节骨矿化密度(bone mineral density,BMD)以及脂肪细胞的分化有着重要意义[2]。而上皮-间质转换(epithelial-mesenchymal transitions,EMT)是 HF重要的病理生理过程,Wnt信号通路是否参与其中及如何发挥作用是本研究的主要内容。
1 材料与方法
1.1 实验动物
SPF级健康雄性小鼠50只,体质量(90±10)g。饲养于同济大学动物实验中心。动物合格证号:SCXK(粤)2004A084。动物房室温20~22℃,光照周期12 h。实验前小鼠适应环境1周,自由饮水,无不良反应,进食、饮水和活动正常者纳入实验。
1.2 肝纤维化诊断标准
病理学检查是诊断HF的金标准。肝组织切片分别采用H-E染色及VG胶原染色,每张切片随机选取4个视野,用图象分析系统测量VG染色后,计算胶原面积与总面积的百分比,取平均数作为判定HF程度的客观指标。由资深病理科医师阅片,按下列方法进行HF分级。
1级为正常肝组织,无纤维化;2级为某些门静脉区域有纤维延伸;3级为门静脉周围纤维化,并有短的纤维间隔伸入肝小叶,少数出现由门静脉延伸至邻近门静脉的纤维间隔,肝小叶结构欠完整;4级为大多数门静脉区域纤维间隔延伸至邻近门静脉和肝的终末小静脉,肝小叶结构变形,但是没有出现假小叶;5级弥漫性的假小叶形成[3]。
1.3 试验试剂与仪器设备
分析纯四氯化碳(CCl4)购自武汉化学试剂公司;D-Hanks液购自美国Gibco公司;链酶蛋白酶E、DNA 酶 I、Triton X-100、0.05% 胰蛋白酶-EDTA 消化液购自上海名臣生物试剂公司;无Ca2+/Mg2+PBS、Nycodenze干粉、DMSO、MTT、FBS、血清替代物(knock out serum replacement,KOSR)、二甲基亚砜、NP-40购自上海滋生科技公司;2 mmol/L Glutamax、20 mmol/L HEPES、SDS、110 mmol/L β-巯基乙醇、Trypsin-EDTA、胎牛血清、明胶购自天津灏洋公司;鼠抗α-SMA单克隆抗体、SABC试剂盒、DAB试剂盒购自武汉博士德公司;Wnt3A与Wnt11购自美国Gibbtet公司。
紫外分光光度计(UV-2100)购自日本岛津公司;光学显微镜、倒置显微镜及荧光显微镜(CH-2)购自日本西门子公司;Multiskan MK3酶标仪,组织切片机购自德国Thermo公司;硝酸纤维素膜电转移系统,蛋白垂直电泳转膜系统、凝胶成像系统(Bio-Rad Doc Gel 2000)购自美国 BioRad公司;Image J图像分析软件购自美国National Institutes of Health公司。
1.4 方法
1.4.1 动物模型建立及分组 实验前小鼠适应环境1周,自由饮水,无不良反应,进食、饮水和活动正常者纳入实验。参照经典的CCl4小鼠肝纤维化模型制备方法[4]:除正常对照组外各受试小鼠腹腔注射CCl4和橄榄油按照2∶3比例配成的40%的CCl4油剂(2 ml/kg),每周2次,共12周,复制HF模型。实验期间所有小鼠食用标准饲料。10只健康雄性小鼠作为正常对照组,20只受试健康成年雄性小鼠分2组各10只,分别腹腔注射Wnt3A与Wnt11各5 ng/ml,每周2次,4周后获得肝组织。每只小鼠随机汇管区域部分通过免疫荧光显微镜下(×20)进行量化,α-SMA双盲法分析。
1.4.2 免疫荧光染色方法 小鼠肝组织标本4%多聚甲醛室温固定,置入30%蔗糖中4℃过夜;冰冻切片机切10 μm 厚组织标本;0.1%Triton-X100、PBS室温5 min膜通透处理;5% ~10%的山羊/驴血清及5%BSA封闭;一抗孵育,将组织标本同时用将兔抗 E-cad的抗体(Sigma公司,稀释度1∶2000)和小鼠抗α-SMA的抗体混合在一起加到切片上,覆盖,4℃过夜;二抗孵育,加入生物素化的羊抗兔IgG(稀释度1∶200),37℃孵育30 min,滤纸吸干,避光同时FITC(绿)标记的羊抗小鼠IgG(1∶50)和德克萨斯红标记的驴抗鼠IgG(1∶1000),37℃孵育30 min,DAPI染色;甘油封片后荧光显微镜观察并拍照,所用 LSCM 型号为 Bio-Rad MRC-1024,FITC的激发波长为488 nm。用于图象采集的显微镜物镜为 Plan-Neofluar 40×油浸镜,数值孔径(NA)为1.3,图象存为512×512相素类型。根据需要选择Zoom范围。扫描所用的激发值依据样本的不同可以在共聚焦系统提供的梯级值中选择。
1.4.3 RT-PCR检测α-SMA、E-cad、Wnt3A、Wnt5A、Wnt11 mRNA含量取大约300 mg肝组织,加入3 ml TRIzol(Invitrogen)提取总RNA,在紫外分光仪下测定RNA含量,根据RNA在D260/D280≥1.8及10 g/L琼脂糖凝胶电泳28 S/18 S RNA条带比值≥1.5鉴定RNA纯度和完整性。取2 μg总RNA为模板,参照TaKaRa公司的 RNA PCR Kit(AMV)Ver 3.0试剂盒说明书进行RT-PCR。反应条件为:95℃ 5 min变性,92℃ 1 min,60℃ 1 min,72℃ 1 min,30个循环,72℃ 延伸10 min。取 PCR扩增产物10 μl在15 g/L琼脂糖凝胶(含0.5 g/L溴化乙锭)电泳,用美国Pharmacia Master Image紫外凝胶成像系统进行扫描并用ChmioDox软件分析图像,PCR产物量以吸光度×面积表示,与GAPDH比值表示目的基因的相对含量。进行基因表达水平的半定量分析。
1.5 统计学处理
全部实验数据输入Excel数据库,应用SPSS 17.0软件,计量资料以表示,两组间均数比较采用t检验、多组间比较采用方差分析;计数资料组间频率比较用Fisher双侧确切检验;频率变化趋势用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 体内试验HF小鼠肝细胞Wnt3A与Wnt11的免疫荧光分析
对照组为健康,成年野生型小鼠进行染色观察α-SMA表达,细胞用DAPI复染,白色的箭头显示阳性,DAPI将α-SMA细胞核染成绿色(图1A)。经Wnt3A处理后,在原位(×40)表现出α-SMA染色,Massion染色的E-cad表达减少(×40),半定量分析显示经Wnt3A与Wnt11处理后的小鼠肝细胞α-SMA表达明显增多(P<0.05),说明发生了EMT,见图1。
2.2 体外试验HF小鼠肝细胞标志物的RT-PCR检测及形态学改变
对照组为正常小鼠肝细胞,在含有血清的培养基中培养;HF组为HF小鼠肝细胞在血清培养基中培养;Wnt组为正常小鼠肝细胞在无血清培养基,含有Wnt 5 ng/ml培养2周后,获得的RNA标记的间充质半定量 RT-PCR分析收获 α-SMA、E-cad、Wnt3A、Wnt5A与Wnt11。RT-PCR分析表明,HF组 α-SMA、Wnt3A、Wnt5A、Wnt11表达明显增加,E-cad明显减少(P <0.05);Wnt组 α-SMA、Wnt3A、Wnt5A、Wnt11表达明显增加,E-cad明显减少(P<0.05),见图2。病理学显示更多的间充质细胞在无血清培养中,经历了EMT,Wnt组显示了类似HF的小鼠肝细胞EMT的形态学改变,见图3。
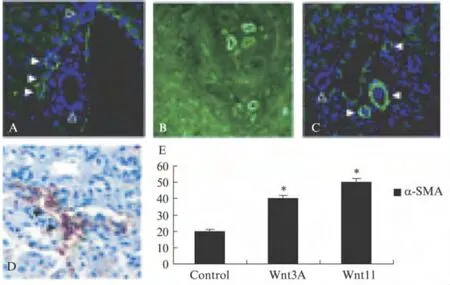
图1 HF小鼠肝细胞体内Wnt3A与Wnt11的免疫双荧光表达及半定量分析Fig.1 Expression of Wnt3A and Wnt11 in liver cells of HF mice by double fluorescence and semi-quantitative analysis

图2 HF小鼠肝细胞体外Wnt3A、Wnt5A、Wnt11、E-cad与α-SMA的RT-PCR检测Fig.2 Detection of Wnt3A,Wnt5A,Wnt11,E-cad and α-SMA expressions in cultured hepatocytes of HF mice by RT-PCR

图3 HF小鼠肝细胞形态学改变Fig.3 Morphological changes in liver cells of HF mice(×10)
3 讨 论
当Wnt信号通路成分的突变,致其活化过度或失调时,便会导致机体形成肿瘤、发育异常及器官纤维化。根据Wnt蛋白转导信号的方式不同,Wnt信号转导分为经典Wnt信号通路(canonical Wnt signaling pathway,CWSP)和非经典的Wnt信号通路(noncanonical Wnt signaling pathway,NWSP)[5]。CWSP(Wnt/β-catenin)通过核内 β 连接蛋白(βcatenin,β-cat)的累积,激活 Wnt相关靶基因,CWSP蛋白包括Wnt1、Wnt2、Wnt3A 和Wnt8等,能够稳定β-cat,从而激活靶基因T细胞因子/淋巴细胞增强因子(T-cell factor/lymphoid enhancer factor,TCF/LEF)的转录[6]。NWSP蛋白包括Wnt4、Wnt5A 和 Wnt11,分为两条:Wnt/Ca2+通路由Wnt5A和Wnt11激活,通过钙调蛋白依赖的激酶Ⅱ(CamkⅡ)、钙调蛋白敏感的蛋白磷酸酶(Calcn)和T细胞核因子NF-AT的作用,引起细胞内Ca2+增加并激活蛋白激酶C(protein kinase C,PKC);细胞平面极性通路(Wnt/planar-cell-polarity,PCP),又称Wnt/PCP途径或Wnt/Jun激酶途径,涉及RhoA和 C-jun激酶(c-jun N-teminal kinase,JNK),此通路主要调控细胞骨架的重排,参与细胞的变形、迁移以及极性变化等[7],NWSP可拮抗CWSP。
CWSP调节由胞质β-cat的磷酸化/降解引起。使之不能再磷酸化β-cat,β-cat在细胞质的水平得到累积,并发生核转位,结合到TCF/LEF上形成复合体,增强靶细胞基因的转录活性[8]。β-cat进入细胞核并堆积在核内,与EMT的发生密切相关[9]。Wnt3A可能诱导成纤维细胞TGF-β2的表达及促进β-cat-Tcf/Lef功能,调节成纤维细胞增殖,进而参与HF过程[10]。NWSP不通过β-cat发挥作用,涉及成员结合G蛋白、磷脂酶C、PKC、Calan2、JNK、Rho家族、鸟苷三磷酸酶和细胞内Ca2+释放相关因子。在没有Wnt信号时,大部分β-cat与E-cad和细胞骨架蛋白(actin)结合维持其稳定性,少部分与大肠腺瘤样蛋白、GSK-3β及Axin结合形成“降解复合物”,随后进行泛素化和蛋白酶体介导的降解,使胞质内游离的β-cat维持在低水平,不能进入核内激活作用靶点[11]。
本实验结果表明,经Massion染色及免疫荧光显示,Wnt3A与Wnt11处理后的小鼠肝上皮细胞标志(E-cad)减低,肝间质细胞标志(α-SMA)升高(P<0.05),发生了EMT;RT-PCR分析表明:HF组与Wnt处理组 α-SMA、Wnt3A、Wnt5A、Wnt11表达明显增加,E-cad明显减少(P<0.05)。病理学支持Wnt处理组显示了类似HF的小鼠肝细胞EMT的形态学改变。本研究表明,在Wnt信号通路在实验性小鼠肝上皮细胞中可能通过下调内源的某些自分泌信号抑制因子,而诱导细胞启动EMT程序,从而导致HF。EMT标志物α-SMA表达与Wnt/β-cat信号通路有关。Wnt/β-cat信号激活可能使 Slug、Snail、Twist等表达增加,降低E-cad并形成EMT。Wnt/β-cat通路对HF有一定促进作用。本研究也证实在小鼠HF过程中,Wnt信号通路诱导激活细胞EMT程序,说明在上皮细胞中下调内源的某些自分泌信号抑制因子可诱导细胞启动EMT程序,从而导致HF。同时发现Wnt蛋白参与EMT过程时,β-cat可能并不在核内积累产生Wnt信号,包括Wnt5A、Wnt11在内的多种Wnt蛋白可能是通过NWSP信号发生转导。是否在某些情况下,一种Wnt蛋白的下游信号可以是CWSP信号,也可以是NWSP信号,这使有些EMT的产生可能是通过Wnt二者通路共同诱导的,尚有待于进一步研究。
[1]Ge WS,Wang YJ,Wu JX,et al.β-catenin is overexpressed in hepatic fibrosis and blockage of Wnt/β-catenin signaling inhibits hepatic stellate cell activation[J].Mol Med Rep,2014,4(1):235-241.
[2]Madankumar P,Naveenkumar P,Manikandan S,et al.Morin ameliorates chemically induced liver fibrosis in vivo and inhibits stellate cell proliferation in vitro by suppressing Wnt/β-catenin signaling[J].Toxicol Appl Pharmacol,2014,3(20):44-49.
[3]Zeisberg M,Yang C,Martino M,et al.Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition[J].J Biol Chem,2007,6(11):2337-2347.
[4]Firrincieli D,Boissan M,Chignard N.Epithelialmesenchymal transition in the liver[J].Gastroenterol Clin Biol,2010,34(10):523-528.
[5]Jian YC,Wang JJ,Dong S,et al.Wnt-induced secreted protein 1/CCN4 in liver fibrosis both in vitro and in vivo[J].Clin Lab,2014,60(1):29-35.
[6]Sun X,He Y,Ma TT,et al.Participation of miR-200a in TGF-β1-mediated hepatic stellate cell activation[J].Mol Cell Biochem,2014,388(1-2):11-23.
[7]Miao CG,Yang YY,He X,et al.Wnt signaling in liver fibrosis:progress,challenges and potential directions[J].Biochimie,2013,95(12):2326-2335.
[8]Arellanes-Robledo J,Reyes-Gordillo K,Shah R,et al.Fibrogenic actions of acetaldehyde are β-catenin dependent but Wingless independent:a critical role of nucleoredoxin and reactive oxygen species in human hepatic stellate cells[J].Free Radic Biol Med,2013,12(65):1487-1496.
[9]Shih YL,Hsieh CB,Yan MD, et al.Frequent concomitant epigenetic silencing of SOX1 and secreted frizzled-related proteins(SFRPs)in human hepatocellular carcinoma[J].J Gastroenterol Hepatol,2013,28(3):551-559.
[10]Bi WR,Yang CQ,Shi Q.Transforming growth factor-β1 induced epithelial-mesenchymal transition in hepatic fibrosis[J].Hepatogastroenterology,2012,59(118):191-194.
[11]Awuah PK,Rhieu BH,Singh S,et al.β-Catenin loss in hepatocytes promotes hepatocellular cancer after diethylnitrosamine and phenobarbital administration to mice[J].PLoS One,2012,7(6):397-411.
