AECOPD与COPD合并CAP的差异队列研究
2014-10-19汪志方徐金富罗艳蓉黄蓓洁邱淑佳
汪志方,徐金富,罗艳蓉,黄蓓洁,邱淑佳
(1.同济大学附属杨浦医院呼吸科,上海 200090;2.同济大学附属肺科医院呼吸科,上海 200433)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气流受限为特征的疾病,其气流受限呈进行性发展,是一种严重危害人类健康的常见病、多发病,在中国40岁以上人群中COPD发病率高达8.2%[1]。社区获得性肺炎(community-acquired pheumonia,CAP)是指在医院外罹患的感染性肺实质(含肺泡壁,即广义的肺间质)炎症[2],在COPD患者中并不少见。慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)主要的症状是咳嗽、咳痰和气促的加重,与COPD患者合并CAP症状类似。但二者并不是同一类疾病,在临床表现、体征以及实验室检查等方面存在明显不同。将COPD患者的肺炎误认为AECOPD,易导致对COPD患者病情的误判,从而导致治疗的偏移。区分二者有利于临床上对患者的分类和积极处理。本研究通过对215例COPD患者的资料进行回顾性研究,分析AECOPD与COPD合并CAP之间的差异,为COPD的个体化治疗提供依据。
1 资料与方法
1.1 一般资料
本研究纳入2011年8月至2013年8月同济大学附属杨浦医院呼吸内科收治入院COPD患者215例,排除合并肺部肿瘤、肺栓塞、肺水肿、肺结核、血液系统疾病、有创机械通气、其他部位存在感染、入住ICU、90 d内曾经住院或者长期居住护理院的患者。所有COPD、AECOPD患者均按照2011版GOLD指南进行诊断;COPD合并肺炎按照中华医学会呼吸分会肺炎的定义进行确认。共215例纳入分析,包括男性176例,女性39例,其中109例为AECOPD,106例为COPD合并CAP。所有纳入病例均有稳定期肺功能分级及2011GOLD慢阻肺综合评估。
1.2 研究方法
记录所有患者性别、年龄、入院时体温、黄脓痰、住院天数等基本情况,及实验室检查指标。各项实验室检查指标均取治疗前标本,包括血白细胞、血红蛋白、白蛋白、降钙素原(procalcitonin,PCT)、C反应蛋白(C-reactive protein,CRP)、内毒素、白介素6(interleukin 6,IL-6)、纤维蛋白原等。调取患者门诊半年内稳定期肺功能,或本次住院症状完全缓解后肺功能,记录为患者稳定期肺功能。CAP的入选标准:符合CAP的诊断标准,影像学诊断依靠肺部CT,所有肺部CT均在入院前或者入院后24 h内采集。本研究以患者入院的即刻开始为研究的起点,以患者好转或痊愈出院为研究的终点。
1.3 统计学处理
使用SPSS 17.0统计软件包进行数据处理,符合正态分布的计量资料均用描述,计数资料使用例数表示,组间差异应用t检验及卡方检验,各项指标之间相关性采用双变量相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
共215名患者纳入本研究,平均年龄(76.6±10.1)岁。其中,AECOPD组109名患者,平均年龄(74.2±11.3)岁,COPD合并CAP组106名患者平均年龄(79.0±8.1)岁;AECOPD组8例(7.3%)患者伴发热症状,COPD合并CAP组58例(54.7%)患者伴发热症状;AECOPD组患者37例(33.9%)有黄脓痰,COPD合并CAP组患者86例(81.3%)有黄脓痰;AECOPD组平均住院(12.6±3.3)d,COPD合并 CAP组平均住院(15.8±5.0)d;AECOPD组FEV1/FEV1预计值平均值为(49.5±11.4)%,COPD合并CAP组为(38.1±6.5)%,差异均有统计学意义(P<0.05)。
2.2 营养状况
AECOPD患者平均血红蛋白为(136.9±15.4)g/L,COPD合并 CAP组平均血红蛋白为(126.4±21.0)g/L;AECOPD组患者血清白蛋白平均为(37.1±3.8)g/L,COPD合并CAP组血清白蛋白为(32.9±4.2)g/L,差异均有统计学意义(P<0.05)。
2.3 炎性标志物
对两组患者的白细胞、PCT、CRP、内毒素、IL-6、纤维蛋白原进行比较,COPD合并CAP组患者白细胞、PCT、CRP、IL-6及纤维蛋白原水平高于AECOPD组,差异有统计学意义(P<0.05),见表1。
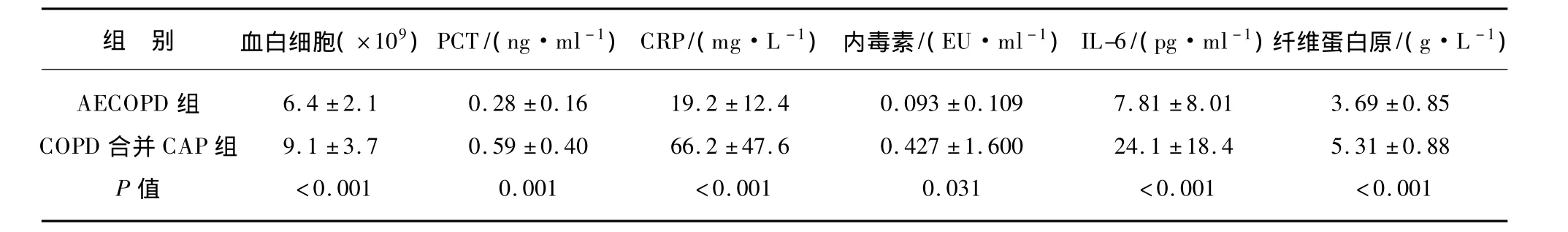
表1 两组患者的炎性标志物水平Tab.1 Levels of inflammatory markers in two groups
2.4 各项指标与住院天数的相关性分析
对所有的患者,将其各项指标与住院天数进行相关性分析。其中年龄、血白细胞、PCT、CRP、IL6、内毒素、纤维蛋白原与住院天数呈显著正相关(P<0.05),而血清白蛋白、血红蛋白、FEV1/FEV1预计值与住院天数呈显著负相关(P<0.05),见表2。
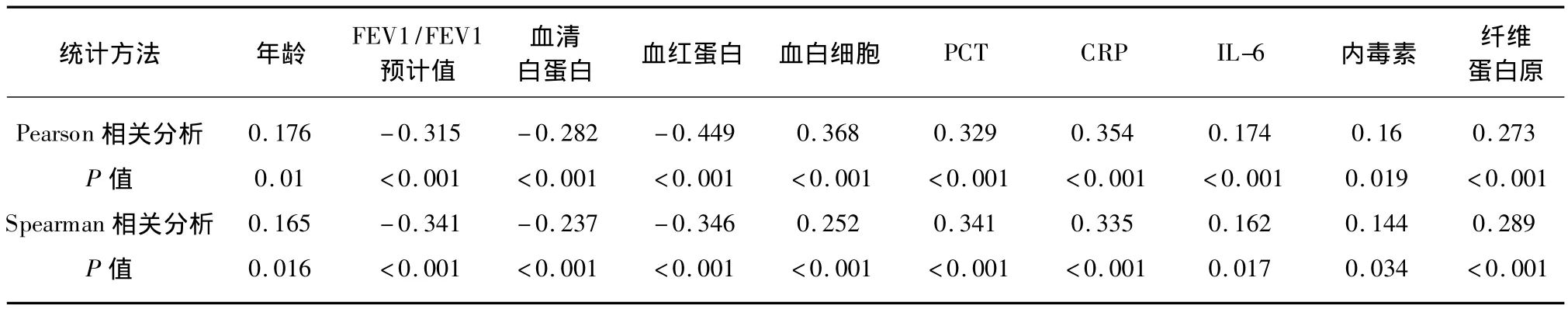
表2 各项指标与住院天数的相关性分析Tab.2 Correlation analysis of indicators with hospitalization days
3 讨 论
COPD是目前常见的慢性疾病,其典型的症状是呼吸困难,咳嗽、咳痰,伴或不伴有喘息,急性加重期COPD患者出现呼吸困难、咳嗽、咳痰、喘息等症状加重。而CAP患者中,存在COPD基础疾病的并不少见,其临床表现亦是相对稳定期咳嗽、咳痰等症状加重。COPD合并肺炎与AECOPD为两种不同的疾病[3]。显然,AECOPD与 COPD合并 CAP症状相似,临床医生难以区分。
本研究中,两组患者在年龄、营养状况、稳定期肺功能上均有明显的差异,COPD合并CAP组患者平均年龄大,血红蛋白及血清白蛋白水平低,FEV1/FEV1预计值低,并且在发热、黄脓痰等症状上差异有统计学意义,与既往研究符合[4]。
本研究选择了血白细胞、CRP、PCT、IL-6、内毒素及纤维蛋白原为炎性指标。白细胞、CRP是经典的炎性标志物,而IL-6、PCT,目前有越来越多的研究证明了其与COPD的相关性[5-6]。内毒素是革兰阴性菌细胞壁的脂多糖,与革兰阴性菌的感染相关[7]。纤维蛋白原以往被作为凝血功能的检验指标,但近年的研究证明纤维蛋白原与感染及肺功能相关[8]。本研究显示,COPD合并 CAP组感染性指标普遍较AECOPD组高,差异均有统计学意义。这也进一步说明,尽管COPD合并 CAP与AECOPD有很多的相似性,但并不是一类疾病,前者感染性指标更高,后者除了细菌感染以外,存在其他诱因[9]。
对于两组患者的转归,本研究选用的指标是住院天数。COPD合并CAP组较AECOPD组住院天数长。而且本研究进行了各项指标和住院天数的相关性分析,结果显示,年龄与住院天数呈正相关性,FEV1/FEV预计值、血红蛋白、血清白蛋白与住院天数呈负相关。显然,高龄、较差的肺功能以及营养状况,患者需治疗的时间以及预后较差,与既往的研究符合[10]。炎性标志物血白细胞、PCT、CRP、内毒素、纤维蛋白原与住院天数均呈正相关性,提示这些炎性标志物可作为患者预后的判断的因素。炎性指标高,与细菌感染程度密切相关,影响患者住院天数,与目前研究符合[11]。尽管COPD合并CAP组患者住院时间更长,但是仍然需要关注患者基础状况、炎性标志物水平,针对不同的个体,选择合适的初始治疗方案。
对于COPD合并CAP的患者,抗感染治疗显然是必要的。目前的争论在于,AECOPD患者是否需要抗感染治疗。依据痰培养结果至少需要48 h,无法满足临床工作的需要,判断是否存在感染,炎性指标显然更加迅速。相对于特异性较差的血常规、CRP等指标,PCT是目前公认的与细菌感染相关性高的指标[12],其临界值通常为 0.5 ng/ml[13],临床工作中可根据PCT水平,结合具体症状,如脓性痰、呼吸困难、机械通气等[1],考虑是否使用抗感染药物。这显然会改善目前临床上广泛存在的抗生素滥用问题。
综上所述,本研究显示,AECOPD与COPD合并CAP尽管在临床症状有相似,但仍然是完全不同的两种疾病状态,存在较多的不同,如营养状况、基础肺功能、症状、炎性标记物水平以及住院天数。针对COPD合并CAP患者,营养状况差、基础肺功能差,炎性指标更高,除了支持治疗以外,抗感染治疗显然优先考虑。而对于单纯的AECOPD患者,需根据其具体情况来判定是否需要抗感染治疗,这不仅仅关系抗菌药物的合理应用,并且对于COPD患者急性加重期的规范化管理至关重要。COPD患者的好转快慢及转归与年龄、肺功能状况、营养及多种炎性标志物等因素相关。
[1]中华医学会呼吸病分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36:255-264.
[2]中华医学会呼吸病学会.社区获得性肺炎的诊断与治疗指南[J].中华结核和呼吸杂志,2006,29:651-655.
[3]Celli BR,Barnes PJ.Exacerbations of chronic obstructive pulmonary disease[J].Eur Respir J,2007,29(6):1224-1238.
[4]Huerta A,Crisafulli E,Menéndez R,et al.Pneumonic and nonpneumonic exacerbations of COPD:inflammatory response and clinical characteristics[J].Chest,2013,144(4):1134-1142.
[5]Young RP, Hopkins RJ. Interleukin-6 and statin therapy:potential role in the management of COPD[J].Respir Res,2013,14:74.
[6]Wróblewski T,Marcisz C.Procalcitonin as a biomarker of acute lower respiratory tract infections[J].Expert Opin Med Diagn,2009,3(1):67-79.
[7]徐修礼,张建芳,樊新,等.革兰阴性杆菌感染患者血浆内毒素测定的临床意义[J].中华医院感染学杂志,2005,15(3):351-353.
[8]Shibata Y,Abe S,Inoue S,et al. Relationship between plasma fibrinogen levels and pulmonary function in the Japanese population:the Takahata study[J].Int J Med Sci,2013,10(11):1530-1536.
[9]Perotin JM,Dury S,Renois F,et al.Detection of multiple viral and bacterial infections in acute exacerbation of chronic obstructive pulmonary disease:a pilot prospective study[J].J Med Virol,2013,85(5):866-873.
[10]Günay E,Kaymaz D,Selçuk NT,et al.The effect of nutritional status in individuals with COPD Undergoing pulmonary rehabilitation[J].Respirology,2013,18(8):1217-1222.
[11]Thomsen M,Ingebrigtsen TS,Marott JL,et al.Inflammatory biomarkers and exacerbations in chronic obstructive pulmonary disease[J].JAMA,2013,09(22):2353-2361.
[12]Lee SH,Chan RC,Wu JY,et al.Diagnostic value of procalcitonin for bacterial infection in elderly patients-a systemic review and meta-analysis[J].Int J Clin Pract,2013,67(12):1350-1357.
[13]石岩,刘大为.降钙素原在全身性感染诊治中的研究进展[J].中华内科杂志,2011,50(5):444-446.
