提高LIPOFECTAMINE2000对PC12细胞转染效率的研究
2014-10-17邱烨
邱 烨
浙江省湖州市南浔区中西医结合医院检验科,浙江湖州 313009
PC12细胞诱导产生的神经轴突能作为研究神经退行性疾病及脊柱损伤的研究模型[1-2],也是研究神经内分泌试验的模型[3]。细胞转染技术是分子生物学及基因工程关键步骤之一[4],也是体外研究神经细胞特定基因表达调控及遗传病基因治疗的重要技术之一[5],但常用的阳离子脂质体转染试剂对PC12细胞转染效率低[1,6-8]。 本研究参照相关文献[8-10],通过在阳离子脂质体转染过程中加入氯喹及亚精胺,同时调整阳离子脂质体转染试剂与DNA用量的比例和转染时间,实现提高PC12细胞转染率,且未影响细胞的正常功能,为PC12细胞进行神经细胞基因功能及开发遗传病治疗方案等生物学研究提供了一种安全、廉价的新方法。
1 材料与方法
1.1 试剂与仪器
主要试剂:PC12 细胞(American Culture Collection),RPMI1640 培养基 (Sigma 公司),Lipofectamine2000(Invitrogen 公司),FuGENE HD (Roche 公司),PolyJet(Signagen Laboratoies 公 司 ),Lipofectamine LTX and Plus(Invitrogen 公司),pEGFP-N1(BD Biosciences 公司),氯喹(Sigma 公司),亚精胺(Sigma 公司),Ⅰ型牛胶原蛋白 (BD Biosciences公司),神经生长因子(NGF)(Peprotech 公司),噻唑蓝(MTT)(Sigma 公司)。Axiovert 100 M倒置荧光显微镜 (Carl Zeiss公司),MetaMorph图像分析处理软件 (Molecular Devices公司),EL808 酶标仪(Bio-Tek Instrument公司)。
1.2 方法
1.2.1 PC12细胞培养 PC12细胞培养参照相关文献[11-12],细胞密度至 70%左右时进行传代,传至 2~3代的PC12细胞备用。
1.2.2 PC12细胞转染 PC12细胞培养参照文献[11]的方法,转染的基本步骤[8]:将 4 μL Lipofectamine2000转染试剂加入75 μL不含血清的新鲜RPMI 1640培养基中混匀,同时将1 μg质粒 pEGFP-N1加入150 μL不含血清的新鲜RPMI 1640培养基中孵育5 min后将两溶液混匀,室温静置30 min,另将含(或不含)36 mmol/L氯喹、32 μmol/L亚精胺的无血清 RPMI 1640培养基75 μL加入上述阳离子脂质体/DNA复合物,移去细胞培养液后加入以上阳离子脂质体/DNA复合物,培养4 h后再弃去上述含阳离子脂质体/DNA复合物的细胞培养液,换成新鲜含5%胎牛血清、10%小牛血清的 RPMI 1640培养基,每室 300 μL。再培养48 h,然后在Axiovert 100 M倒置荧光显微镜,物镜40×和目镜10×放大倍数下拍照及计数分析。见图1(封三)。
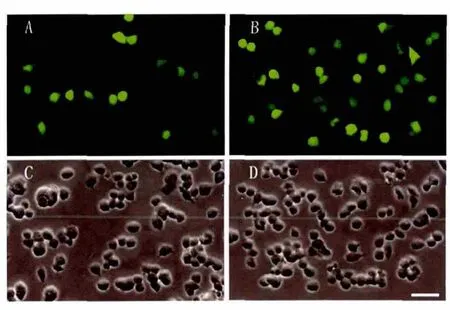
图1 本法与Lipofectamine 2000法对PC12细胞增强绿色荧光蛋白表达比较
1.2.3 四甲基偶氮唑盐(MTT)试验 参照文献[1]方法,用MTT试验分别测定对照孔、在转染过程中加(或不加)氯喹与亚精胺孔的PC12细胞活性。
1.2.4 PC12细胞神经轴突生长试验 按文献方法[11],PC12细胞转染48 h后,将细胞培养基换成含1%胎牛血清、含(或不含)100 ng/mL神经生长因子(NGF)的新鲜RPMI 1640培养基,培养5 d后,在倒置荧光显微镜物镜40×和目镜10×放大倍数下拍照及计数分析见图2(封三)。
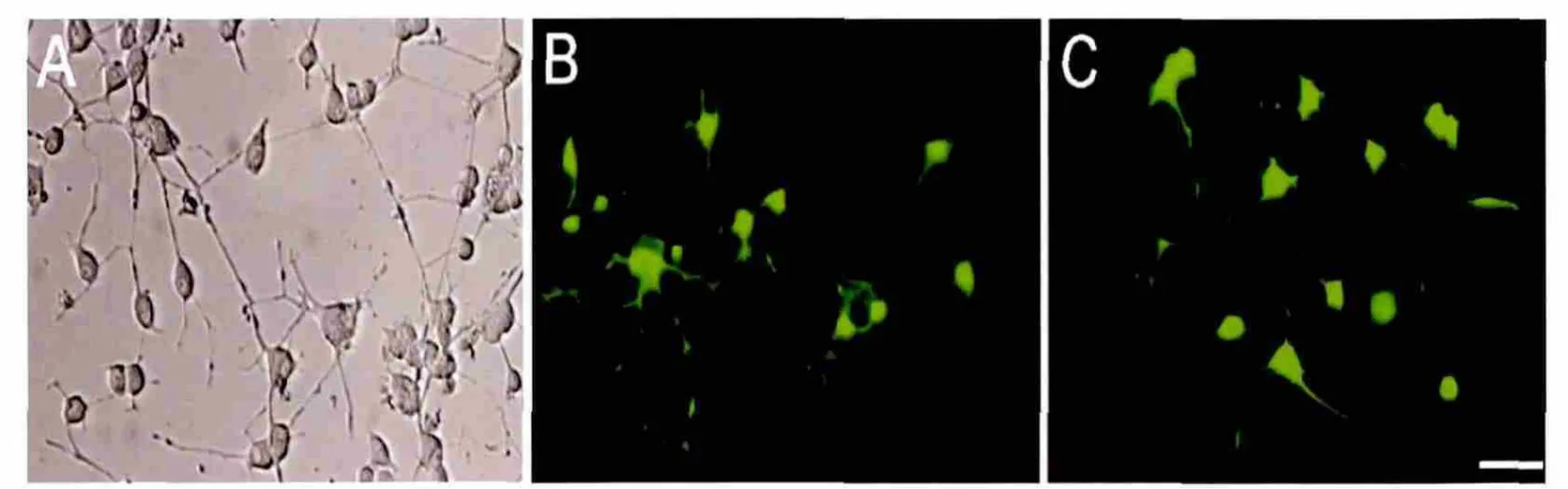
图2 本法与Lipofectamine 2000法对PC12细胞神经轴突生长比较
1.2.5 转染效率与神经轴突判定及统计 PC12细胞转染48 h后,计数绿色荧光蛋白阳性的细胞占细胞总数的百分比即为转染效率。参照文献方法[11],用Meta Morph图像分析处理软件计数并测量PC12细胞神经轴突的长度。
1.3 统计学方法
采用统计软件SPSS 15.0对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 DNA与Lipofectamine 2000的比例对 PC12细胞转染效率的影响
当质粒 pEGFP-N1的用量为 1 μg时,Lipofectam ine2000用量相对较低时,PC12细胞转染效率与Lipofectamine2000用量呈正相关,但随着Lipofectam ine2000用量超过 4 μL,其毒副作用逐渐明显,导致PC12细胞转染效率逐步降低,且绿色荧光蛋白阳性细胞的死亡率明显增加,本研究结果表明,对PC12细胞转染,DNA∶Lipofectamine2000 用量比例应控制在 1∶4。
2.2 转染时间对PC12细胞转染效率的影响
当转染时间分别为 1、2、4、8、24 h 时,PC12 细胞转染率分别为 35.5%、37.9%、40.5%、40.3%及 38.6%。实验结果表明,在未达到最佳转染时间前,转染效率随转染时间的延长而增加,4 h达到最大转染效率,但在超过4 h后转染时间后,转染效率则会缓慢降低。
2.3 氯喹、亚精胺用量对PC12细胞转染效率的影响
随着氯喹、亚精胺加入浓度的增加,PC12细胞转染效率也随之增加,当氯喹、亚精胺加入终浓度分别增至 9 μmol/L和 8 μmol/L时,PC12细胞的转染效率最高,转染效率为40.5%。
2.4 氯喹、亚精胺对PC12细胞活性的影响
PC12细胞在转染过程中加入终浓度为9 μmol/L氯喹与8 μmol/L亚精胺前、后MTT试验吸光度(590 nm)分别为(0.466±0.042)与(0.451±0.038),差异无统计学意义(P>0.05),表明PC12细胞的活性无影响。
2.5 氯喹、亚精胺对PC12细胞神经轴突生长的影响
转染试剂Lipofectamine2000对转染前后的PC12细胞及经NGF诱导后产生的神经轴突长度无影响。氯喹、亚精胺对PC12细胞的神经轴突生长数量与长度无影响;也间接表明在转染过程中加入9 μmol/L氯喹及8 μmol/L亚精胺对PC12细胞的功能无影响。见表1。
表1 氯喹、亚精胺对PC12细胞神经轴突生长的影响(±s)

表1 氯喹、亚精胺对PC12细胞神经轴突生长的影响(±s)
方法 神经轴突数量(个) 神经轴突长度(μm)Lipofectamine 20002.41±0.1246.6±7.12本法2.48±0.1144.9±6.95 P值 >0.05>0.05
2.6 本法与4种常用脂质体转染试剂对PC12细胞转染效率的比较
本文以pEGFP-N1为报告基因,用本法与常用的FuGENE、PolyJet、Lipofectamine LTX and Plus、Lipofectamine2000等4种脂质体转染试剂对PC12细胞转染效率进行了比较,结果:本法的PC12细胞转染率为40.5%,其它四种脂质体转染试剂对PC12细胞转染效率分别为10.5%、8.6%、11.8%及15.3%。本法对PC12细胞的转染效率明显高于其他4种脂质体转染法,差异有高度统计学意义(P<0.01)。见图3。
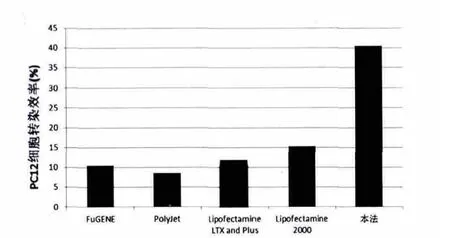
图3 本法与4种常用脂质体转染试剂对PC12细胞转染效率的比
3 讨论
PC12细胞具有类似神经细胞的形态学改变及生理学特征而作为神经研究的模式细胞[1]。氯喹、亚精胺能明显提高PC12细胞的转染效率,且不影响PC12细胞的活性与正常功能,与文献报道一致[1,8]。
氯喹是一种疏水性的弱碱,在PC12细胞转染过程中能进入细胞吞噬溶酶体,在酸性环境下被质子化,随着质子化的氯喹在吞噬溶酶体的累积,吞噬溶酶体开始肿胀,其包膜稳定性破坏,导致阳离子脂质体/DNA复合物释放入细胞浆,同时,氯喹抑制吞噬溶酶体酸化与成熟,阻止阳离子脂质体/DNA复合物在溶酶体中的降解[8-9],转染过程中氯喹能提高PC12细胞转染效率与上述氯喹的作用机制有关。亚精胺是一种多胺类制剂能通过增强DNA的复制与转录作用来提高PC12细胞转染效率,同时能增强报告基因的表达强度[8]。
当 DNA:Lipofectamine2000 比 小 于 1∶4 时 ,Lipofectamine2000用量相对过多,N∶P比增加,阳离子脂质体/DNA复合物表面所带的净正电荷增多,PC12转染效率也随之增加[6],但对 PC12细胞毒性作用也随之增强,这与部分结合的Lipofectamine从阳离子脂质体/DNA复合物中分离,引起Lipofectamine内化而损伤细胞或破坏带负电荷的细胞膜而影响PC12细胞的状态,PC12细胞转染效率与细胞活性也会降低[1],及时更换RPMI1640培养基可以减少其毒性作用。
本文得到美国伊利诺斯州立大学芝加哥分校医学院Beatrice Y.J.T.Yue教授指导,特此致谢!
[1]Lee JH,Ahn HH,Kim KS,et al.Polyethyleneimine-mediated gene delivery into rat pheochromocytoma PC-12 cells[J].J Tissue Eng Regen Med,2008,2:288-295.
[2]Ilarraza-Lomeli R,Cisneros-Vega B,Cervantes-Gonez J,et al.Dp71,utrophin and beta-dystroglycan expression and distribution in PC12/L6 cell cocultures[J].Neuroreport,2007,18(16):1657-1661.
[3]Westerink RH,Ewing AG.The PC12 cell as model for neurosecretion[J].Acta Physiol,2008,192(2):273-285.
[4]Kamata H,Yagisawa H,Takahashi1 S,and Hirata H.Amphiphilic peptides enhance the efficiency of liposomemediated DNA transfection[J].Nucleic Acids Research,1994,22(3):536-537.
[5]Wolff JA,Rozema DB.Breaking the bonds:non-viral vectors become chemically dynamic[J].Mol Ther,2008,16(1):8-15.
[6]Xiang G,Keun-Sik K,Dexi L.Nonviral gene delivery:what we know and what is next[J].AAPS J,2007,9(1):92-104.
[7]Bergen JM,Park IK,Horner PJ,et al.Nonviral approaches for neuronal delivery of nucleic acids[J].Pharm Res,2008,25(5):983-998.
[8]Wong-Baeza C,Bustos I,Serna M,et al.Membrane fusion inducers,chloroquine and spermidine increase lipoplex-mediated gene transfection[J].Biochem Biophys Res Commun,2010,396:549-554.
[9]Khalil IA,Kogure K,Akita H,et al.Uptake pathways and subsequent intracellular trafficking in nonviral gene delivery[J].Pharmacol Rev,2006,58(1):32-45.
[10]Averill-Bates DA,Ke Q,Tanel A,et al.Mechanism of cell death induced by spermine and amine oxidase in mouse melanoma cells[J].Int J Oncol,2008,32:79-88.
[11]Koga T,Xiang S,Park JS,et al.Differential effects of myocilin and optineurin,two glaucoma genes on neurite outgrowth[J].Am J Pathol,2010,176(1):343-352.
[12]Park BC,Tibudan M,Samaraweera M,et al.Interaction between two glaucoma genes,optineurin and myocilin[J].Genes Cells,2007,12:969-979.
[13]Honma K,Mishima E,Sharma A.Role of Tannerella forsythia NanH sialidase in epithelial cell attachment[J].Infect Immun,2011,79(1):393-401.
