邻苯二甲酸二(2-乙基己)酯(DEHP)和邻苯二甲酸单乙基己基酯(MEHP)长期暴露对海洋青鳉(Oryzias melastigma)内分泌干扰效应的评价
2014-09-22叶婷康美黄乾生董四君
叶婷,康美,黄乾生,董四君
中国科学院城市环境研究所 中国科学院城市环境与健康重点实验室,厦门361021
邻苯二甲酸二(2-乙基己)酯(DEHP)和邻苯二甲酸单乙基己基酯(MEHP)长期暴露对海洋青鳉(Oryzias melastigma)内分泌干扰效应的评价
叶婷,康美,黄乾生#,董四君*
中国科学院城市环境研究所 中国科学院城市环境与健康重点实验室,厦门361021
为探讨邻苯二甲酸二(2-乙基己)酯(DEHP)和邻苯二甲酸单乙基己基酯(MEHP)长期暴露对海水生物的内分泌干扰效应及机制,将孵化后1周的海洋青鳉(Oryzias melastigma)分别暴露于DEHP(0.1 mg·L-1和0.5 mg·L-1)和MEHP(0.1 mg·L-1和0.5 mg·L-1)6个月。结果显示:DEHP显著增加了雌性和雄性海洋青鳉的肝指数,而MEHP只在高剂量时显著增加雄性青鳉的肝指数。对于雌性青鳉,DEHP暴露后肝脏雌激素相关基因ERα、ERβ、ERγ、VTG1、VTG2、ChgH和ChgL的表达水平显著上调,而对于雄性青鳉,DEHP暴露后,只有肝脏ERβ的表达水平显著上调。相比之下,MEHP暴露对雌性和雄性青鳉肝VTG和Chg基因表达无显著影响。DEHP激活了雌性和雄性青鳉的肝过氧化物增殖激活受体PPARα和PPARγ,而MEHP只在低剂量时上调了雄性青鳉PPARγ的表达。在雌性和雄性青鳉体内,VTG和Chg的表达与ERα和ERγ的表达显著相关,并且ER与PPAR也显著相关。研究表明,DEHP长期暴露可通过激活肝性激素受体调控肝雌激素响应基因(VTG和Chg)和过氧化物增殖激活受体(PPARα和PPARγ)的表达而对海洋青鳉产生内分泌干扰效应,并且显示出性别特异性。MEHP对海洋青鳉的内分泌干扰效应弱于DEHP。
海洋青鳉(Oryzias melastigma);邻苯二甲酸二(2-乙基己)酯(DEHP);邻苯二甲酸单乙基己基酯(MEHP);雌激素受体(ER);卵黄蛋白原(VTG);卵膜蛋白原(Chg);过氧化物增殖激活受体(PPAR)
邻苯二甲酸二(2-乙基己)酯(di(2-ethylhexyl) phthalate, DEHP)是一种新兴的内分泌干扰化合物,常添加于聚氯乙烯材料增加可塑性,普遍应用于食品包装材料、建筑装饰材料、儿童玩具和医疗器械等产品中,DEHP也作为起云剂添加于各种果汁、果冻和饮料等食品中[1]。DEHP与塑料材料是以普通的分子间作用力结合,容易从塑料材料中释放进入环境[2]。邻苯二甲酸盐的浓度在表层海水、海水沉积物和海水生物中分别高达300 μg·L-1、3 μg·g-1和4.07 ng·g-1[3]。高脂溶性使DEHP大量蓄积在鱼体组织从而引起毒性效应[4]。很多哺乳动物研究表明DEHP具有生殖毒性效应,如导致胚胎畸形、睾丸萎缩和精子畸形等[1]。DEHP影响了一些淡水生物的生殖发育,如抑制雌性日本青鱂鱼(Oryzias latipes)卵巢的发育[5],降低雌性斑马鱼(Danio rerio)的产卵量[6],降低雄性斑马鱼受精率[7]等。斑马鱼肝细胞研究显示DEHP具有雌激素活性,并表现出性别差异[8]。哺乳动物研究结果显示邻苯二甲酸单乙基己基酯(mono(2-ethylhexyl)phthalate, MEHP)作为DEHP主要代谢产物,可通过干扰固醇类激素生物合成从而引起生殖毒性[9]。很多哺乳动物研究显示DEHP的代谢产物MEHP的毒性效应强于DEHP,并且DEHP产生的毒性效应主要是由其代谢产物引起的[1]。然而由于哺乳动物与水体脊椎动物的生理特性有很大差异,且海水环境和淡水环境差别较大,若要明确海水环境中DEHP和MEHP对海水生物毒性效应,需应用一种典型的海洋生物进行评估,目前DEHP和MEHP对海水生物的毒性毒理研究还很少。海洋青鳉(Oryzias melastigma)世代周期短,性别容易区分,对污染物干预敏感等优势使海洋青鳉越来越广泛用于海洋生态毒理学研究[10]。
本研究评价了DEHP和MEHP长期暴露对海洋青鳉肝指数的影响,采用荧光定量PCR技术检测内分泌干扰相关基因的mRNA水平,如肝脏性激素受体ERα、ERβ、ERγ和ARα,VTG亚型(VTG1和VTG2),Chg亚型(ChgH和ChgL),以及过氧化物增殖激活受体PPAR亚型(PPARα和PPARγ),并分析性固醇激素受体基因与VTG、Chg和PPAR相关基因之间的关系,以探讨DEHP及其代谢产物MEHP引起海洋青鳉内分泌干扰的分子基础,为海洋污染风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:UNIVERSAL 320R台式(常温/低温)离心机(德国Hettich Zentrifugen公司);ND-1000超微量紫外可见分光光度计(美国Gene Companey Limited公司);Mastercycler® personal PCR仪(德国EPPENDORF公司),Lightcycler 480实时荧光定量PCR仪(瑞士Roche公司)。
试剂:DEHP,优级纯,购于美国Supelco公司,溶于二甲基亚砜(DMSO,优级纯,美国Sigma-Aldrich公司),浓度为1 g·mL-1,将母液用DMSO稀释至0.01 g·mL-1备用;MEHP,优级纯,购于美国AccuStandard公司。将MEHP用DMSO配成0.01 g·mL-1母液备用;RNA提取试剂盒(美国Omega生物技术公司);反转录试剂盒(PrimeScriptTMRT-PCR Kit,宝生物工程(大连)有限公司);SYBR Premix Ex TaqTM试剂盒(宝生物工程(大连)有限公司)。
1.2 海洋青鳉暴露实验
将孵化1周后的健康幼鱼随机分为5组:溶剂(DMSO)对照组,2个DEHP暴露组(0.1 mg·L-1和0.5 mg·L-1),2个MEHP暴露组(0.1 mg·L-1和0.5 mg·L-1),所选暴露浓度参考文献[11],每组设3个重复,每个重复约含50条幼鱼,暴露海水中DMSO终浓度小于1‰(体积分数)。养殖海水体积第1个月每个重复为3 L,第2月至第3月为6 L,第4月至第6月为10 L。1周换3次水,养殖海水为人工海水,盐度30‰,温度(28±1)℃;光/暗周期为14 h∶10 h;用新孵化的丰年虾喂食,每天喂食2次。暴露过程中,记录海洋青鳉的死亡情况,及时捞出死鱼。暴露6个月后,每个重复随机取雌雄鱼各5条分别于冰水中麻醉10秒,擦干,测量体长并称量体重,取肝称重,计算肝指数,肝指数=肝重/(体重-肝重),将5条同性别鱼的肝合并为1个肝样品冻存于-80℃,用于后续RNA提取。
1.3 RT-PCR分析肝脏基因表达变化
采用RNA提取试剂盒提取RNA,提取后采用分光光度法鉴定RNA质量,测定RNA浓度,采用反转录试剂盒进行反转录,获得cDNA。用SYBR Premix Ex TaqTM试剂盒在罗氏480仪器上进行荧光定量PCR反应。用于荧光定量PCR的引物序列见表1,其中雄激素受体α(ARα)的引物是根据笔者前期研究中对Illumina RNA测序获得的序列而设计[12]。采用18S rRNA作为内参基因,用2-ΔΔCT方法来定量基因表达的相对变化倍数[13]。
1.4 数据分析
所有基因表达的实验数据采用平均值±标准误差表示。采用SPSS16.0软件进行单因素方差分析(One-Way AVONA)和Turkey’s检验。用斯皮尔曼秩相关分析方法分析肝脏性固醇激素受体基因与其他基因表达水平之间的相关关系。置信水平p<0.05时差异显著,置信水平p<0.01时差异极显著.
2 结果(Results)
2.1 DEHP和MEHP对海洋青鳉生长状况及肝指数的影响
在暴露过程中,DEHP和MEHP对海洋青鳉的体长、体重和存活情况无显著影响。如图1所示,与溶剂对照组相比,DEHP暴露显著增加了雌性和雄性青鳉的肝指数。只有高剂量MEHP处理显著增加雄性青鳉肝指数。可见DEHP对肝指数的影响强于MEHP。

表1 用于实时荧光定量PCR分析的引物序列Table 1 Primers used in the real-time quantitative RT-PCR analysis
注:a引物信息参考文献[14];b引物信息参考文献[15]。
Note: a, the primer information were according to reference [14]; b, the primer information were according to reference [15].
2.2 DEHP和MEHP对海洋青鳉肝脏基因表达的影响
DEHP和MEHP对海洋青鳉肝脏性固醇激素受体相关基因表达的影响具有性别特异性。如表2所示,对于雌性青鳉,相对溶剂对照组,DEHP暴露显著上调了ERα基因表达水平(p<0.05),低剂量DEHP显著上调了ERβ和ERγ基因表达水平(p<0.01),而MEHP只在低剂量时显著上调了ERβ基因表达水平(p<0.05),低剂量MEHP和高剂量DEHP显著下调了雄激素受体ARα的表达(p<0.05)。然而对于雄性青鳉,相对溶剂对照组,只有低剂量DEHP和MEHP暴露显著上调了ERβ基因表达水平(p<0.05),DEHP和MEHP对ERα、ERγ和ARα基因表达无显著性影响(p>0.05)。
如表2所示,DEHP和MEHP对海洋青鳉肝脏雌激素相关基因VTG1、VTG2、ChgH和ChgL表达的影响也显示出性别特异性。对于雌性青鳉,相对溶剂对照组,DEHP暴露显著上调了VTG1、VTG2、ChgH和ChgL的基因表达水平(P<0.05),而MEHP对这些基因的表达无显著影响(p>0.05)。对于雄性青鳉,相对溶剂对照组,MEHP暴露显著下调了ChgL表达水平(p<0.05),DEHP和MEHP对VTG1、VTG2和ChgH的基因表达无显著性影响。
如表2所示,DEHP和MEHP对海洋青鳉过氧化物增殖激活受体PPARα和PPARγ基因表达的影响也显示了性别特异性。DEHP暴露上调了雌性和雄性青鳉PPARα基因的表达(p<0.05),而MEHP对PPARα基因的表达无显著影响(p>0.05)。低剂量的DEHP显著上调了雌性青鳉PPARγ基因表达(p<0.05)。对于雄性青鳉,DEHP暴露和低剂量MEHP显著上调了PPARγ基因表达(p<0.05)。

表2 DEHP和MEHP对海洋青鳉肝组织内分泌相关基因表达水平的影响Table 2 Effects of DEHP and MEHP on the relative expression levels of endocrine-related genes in hepatic tissue of O. melastigma
注:与对照组相比,* p<0.05、** p<0.01。
Note: * p<0.05, ** p<0.01, compared with the control.
2.3 肝脏性固醇激素受体与VTG、Chg及PPAR基因表达之间的关系
雌性和雄性青鳉肝脏性固醇激素受体和其他基因之间存在相互关系。如表3所示,对于雌性青鳉,肝雌激素受体ERα与ERγ存在显著的正相关关系(p<0.05),并且ERα与VTG1、VTG2和ChgH显著正相关(p<0.05),ERγ与VTG1、VTG2、ChgH和ChgL极显著正相关(p<0.01),ERα和ERγ与PPARα和PPARγ显著正相关,且ERβ和ARα与VTG和Chg之间不存在显著相关关系。对于雄性青鳉,ERα与ERβ、ERγ、VTG1、VTG2、ChgH和ChgL显著相关(p<0.05),ERγ与VTG1、VTG2、ChgH和ChgL极显著相关(p<0.01),ERα和ERγ与PPARα显著正相关。与雌性青鳉不同的是,ERβ与PPARα和PPARγ显著正相关,并且ARα与VTG2之间存在显著相关关系。
3 讨论(Discussion)
3.1 DEHP和MEHP对海洋青鳉肝指数的影响
肝脏是鱼体卵黄蛋白原VTG和卵膜蛋白原Chg合成的主要场所,VTG和Chg是卵巢发育的重要蛋白,研究显示肝指数(HSI)随着VTG的增加而增加[16]。所以肝脏是一个与内分泌调节相关的重要器官,肝指数普遍用作指示内分泌干扰效应的指标。本研究结果显示,DEHP增加了雌性和雄性海洋青鳉的肝指数。一些研究结果显示,DEHP等雌激素化合物主要增加了雄鱼的肝指数,对雌鱼肝指数无显著影响[17-19]。这可能是因为海水环境影响了污染物的物理化学性质,且所选鱼种的生理特性也有差异。研究显示盐度会增强污染物在生物体内的蓄积能力,从而影响污染物对生物体的毒性效应[20]。所以笔者推测与淡水生物相比,DEHP在海洋青鳉体内的蓄积可能增强了,进而增强了DEHP对肝脏的影响。但也不能排除水生生物的物种差异的原因,具体机制还有待进一步探究。本研究结果还显示,与DEHP相比,MEHP对肝指数的影响较弱,MEHP只有在高剂量时才会增加雄性青鳉的肝指数,而对雌鱼的肝指数无显著影响。而且研究还发现MEHP只上调了雌雄青鳉ERβ和雄性青鳉PPARγ表达,下调了雌性青鳉ARα和雄性青鳉ChgL表达。这均说明MEHP对海洋青鳉产生的内分泌干扰效应较弱。MEHP是DEHP的主要代谢产物,故笔者推断DEHP对海洋青鳉的内分泌干扰效应可能主要来自DEHP本身,其代谢产物MEHP有较弱的内分泌干扰作用。但是这些结论的证实还需要进行更深入的研究。
3.2 DEHP和MEHP对海洋青鳉肝雌激素响应基因的影响
卵生脊椎动物卵母细胞的生长需要吸收卵黄前体蛋白,主要是在卵子发生的卵黄生成阶段产生的卵黄蛋白原(VTG)和低密度脂蛋白,在雌鱼体内,这些蛋白在下丘脑-垂体-性腺-肝脏轴调控下主要在肝脏中合成。环境内分泌干扰化合物能干预性激素如雌二醇和睾酮的合成,雌二醇随血液流向肝脏,激活并结合雌激素受体ER形成二聚化的配体受体复合物,该复合物识别并结合VTG和Chg基因的雌激素响应元素(estrogen responsive element, ERE),从而调控VTG和Chg的转录[21]。在脊椎动物中有3个不同的雌激素受体亚型,硬骨鱼中为ERα、ERβ和ERγ。本研究结果显示,DEHP长期暴露上调了雌性青鳉肝脏ERα、ERβ和ERγ的表达,也同时上调了肝VTG1、VTG2、ChgH和ChgL的表达,所以推测DEHP暴露可能增加了类固醇激素如雌二醇的生物合成,雌二醇结合肝雌激素受体,上调雌激素受体的表达,增加雌激素受体配体复合物的形成,从而增加与VTG和Chg雌激素响应元素的结合,以致增加VTG和Chg的转录。还有可能是由于DEHP有雌激素效应,可以结合雌激素受体而引发下游一系列的变化。雌性青鳉肝性固醇激素受体、VTG和Chg表达的上调会导致肝脏合成更多的卵黄蛋白原和卵膜蛋白原,这可能是导致肝指数增加的原因。根据肝脏性固醇激素受体基因与其他基因表达水平相关分析结果可知,在雌性和雄性青鳉肝脏中ERβ与VTG和Chg基因之间不存在显著相关关系,并且DEHP上调了雄性青鳉鱼肝脏ERβ的表达,对雄性青鳉鱼其余的性固醇激素受体、VTG和Chg的表达均无显著影响,这说明ERβ不是调控VTG和Chg表达的主要性固醇激素受体。DEHP对这些基因表达的影响显示出性别特异性,对雌性青鳉肝脏的影响较强。根据基因表达结果可知,MEHP对雌性青鳉肝ERα、VTG和Chg的表达无显著影响,相比之下DEHP作用较强,这可能是由于DEHP对海洋青鳉的毒性效应强于MEHP,也可能是DEHP代谢成MEHP过程中的一些其他代谢产物如二乙基己醇、二乙基己荃和二乙基己酸等引起的,有报道显示这些代谢产物的毒性强于DEHP[22]。这不同于哺乳动物的研究结果,DEHP对哺乳动物的毒性效应主要是由其代谢产物引起的,代谢产物MEHP的毒性效应强于DEHP[23-24]。有研究报道雄性棘鱼长期暴露于较高浓度的雌激素化合物中,雄激素受体的表达显著下调,该化合物具有抗雄激素能力[25],高剂量DEHP和低剂量MEHP显著下调了雌性青鳉ARα的表达,所以笔者推测DEHP和MEHP在雌性青鳉体内显示了抗雄激素能力。而DEHP和MEHP对雄性青鳉ARα的表达无显著影响,这显示出性别特异性的作用效应。
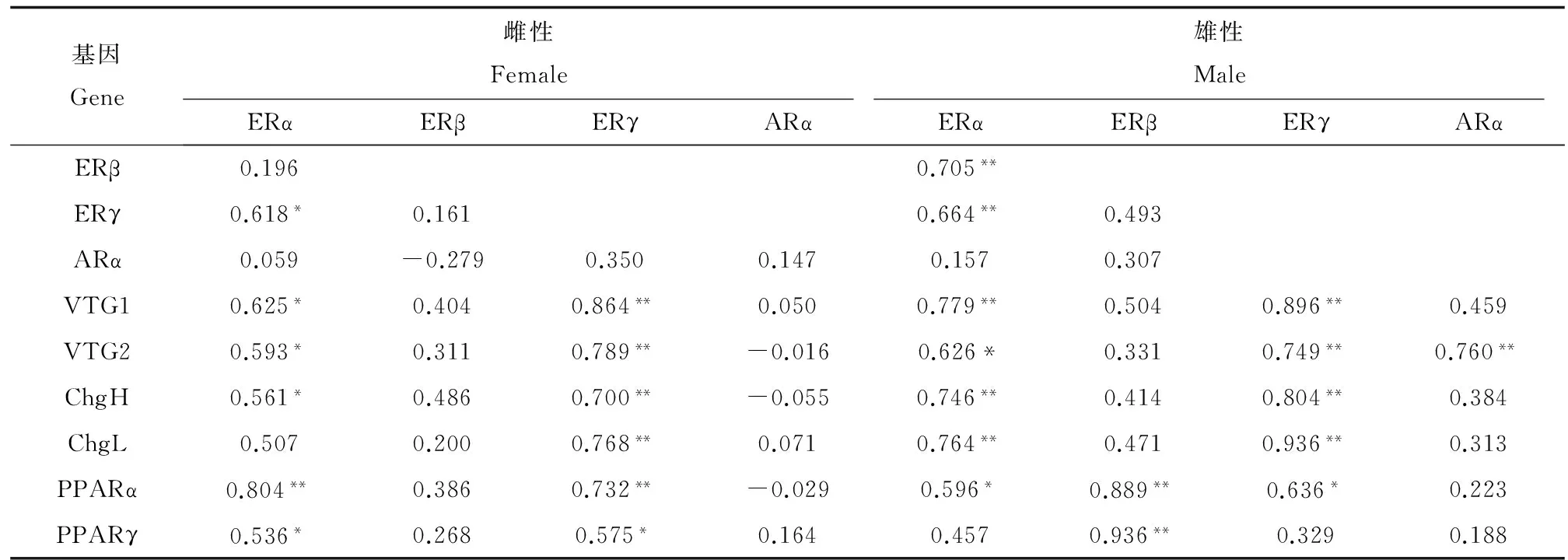
表3 肝脏性固醇激素受体基因与其他基因表达水平斯皮尔曼等级相关系数Table 3 Spearman rank correlation coefficients between hepatic expression levels of steroid hormone receptors and other genes
注:与对照组相比,* p<0.05、** p<0.01。
Note: * p<0.05, ** p<0.01, compared with the control.
3.3 DEHP和MEHP对海洋青鳉肝脏过氧化物增殖激活受体的影响
邻苯二甲酸酯类化合物属于过氧化物酶体增殖激活物,过氧化物酶体增殖激活物引起的一些内分泌干扰效应可能与过氧化物增殖激活受体相关[1]。PPARα的激活是邻苯二甲酸酯类化合物引起包括肝肿胀、诱导过氧化物酶体增殖激活和滑面内质网增殖等肝脏毒性反应的必要条件[26]。本研究结果显示,DEHP激活了雌性和雄性青鳉的肝PPARα,推测DEHP可结合并激活PPARα而引起肝脏毒性效应。然而MEHP对青鳉的肝PPARα转录活性无显著影响,所以我们推测在激活青鳉肝PPARα时,DEHP的作用强于MEHP。PPARγ在脂肪细胞分化和脂质储存过程中起到重要作用,PPARγ的激活可增强脂质吸收,增加脂肪酸合成,促进脂质储存并抑制脂肪分解[27],DEHP和MEHP在低剂量时可激活肝PPARγ,显示了低剂量诱导效应,所以可推测DEHP和MEHP影响了海洋青鳉的能量代谢,从而引起了内分泌干扰效应。胚胎瘤细胞系研究显示MEHP可激活PPAR的3个亚型(PPARα、PPARβ和PPARγ),但主要激活PPARα,DEHP代谢成MEHP过程中产生的代谢产物如二乙基己酸也是PPARα、PPARβ和PPARγ的激活剂[26],但其激活作用较弱。对于人体的研究显示,邻苯二甲酸酯类化合物不会引起过氧化物增殖激活反应,可能的原因是肝PPARα在这些物种中表达水平较低[28]。可见,DEHP和MEHP在不同物种体内可激活不同的PPAR受体,显示了物种差异性。3.4 性固醇激素受体与VTG、Chg及PPAR的相关性
对性固醇激素受体、VTG和Chg的表达进行了秩相关分析,结果显示,在雌性青鳉肝脏中,ERα和ERγ显著相关,在雄性青鳉肝脏中,ERα与ERβ和ERγ显著相关。一些硬骨鱼研究显示ERγ和ERβ紧密相关[29]。在雌性和雄性青鳉体内,VTG和Chg与ERα和ERγ的表达显著相关,与ERβ的表达无显著相关关系,说明肝VTG和Chg的转录主要受到肝ERα和ERγ的调节。而在淡水青鳉中,肝VTG和Chg主要受肝ERα调节,与ERβ、ERγ和ARα不存在相关关系[30]。一项关于金鱼的研究显示3个ER亚型(ERα、ERβ和ERγ)对于雌二醇诱导VTG合成都很重要[31]。这说明ERα、ERβ和ERγ在不同种类的鱼体内对肝VTG和Chg的诱导起到不同的作用。在雄性青鳉体内,VTG2的表达还与ARα有显著的正相关关系,这可能是由于雄激素也涉及了VTG的合成,金鱼和虹鳟鱼研究显示雄激素如睾酮诱导了VTG的转录[32]。本研究发现,ER通路与PPAR通路之间存在相关关系,在雌性青鳉肝脏中,肝ERα和ERγ显著正相关于肝PPARα和PPARγ,而在雄性青鳉肝脏中,肝ERα和ERγ显著正相关于肝PPARα,肝ERβ显著正相关于肝PPARα和PPARγ。乳腺癌细胞研究结果显示,PPAR通路与ER通路是相互关联的,PPAR/RXR异质二聚体可以结合雌激素响应元素而不受ER的影响,另一方面雌激素ERα干预了过氧化物增殖响应元素(PPRE)介导的转录活性,ERα和PPARγ能潜在增强雌激素响应元素和过氧化物增殖响应元素介导的反应[33],所以ER和PPAR通路共同调控了海洋青鳉的内分泌干扰作用。
综上所述,DEHP长期暴露会对海洋青鳉产生内分泌干扰作用,通过激活肝性激素受体调控肝雌激素响应基因(VTG和Chg)和过氧化物增殖激活受体(PPARα和PPARγ)的表达,并且显示出性别特异性。MEHP对海洋青鳉的内分泌干扰效应较弱,DEHP对海洋青鳉的影响强于MEHP。
[1] Magdouli S, Daghrir R, Brar S K, et al. Diethylhexylphtalate in the aquatic and terrestrial environment: A critical review [J]. Journal of Environmental Management, 2013, 127: 36-49
[2] Sioen I, Fierens T, Van Holderbeke M, et al. Phthalates dietary exposure and food sources for Belgian preschool children and adults [J]. Environment International, 2012, 48: 102-108
[3] Liu Y, Guan Y, Yang Z, et al. Toxicity of seven phthalate esters to embryonic development of the abalone Haliotis diversicolor supertexta [J]. Ecotoxicology, 2009, 18(3): 293-303
[4] Huang P C, Tien C J, Sun Y M, et al. Occurrence of phthalates in sediment and biota: Relationship to aquatic factors and the biota-sediment accumulation factor [J]. Chemosphere, 2008, 73(4): 539-544
[5] Kim E J, Kim J W, Lee S K. Inhibition of oocyte development in Japanese medaka (Oryzias latipes) exposed to di-2-ethylhexyl phthalate [J]. Environment International, 2002, 28(5): 359-365
[6] Carnevali O, Tosti L, Speciale C, et al. DEHP impairs zebrafish reproduction by affecting critical factors in oogenesis [J]. PloS One, 2010, 5(4): e10201
[7] Uren-Webster T M, Lewis C, Filby A L, et al. Mechanisms of toxicity of di (2-ethylhexyl) phthalate on the reproductive health of male zebrafish [J]. Aquatic Toxicology, 2010, 99(3): 360-369
[8] Maradonna F, Evangelisti M, Gioacchini G, et al. Assay of Vtg, ERs and PPARs as endpoint for the rapid in vitro screening of the harmful effect of di-(2-ethylhexyl)-phthalate (DEHP) and phthalic acid (PA) in zebrafish primary hepatocyte cultures [J]. Toxicology in Vitro, 2013, 27(1): 84-91
[9] Chauvigné F, Plummer S, Lesné L, et al. Mono-(2-ethylhexyl) phthalate directly alters the expression of Leydig cell genes and CYP17 lyase activity in cultured rat fetal testis [J]. PloS one, 2011, 6(11): e27172
[10] 伍辛泷, 黄乾生, 方超, 等. 新兴海洋生态毒理学模式生物——海洋青鳉(Oryzias melastigma) [J]. 生态毒理学报, 2012, 7(4): 345-353
Wu X L, Huang Q S, Fang C, et al. Oryzias melastigma: A new promising model organism for marine ecotoxicology [J]. Asian Journal of Ecotoxicology, 2012, 7(4): 345-353 (in Chinese)
[11] Staples C A, Adams W J, Parkerton T F, et al. Aquatic toxicity of eighteen phthalate esters [J]. Environmental Toxicology and Chemistry, 1997, 16(5): 875-891
[12] Huang Q, Dong S, Fang C, et al. Deep sequencing-based transcriptome profiling analysis of Oryzias melastigma exposed to PFOS [J]. Aquatic Toxicology, 2012, 120-121: 54-58
[13] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408
[14] Fang C, Wu X L, Huang Q S, et al. PFOS elicits transcriptional responses of the ER, AHR and PPAR pathways in Oryzias melastigma in a stage-specific manner [J]. Aquatic Toxicology, 2012, 106-107: 9-19
[15] Chen X, Li V W T, Yu R M K, et al. Choriogenin mRNA as a sensitive molecular biomarker for estrogenic chemicals in developing brackish medaka (Oryzias melastigma) [J]. Ecotoxicology and Environmental Safety, 2008, 71(1): 200-208
[16] Flippin J L, Huggett D, Foran C M. Changes in the timing of reproduction following chronic exposure to ibuprofen in Japanese medaka, Oryzias latipes [J]. Aquatic Toxicology, 2007, 81(1): 73-78
[17] Wang X, Yang Y, Zhang L, et al. Endocrine disruption by di-(2-ethylhexyl)-phthalate in Chinese rare minnow (Gobiocypris rarus) [J]. Environmental Toxicology and Chemistry, 2013, 32(8): 1846-1854
[18] Wang Y, Zhou Q, Wang C, et al. Estrogen‐like response of perfluorooctyl iodide in male medaka (Oryzias latipes) based on hepatic vitellogenin induction [J]. Environmental Toxicology, 2011, 28(10): 571-578
[19] Kang I J, Yokota H, Oshima Y, et al. Effects of 4-nonylphenol on reproduction of Japanese medaka, Oryzias latipes [J]. Environmental Toxicology and Chemistry, 2003, 22(10): 2438-2445
[20] 黄乾生, 陈亚檞, 方超, 等. 盐度影响全氟辛烷磺酸对海水青鳉(Oryzias melastigma)的毒性[J]. 科学通报, 2013, 58(2): 151-157
[21] Arukwe A, Goksøyr A. Eggshell and egg yolk proteins in fish: Hepatic proteins for the next generation: Oogenetic, population, and evolutionary implications of endocrine disruption [J]. Comparative Hepatology, 2003, 2(1): 4. doi:10.1186/1476-5926-2-4
[22] Horn O, Nalli S, Cooper D, et al. Plasticizer metabolites in the environment [J]. Water Research, 2004, 38(17): 3693-3698
[23] Shiota K, Mima S. Assessment of the teratogenicity of di (2-ethylhexyl) phthalate and mono (2-ethylhexyl) phthalate in mice [J]. Archives of Toxicology, 1985, 56(4): 263-266
[24] Daniel J W. Toxicity and metabolism of phthalate esters [J]. Clinical Toxicology, 1978, 13(2): 257-268
[25] Katsiadaki I, Williams T D, Ball J S, et al. Hepatic transcriptomic and metabolomic responses in the Stickleback (Gasterosteus aculeatus) exposed to ethinyl-estradiol [J]. Aquatic Toxicology, 2010, 97(3): 174-187
[26] Lapinskas P J, Brown S, Leesnitzer L M, et al. Role of PPARα in mediating the effects of phthalates and metabolites in the liver [J]. Toxicology, 2005, 207(1): 149-163
[27] Puglisi M J, Hasty A H, Saraswathi V. The role of adipose tissue in mediating the beneficial effects of dietary fish oil [J]. The Journal of Nutritional Biochemistry, 2011, 22(2): 101-108
[28] Palmer C N, Hsu M H, Griffin K J, et al. Peroxisome proliferator activated receptor-α expression in human liver [J]. Molecular Pharmacology, 1998, 53(1): 14-22
[29] Ko C-I, Chesnel A, Mazerbourg S, et al. Female-enriched expression of ERα during gonad differentiation of the urodele amphibian Pleurodeles waltl [J]. General and Comparative Endocrinology, 2008, 156(2): 234-245
[30] Zhang X, Hecker M, Park J-W, et al. Real-time PCR array to study effects of chemicals on the hypothalamic pituitary gonadal axis of the Japanese medaka [J]. Aquatic Toxicology, 2008, 88(3): 173-182
[31] Nelson E R, Habibi H R. Functional significance of nuclear estrogen receptor subtypes in the liver of goldfish [J]. Endocrinology, 2010, 151(4): 1668-1676
[32] Babin P J, Carnevali O, Lubzens E, et al. Molecular Aspects of Oocyte Vitellogenesis in Fish [M]. Babin P J, Cerd J, Lubzens E. The Fish Oocyte. Nieuwerkerk: Springer, 2007: 39-76
[33] Bonofiglio D, Gabriele S, Aquila S, et al. Estrogen receptor alpha binds to peroxisome proliferator-activated receptor response element and negatively interferes with peroxisome proliferator-activated receptor gamma signaling in breast cancer cells [J]. Clinical Cancer Research, 2005, 11(17): 6139-6147
◆
Endocrine-DisruptingEffectsofDEHPandMEHPonOryziasmelastigmaunderLong-termExposure
Ye Ting, Kang Mei, Huang Qiansheng#, Dong Sijun*
Key Lab of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021, China
22 July 2013accepted27 September 2013PublisheddateinCNKIdatabases26 November 2013
To study the endocrine-disrupting effects and mechanisms of long-term exposure to di(2-ethylhexyl) phthalate (DEHP) and mono (2-ethylhexyl) phthalate (MEHP) on marine aquatic organisms, Oryzias melastigma (one week post hatching) were exposed to DEHP (0.1 mg L-1and 0.5 mg L-1) and MEHP (0.1 mg L-1and 0.5 mg L-1) respectively for 6 months. The results showed that the hepatosomatic index (HSI) of female and male medaka increased after exposure to DEHP. In contrast, the HSI of male fish increased significantly only after exposure to higher dose of MEHP (0.5 mg L-1). The mRNA levels of hepatic estrogen related genes including estrogen receptor (α, β, γ), vitellogenin (VTG1, VTG2), choriogenin (ChgL, ChgH) were significantly up-regulated in female medaka after exposure to DEHP. In male fish, only the expression of hepatic ERβ was significantly up-regulated after exposure to DEHP. In contrast, exposure to MEHP had no significant influence on the expression of VTG and Chg genes both for female and male. DEHP activated hepatic PPARα and PPARγ in both sexes, while only lower dose of MEHP (0.1 mg·L-1) augmented the expression of hepatic PPARγ in male. The expression of the VTG and Chg was significantly correlated to expression of the ERα and ERγ in both female and male liver. Moreover, significant correlations were observed between the expression of ER and PPAR. Thus, it is proposed that endocrine-disrupting effects on marine medaka could be regulated through hepatic estrogenic responsive genes (VTG and Chg) and peroxisome proliferator-activated receptor (PPARα and PPARγ) after long-term exposure to DEHP, and the effect is sex-specific. MEHP showed weaker endocrine disrupting activity on marine medaka in comparison with that of DEHP.
Oryzias melastigma; di(2-ethylhexyl) phthalate (DEHP); mono(2-ethylhexyl)phthalate (MEHP); estrogen receptor (ER); vitellogenin (VTG); choriogenin (Chg); peroxisome proliferator-activated receptor (PPAR)
国家自然科学基金(21277137,21107107,21207127);福建省自然科学基金(2011J05117)
叶婷(1988-),女,学士,主要研究方向为环境分子毒理学,E-mail:tye@iue.ac.cn;
*通讯作者:(Corresponding author),E-mail:sjdong@iue.ac.cn;
#共同通讯作者(Co-corresponding author),E-mail:qshuang@iue.ac.cn
10.7524/AJE.1673-5897.20130722001 优先出版网址:www. cnki. net/kcms/detail/11. 5470. x. 20131126. 2123. 001. html
叶婷,康美,董四君, 等. 邻苯二甲酸二(2-乙基)己酯(DEHP)和邻苯二甲酸单乙基己基酯(MEHP)长期暴露对海洋青鳉(Oryzias melastigma)内分泌干扰效应的评价[J]. 生态毒理学报, 2014, 9(2): 253-260
Ye T, Kang M, Dong S J, et al. Endocrine-disrupting effects of DEHP and MEHP on Oryzias melastigma under long-term exposure [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 253-260 (in Chinese)
2013-07-22录用日期2013-09-27 < class="emphasis_bold">网络出版日期
日期:2013-11-26
1673-5897(2014)2-253-08
X171.5
A
董四君(1966—),男,博士,研究员,研究方向为环境分子毒理、环境防卫医学和天然活性物质在健康领域的应用。
黄乾生(1982—),男,博士,副研究员,研究方向为环境分子毒理学。
