乙烯菌核利对稀有鮈鲫性腺组织及相关基因转录水平的影响
2014-09-21杨丽华査金苗王子健
杨丽华,査金苗,王子健
中国科学院生态环境研究中心 环境水质学国家重点实验室,北京 100085
乙烯菌核利对稀有鮈鲫性腺组织及相关基因转录水平的影响
杨丽华,査金苗*,王子健
中国科学院生态环境研究中心 环境水质学国家重点实验室,北京 100085
乙烯菌核利在哺乳动物实验中被广泛证实具有抗雄激素效应,而对鱼类的研究结论目前并不统一。将性成熟稀有鮈鲫分别暴露于0、2、10、50 μg·L-1乙烯菌核利21 d,研究环境浓度下乙烯菌核利对鱼类生殖系统的影响及作用机制。结果表明,雌鱼的性腺指数(GSI)、肝脏指数(HSI)在所有浓度组均显著降低(p<0.05),同时卵巢组织中卵泡的发育受到了抑制;而雄鱼仅HSI在最高浓度组(50 μg·L-1)出现显著降低(p<0.05),精巢组织切片也未观察到明显损伤,说明乙烯菌核利对雌鱼生殖系统的影响大于雄鱼。在转录水平上,雌鱼性腺中er mRNA、vtg mRNA分别在50 μg·L-1和10、50 μg·L-1时显著升高(p<0.05),ar mRNA在所有浓度组显著升高(p<0.05);而雄鱼性腺中ar mRNA、dmrt1 mRNA水平分别在10 μg·L-1浓度组和所有浓度组显著降低(p<0.05),er mRNA在所有浓度组显著降低(p<0.05),说明雌雄鱼对乙烯菌核利暴露的分子响应机制存在差异。综上,环境浓度下乙烯菌核利短期暴露会对稀有鮈鲫生殖系统产生一定的影响,并且雌雄鱼在敏感性和分子响应机制上都存在差异。
乙烯菌核利;稀有鮈鲫;性腺组织;转录
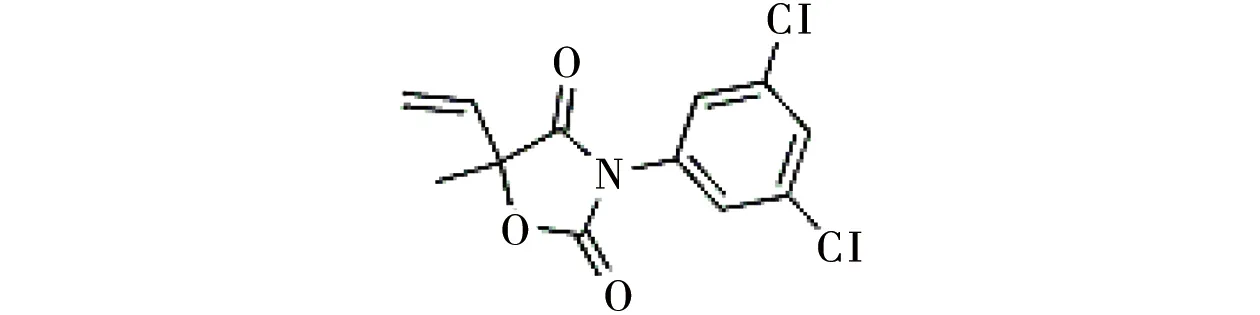
乙烯菌核利(vinclozolin),又称灰霉利、烯菌酮,商品名为农利灵,其化学名称为3-(3,5-二氯苯基)-5-甲基-5-乙烯基-1,3-噁唑烷-2,4-二酮,结构式为:在结构上,乙烯菌核利属于3,5-二氯苯胺的衍生物,即二甲酰亚胺类杀菌剂。它是一种广谱的保护性和触杀性杀菌剂,广泛用于蔬菜和水果的生产过程。农田中施用的乙烯菌核利可迁移至地表水,几周甚至数月后仍能够检测到[1]。Steeger和Garber[2]通过模型预测乙烯菌核利在水体中最高浓度可能达到52.0 μg·L-1;Oskam等[3]在莱茵河中检测到的乙烯菌核利的浓度为2.4 μg·L-1。水体中的乙烯菌核利可部分吸附于悬浮颗粒物或沉积物,其生物富集因子(BCF)介于60~1 260之间,可在水生生物体内富集。
乙烯菌核利曾被认为是对野生生物低毒的[1],但越来越多的研究发现它会干扰生物体内分泌系统,且已经被列入欧盟优先污染物名单[4]和美国国家环境保护局(USEPA)2009年公布的饮用水污染物候选清单(CCL3)[5]。大量研究表明,乙烯菌核利可干扰雄激素受体信号通路[6],特别是抑制雄激素依赖性基因的转录,这些基因编码的产物对雄性性功能如求偶行为及精子发生有重要意义[7-8]。胚胎期乙烯菌核利暴露可以影响哺乳动物的性别分化及性别决定(如抑制生精小管索形成),并导致青春期及成年雄性动物出现睾丸萎缩、前列腺重量降低[9],精子细胞凋亡增加等[10]。乙烯菌核利对鱼类的影响主要集中于雄鱼的性腺分化和精巢发育等,且结论并不统一。如Baatrup和Junge[11]发现乙烯菌核利可以抑制雄性虹鳉(Poecilia reticulate)精巢发育,并影响其第二性征(吸引异性的橘黄色区域减小)及求偶行为;而Makynen等[12]发现乙烯菌核利对黑头呆鱼(Pimephales promelas)幼鱼的性别分化无显著影响,与雄激素受体(AR)的亲和力也较低。Martinovic等[13]对黑头呆鱼(Pimephales promelas)的研究表明,乙烯菌核利对雌鱼性腺的影响大于雄鱼。上述研究均采用了较高剂量的暴露水平(高达1 200 μg·L-1),其结果难以用于评价环境中乙烯菌核利的毒性效应和生态风险。因此,需要进一步研究环境浓度水平下乙烯菌核利对鱼类生殖系统的影响及作用机制。
稀有鮈鲫(Gobiocypris rarus),俗名金白娘、墨线鱼,隶属于鲤形目,鲤科,(鱼丹)亚科,鮈鲫属,具有性成熟快、繁殖力强、产卵频次高、饲养方便、实验操作容易、温度适应广、对化学品敏感且实验重复性好等优点,已被广泛应用到化学品测试及毒理学研究领域[14]。以往研究已经证实,稀有鮈鲫性腺相关基因,如雌激素受体(estrogen receptor, er)、卵黄蛋白原(vitellogenin, vtg)、雄激素受体(androgen receptor, ar)、dmrt1(Doublesex and Mab-3 related transcription factor 1)等对外源污染物的内分泌干扰效应具有很好的指示作用[15]。因此,本研究的主要目的是以性成熟稀有鮈鲫为实验动物,从组织、转录等不同水平上揭示环境浓度水平下乙烯菌核利对不同性别稀有鮈鲫性腺的影响及分子机制。
1 材料与方法(Materials and methods)
1.1 实验鱼饲养
稀有鮈鲫由本实验室饲养并繁殖后代多年,至少驯化7代以上。养殖用水为经活性炭过滤并曝气的自来水(pH 7.2~7.6;硬度 44.0~61.0 mg·L-1,以CaCO3计),水温控制在(25±1) ℃,光周期为16 h∶8 h (昼∶夜),溶解氧不低于7 mg·L-1。饲养期每天投喂饲料3次,即小颗粒商品饵料(TetraMin®)2次和刚孵化的丰年虫幼虫(Artemia nauplii)1次,并及时清除多余饵料和排泄物。
1.2 材料与试剂
乙烯菌核利(纯度>99.5%)购自美国Supelco Chemical公司,助溶剂二甲基亚砜(DMSO)(色谱纯)购自美国Sigma Chemical公司。逆转录酶(M-MLV RT)、脱氧核糖核苷酸(dNTP)等为美国Promega公司产品;RNAprep动物总RNA提取试剂盒(含DNase I)购自天根生化科技公司;SYBR Green PCR master mix购自美国Stratagene公司。其他常规试剂为国产分析纯。
1.3 流水暴露实验
实验选取来自同亲本的性成熟稀有鮈鲫,随机分为5组(每组30条,性别比为1∶1),试验开始前驯养1周。
暴露实验采用流水系统完成,具体操作如下:将乙烯菌核利配制成不同浓度的暴露母液(DMSO助溶),用蠕动泵将暴露母液泵入(1.0 mL·min-1),与去氯自来水(4 L·h-1)混合后注入暴露缸(18 L),乙烯菌核利的终浓度分别为2、10、50 μg·L-1;同时设空白对照、溶剂对照,且暴露组和溶剂对照组中助溶剂的终浓度均不超过0.01‰(体积分数)。乙烯菌核利暴露浓度的选择依据如下:以模型预测最大浓度为上限[2],包含水环境中的实际报道浓度[3],等比例设置。暴露过程中pH=7.2~7.6,硬度为44.0~61.0 mg·L-1(以CaCO3计),水温控制在(25±1) ℃,光照周期为16 h∶8 h(昼∶夜),溶解氧不低于7 mg·L-1。每天投喂小颗粒商品饵料(TetraMin®)1次和刚孵化的丰年虫幼虫(Artemia nauplii)2次,并及时清除多余饵料和排泄物。
暴露时间为28 d,暴露结束前一天晚上停止喂食,使试验鱼空腹。解剖之前首先使用冰块麻醉,并用滤纸吸干,称量并记录体长和体重。然后解剖取性腺、肝脏,称量后存放于-80 ℃待测。
1.4 形态学指标分析
各形态学指标的计算方法如下:
条件因子K-factor = 体重(g)/体长(cm)3×100
性腺指数GSI = 性腺重量(g)/体重(g)×100
肝脏指数HSI = 肝脏重量(g)/体重(g)×100
1.5 组织切片
分离的组织在Bouin's液中固定24 h后,转移至70%(体积分数)乙醇,按常规程序脱水、石蜡包埋,切片机切片,切片厚度3~4 μm,苏木精和曙红染色(H&E染色)。切片观察分析使用Axioskop 2 mot plus光学显微镜和AxioVision Rel. 4.5 软件(Zeiss, Oberkochen, Germany)。
1.6 荧光定量PCR
雌雄鱼性腺组织总RNA提取按照天根生化RNAprep动物组织总RNA提取试剂盒说明书进行,并加入DANase I去除DNA污染。1.2%(质量体积比)琼脂糖凝胶电泳(0.5× TBE buffer, 150 V, 15 min)检测RNA完整性,UV-2000紫外/可见分光光度计(Unico, Dayton, USA)测定RNA浓度及纯度。取1 μg总RNA进行反转录反应得到cDNA,SYBR Green I染料法对目标基因进行定量检测(Mx3005P, Stratagene, USA)。反应体系均为25 μL,包括SYBR Green PCR master mix (Stratagene, USA) 11.25 μL,25 μmol·L-1正义和反义引物各0.4 μL及cDNA 1 μL和ddH2O。PCR反应程序为95 ℃预变性5 min;40个循环:95 ℃变性30 s,58 ℃复性40 s,72 ℃延伸30 s;最后一个循环做熔解曲线:95 ℃变性60 s,58 ℃复性30 s,72 ℃延伸30 s。内参基因选择β-actin,引物如下:正义引物5'-CAGGGCGTGATGG TGGGGAT-3',反义引物5'-GGTTGGCTTTGGGGTTGAG -3'。各目标基因引物见表1。
所有样品的定量检测至少重复2次,每次2个平行。以delta-delta Ct法计算目标基因mRNA的相对表达量。
1.7 数据处理与分析
所有的数据分析均通过SPSS 13.0(SPSS, Chicago, IL, USA)软件one-way ANOVA方法,Levene方法验证方差齐次性,Dunnett's方法分析实验组与对照组间差异显著性,显著性水平为p<0.05;结果以平均值±标准偏差表示,作图使用Origin 8.0软件完成。
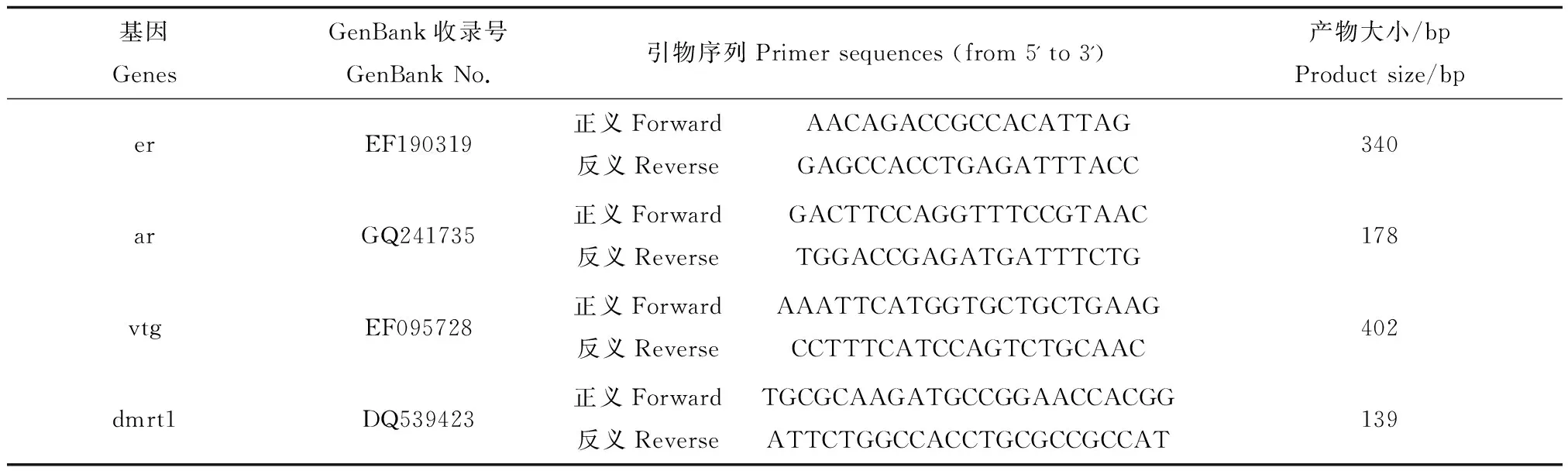
表1 定量PCR所用引物信息Table 1 Primers for q-RT-PCR utilized in this study
2 结果(Results)
2.1 形态学指标的变化
稀有鮈鲫的形态学指标变化见表2。经乙烯菌核利暴露28 d后,稀有鮈鲫体长及体重(数据未给出)和条件因子与对照组相比没有明显的差异。雌鱼的性腺指数、肝脏指数在所有浓度组均显著降低(p<0.05),而雄鱼仅肝脏指数在最高浓度组出现显著降低(p<0.05)。
2.2 组织病理学损伤
稀有鮈鲫性腺组织切片见图1。对照组稀有鮈鲫卵巢中以成熟卵母细胞(第V时相)为主,有少量Ⅱ、 Ⅲ时相卵母细胞(图1A);而在50 μg·L-1乙烯菌核利暴露组稀有鮈鲫卵巢中则以第Ⅱ时相卵母细胞为主,还有一定数量的第Ⅲ 、 Ⅳ时相卵母细胞及少量的成熟卵母细胞(图1B)。
对照组稀有鮈鲫精巢内可观察到成熟的精子(spermatozoa, SP)及不同发育阶段的精小囊(spermatogenic cyst, SPC),分别含有精原细胞(spermatogonia, SG)和精母细胞(spermatocyte, SC)等(图1C)。乙烯菌核利暴露组的精巢与对照组相似且发育良好(图1D)。

表2 乙烯菌核利(VCZ)对稀有鮈鲫形态学指标的影响Table 2 Impacts of vinclozolin (VCZ) on morphometric parameters of rare minnow (Gobiocypris rarus)
注:Mean±SEM (n = 15);*表示与对照组相比具有显著差异(p<0.05)。
Note: Mean±SEM (n = 15); * p<0.05, compared with the control.
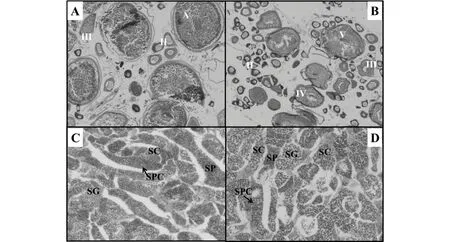
图1 稀有鮈鲫性腺组织切片注:A,对照组雌鱼(40×);B,50 μg·L-1 VCZ暴露后雌鱼(40×);C,为对照组雄鱼(200×);D,50 μg·L-1 VCZ暴露后雄鱼(200×)。 Ⅱ , Ⅲ, Ⅳ, Ⅴ分别代表第Ⅱ , Ⅲ, Ⅳ, Ⅴ时相的卵母细胞,SPC,精小囊;SG,精原细胞;SC,精母细胞;SP,精子。Fig. 1 Microphotographs of gonad from rare minnow (Grobiocypris rarus)Note: A, gonad from female control (40×); B, gonad from female fish exposed to 50 μg·L-1 VCZ (40×); C, gonad from male control (200×); D, gonad from male fish exposed to 50 μg·L-1 VCZ (200×); Ⅱ , Ⅲ, Ⅳ, Ⅴindicate oocyte at Ⅱ, Ⅲ, Ⅳ, Ⅴ stage, respectively; SPC, spermatogenic cyst; SG, spermatogonia; SC, spermatocyte; SP, spermatozoa.
2.3 性腺基因转录水平的变化
稀有鮈鲫性腺er、vtg、ar、dmrt1基因转录水平变化情况见图2和图3。暴露于乙烯菌核利28 d后,雌鱼性腺中er、vtg的转录水平分别在50 μg·L-1和10、50 μg·L-1时显著升高(p<0.05);ar转录水平在所有浓度组显著升高(p<0.05),但dmrt1转录水平未发生显著变化(图2)。雄鱼中,er mRNA水平显著降低(p<0.05),vtg mRNA无显著变化;ar mRNA、dmrt1 mRNA水平分别在10 μg·L-1浓度组和所有浓度组显著降低(p<0.05) (图3)。
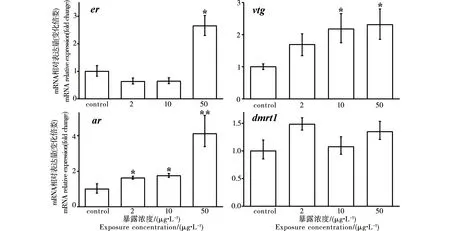
图2 乙烯菌核利暴露对雌性稀有鮈鲫性腺相关基因转录水平的影响注:与对照组相比,* p<0.05,** p<0.01,下同。Fig. 2 Effect of vinclozolin on gene transcription in gonad of female rare minnow (Grobiocypris rarus)Note: * p<0.05, ** p<0.01, compared with the control, the same below.
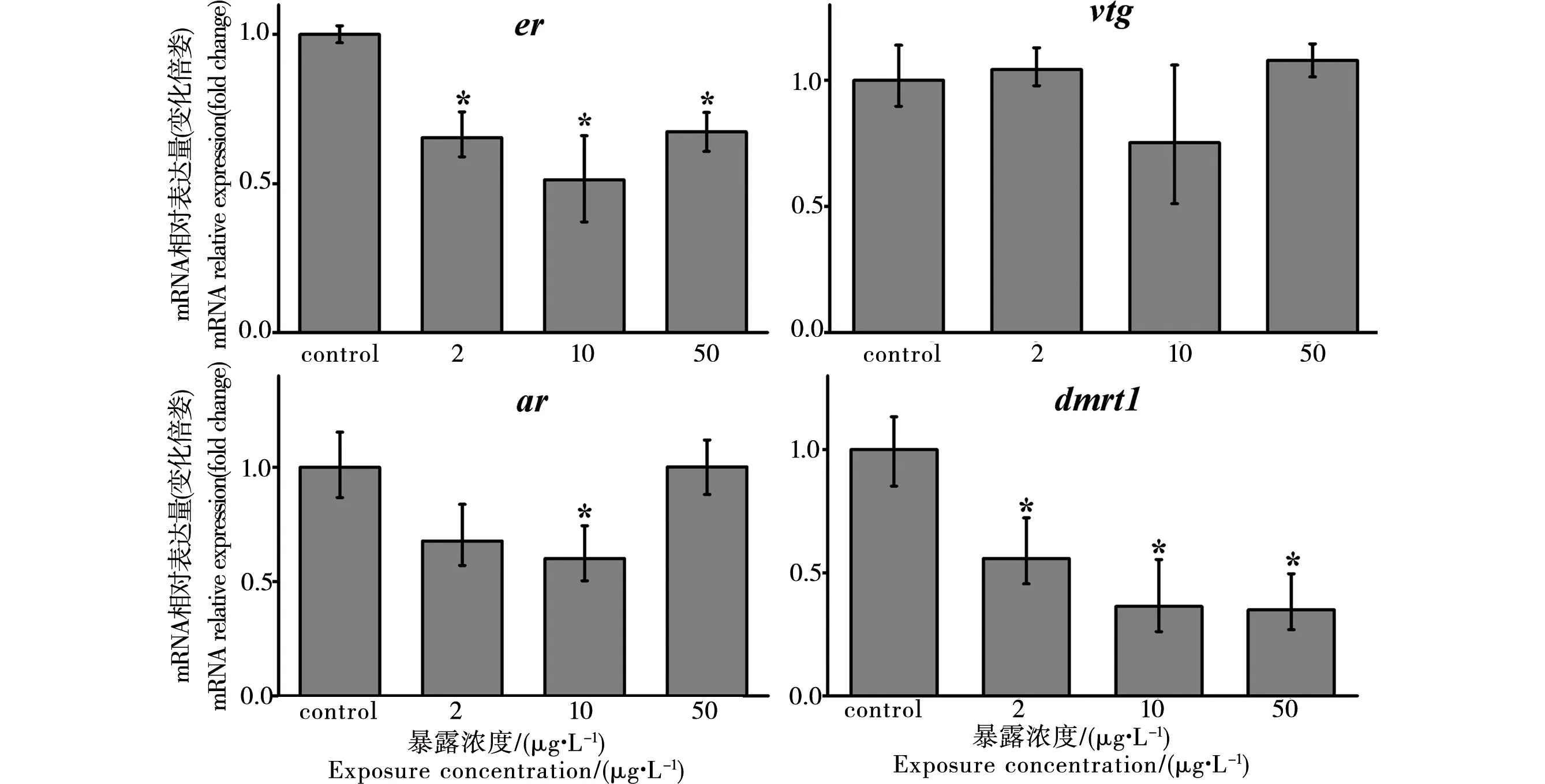
图3 乙烯菌核利暴露对雄性稀有鮈鲫性腺相关基因转录水平的影响Fig. 3 Effect of vinclozolin on gene transcription in gonad of male rare minnow (Grobiocypris rarus)
3 讨论(Discussion)
通过组织及基因转录等水平的研究发现,乙烯菌核利短期暴露会对稀有鮈鲫性腺组织发育和功能产生一定的干扰,并且在雌雄鱼体内表现出不同的作用机制。
条件因子和组织指数可以从一定程度上反映鱼类整体状况或组织生长状态,且易于测量与计算,因此广泛用于毒理学研究中[16]。如Deng等[17]研究发现,成年斑马鱼(Danio rerio)暴露于三溴苯酚之后,条件因子显著增加。本研究中,雌雄鱼条件因子与对照组相比均未发生明显变化。然而,组织指数则受到了显著影响,特别是在雌鱼体内,即使在最低浓度组(2 μg·L-1)HSI和GSI也出现了显著的降低。哺乳动物研究表明,乙烯菌核利的确会对卵巢的发育有不利影响[18]。Makynen等[12]研究表明,暴露于高浓度乙烯菌核利(700 μg·L-1) 21 d后,雌性黑头呆鱼(Pimephales promelas)的性腺指数显著下降,但暴露于200 μg·L-1乙烯菌核利并未导致雌性黑头呆鱼的性腺指数发生显著变化。而本研究中,即使在2 μg·L-1乙烯菌核利暴露组,雌性稀有鮈鲫的GSI也发生了显著变化,这可能与实验鱼类的敏感性和暴露时间长短有关。同时在Makynen等[12]的研究中,乙烯菌核利的暴露未对雄鱼GSI产生显著影响,与本研究结果一致。上述结果表明,在本实验浓度范围内乙烯菌核利的短期暴露对成年稀有鮈鲫的整体生长没有显著的影响,但是会对肝脏、性腺等组织造成损害。
组织病理学结果显示,乙烯菌核利暴露组的雌鱼性腺组织中卵泡的发育受到了严重抑制,这可能是雌鱼HSI和GSI下降的主要原因。而雄鱼精巢组织在显微镜下未观察到明显损伤,同时雄鱼GSI也没有显著变化。Martinovic等[13]在对黑头呆鱼(Pimephales promelas)的研究中也发现了类似的现象:乙烯菌核利暴露后的雌鱼产卵量减少且卵巢闭锁发生率增加,但雄鱼则未表现出明显的性腺组织损伤。上述结果均表明,乙烯菌核利对雌鱼生殖系统的影响大于雄鱼。Bayley等[19]的研究则证实乙烯菌核利可以影响虹鳉(Poecilia reticulate,未完全性成熟)的生殖能力,而Kiparissis等[20]也在未性成熟青鳉(Oryzias latipes)中发现乙烯菌核利引起的性腺组织损伤如精巢纤维化。由此推测,乙烯菌核利对生殖系统的影响很可能与鱼类的性别以及性腺发育阶段有关。
为进一步了解乙烯菌核利对稀有鮈鲫生殖系统的影响,分别测定了雌雄稀有鮈鲫性腺组织中关键基因的转录水平。在鱼类体内,合成后的雌激素和/或雄激素与相应的受体结合,并激活受体依赖性基因的表达(如vtg、dmrt1),从而对性腺组织的发育进行调节[21]。卵黄蛋白原虽然主要来源于肝脏,但已有研究表明,vtg mRNA在肝脏外组织,特别是卵巢也有表达,并且可以被雌激素(E2)诱导[22]。
以往大量研究表明,乙烯菌核利可以抑制ar转活及ar依赖性基因的表达,从而干扰雄性生殖系统的发育及功能[23]。本研究中,雄性稀有鮈鲫性腺中ar基因(10 μg·L-1)及dmrt1基因(所有浓度组)的转录水平均显著降低,表明乙烯菌核利对ar介导的信号通路的确有抑制作用。Martinovic等[13]则发现黑头呆鱼(Pimephales promelas)暴露于450 μg·L-1乙烯菌核利后,其精巢组织中ar mRNA的表达显著增加。这种差异可能与暴露浓度以及物种敏感性等因素相关。本研究中雄鱼性腺组织切片和GSI均没有出现相应的变化。Baatrup和Junge[11]对虹鳉(Poecilia reticulate)的研究显示,虽然GSI等指标没有明显变化,但乙烯菌核利对雄鱼的精子数量和质量均产生了显著的影响。因此,本研究中乙烯菌核利有可能通过抑制ar信号通路对稀有鮈鲫精巢组织产生了其他未观测到的影响(如精子数量和质量下降等)。
相反,雌鱼性腺中ar转录水平显著升高,但dmrt1转录水平未发生显著变化,同时er、vtg的转录水平也显著升高。虽然AR在鱼类卵巢中的作用和调节机制尚未明晰,但有证据显示,雄激素可以通过与AR直接反应抑制VTG的合成[13]。乙烯菌核利也可能与雄激素竞争受体,导致ar基因转录水平升高,并加剧对VTG合成的抑制,从而导致雌性稀有鮈鲫卵泡发育受到阻碍。而er、vtg的转录水平的升高,则可能是VTG合成受到抑制后的补偿效应。
雌雄鱼对环境污染物的敏感性和响应机制上的差异,已经有过多次报道[12]。笔者在前期的研究中也发现,稀有鮈鲫雌鱼肾上腺系统对乙烯菌核利暴露的敏感性高于雄鱼[24]。这可能与体内激素水平有关,以本研究为例:雄鱼体内具有较高的雄激素及ar mRNA表达水平,乙烯菌核利直接表现出对ar及其依赖性信号通路的抑制作用;而雌鱼体内雄激素及ar转录水平都非常低,乙烯菌核利可更有效地竞争雄激素受体,导致受体供应不足,诱导ar的表达增加。当然,其中具体的分子机制还需要进一步研究证实。
综上,环境浓度下乙烯菌核利短期暴露会对稀有鮈鲫生殖系统产生一定的影响,但在转录水平上表现出不同的分子机制,且雌鱼的敏感性大于雄鱼。在以后的内分泌干扰研究中,应充分考虑受试动物的性别、发育阶段等因素可能带来的影响。
[1] United States Environmental Protection Agency (US EPA). Reregistration Eligibility Decision for Vinclozolin [R]. Washington DC: Office of Prevention, Pesticides and Toxic Substances, 2000
[2] Steeger T, Garber K. Risks of Vinclozolin Use to Federally Threatened California Red-Legged Frog (Rana aurora draytonii) [R]. Washington DC: Office of Pesticide Programs, Environmental Fate and Effects Division, 2009
[3] Oskam G, Van G J, Hopman R, et al. General view of the problem, with special reference to the Dutch situation [J]. Water Supply, 1993, 11(1): 1-17
[4] European Commission. Communication to the Council and the European Parliament on the Implementation of the Community Strategy for Endocrine Disrupters-A Range of Substances Suspected of Interfering with the Hormone Systems of Humans and Wildlife [R]. Brussels: Commission of the European Communities, 2001
[5] United States Environmental Protection Agency (US EPA). Contaminant Candidate List 3 [R]. Washington DC: Office of Ground Water and Drinking Water, 2009
[6] Kelce W R, Lambright C R, Gray Jr L E, et al. Vinclozolin and p,p'-DDE alter androgen-dependent gene expression: In vivo confirmation of an androgen receptor-mediated mechanism [J]. Toxicology and Applied Pharmacology, 1997, 142(1): 192-200
[7] Gray L E, Ostby J. Effects of pesticides and toxic substances on behavioral and morphological reproductive development: Endocrine versus nonendocrine mechanisms [J]. Toxicology and Industrial Health, 1998, 14(1-2): 159-184
[8] Roberts K P, Zirkin B R. Androgen regulation of spermatogenesis in the rat [J]. Annals of the New York Academy of Sciences, 1991, 637(1): 90-106
[9] Gray L E, Ostby J, Furr J, et al. Effects of environmental antiandrogens on reproductive development in experimental animals [J]. Human Reproduction Updata, 2001, 7(3): 248-264
[10] Uzumcu M, Suzuki H, Skinner M K. Effect of the anti-androgenic endocrine disruptor vinclozolin on embryonic testis cord formation and postnatal testis development and function [J]. Reproductive Toxicology, 2004, 18(6): 765-774
[11] Baatrup E, Junge M. Antiandrogenic pesticides disrupt sexual characteristics in the adult male guppy (Poecilia reticulata) [J]. Environmental Health Perspectives, 2001, 109(10): 1063-1070
[12] Makynen E A, Kahl M D, Jensen K M, et al. Effects of the mammalian antiandrogen vinclozolin on the development and reproduction of the fathead minnow (Pimephales promelas) [J]. Aquatic Toxicology, 2000, 48(4): 461-475
[13] Martinovic D, Blake L S, Durhan E J, et al. Reproductive toxicity of vinclozolin in the fathead minnow: Confirming an anti-androgenic mode of action [J]. Environmental Toxicology and Chemistry, 2008, 27(2): 478-488
[14] Zhong X P, Xu Y, Liang Y, et al. The Chinese rare minnow (Gobiocypris rarus) as an in vivo model for endocrine disruption in freshwater teleosts: A full life-cycle test with diethylstilbestrol [J]. Aquatic Toxicology, 2005, 71(1): 85-95
[15] Zhang X Y, Zha J M, Wang Z J. Influences of 4-nonylphenol on dmrt1 gene expression and vitellogenin mRNA induction of adult rare minnow (Gobiocypris rarus) [J]. Environental Toxicology and Chemistry, 2008, 27(1): 196-205
[16] Van der Oost R, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: A review [J]. Environmental Toxicology Pharmacololy, 2003, 13(2): 57-149
[17] Deng J, Liu C S, Yu L Q, et al. Chronic exposure to environmental levels of tribromophenol impairs zebrafish reproduction [J]. Toxicology and Applied Pharmacology, 2010, 243(1): 87-95
[18] Quignot N, Arnaud M, Robidel F, et al. Characterization of endocrine-disrupting chemicals based on hormonal balance disruption in male and female adult rats [J]. Reproductive Toxicology, 2012, 33(3): 339-352
[19] Bayley M, Larsen P F, Baekgaard H, et al. The effects of vinclozolin, an anti-androgenic fungicide, on male guppy secondary sex characters, and reproductive success [J]. Biology of Reproduction, 2003, 69(6): 1951-1956
[20] Kiparissis Y, Metcalfe T L, Balch G C, et al. Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development of the Japanese medaka (Oryzias latipes) [J]. Aquatic Toxicology, 2003, 63(4): 391-403
[21] Nagahama Y, Yamashita M. Regulation of oocyte maturation in fish [J]. Development, Growth & Differentiation, 2008, 50(s1): S195-S219
[22] Wang H, Tan J T T, Emelyanov A, et al. Hepatic and extrahepatic expression of vitellogenin genes in the zebrafish, Danio rerio [J]. Gene, 2005, 356: 91-100
[23] Kelce W R, Gray L E, Wilson E M. Antiandrogens as environmental endocrine disruptors [J]. Reproduction, Fertility and Development, 1998, 10(1): 105-111
[24] Yang L H, Zha J M, Zhang X Y, et al. Vinclozolin affects the interrenal system of rare minnow (Gobiocypris rarus) [J]. Aquatic Toxicology, 2011, 104(1-2): 153-159
◆
VinclozolinAffectedtheGonadofRareMinnow(Gobiocyprisrarus)atHistopathologicalandTranscriptionalLevels
Yang Lihua, Zha Jinmiao*, Wang Zijian
State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
16 July 2013accepted15 September 2013
Vinclozolin has been proved as a mammalian anti-androgen. However, data concerning its effects in fish is limited. In the present study, sexually matured rare minnow were exposed to environmentally relevant concentrations of vinclozolin (0, 2, 10, 50 μg·L-1) for 21 days. In the females, the hepatosomatic index (HSI) and gonadsomatic index (GSI) were significantly decreased at all treatments (p<0.05), and the development of ovarian follicles were inhibited; while in the males, no obvious changes were observed except for a decrease of HSI at 50 μg·L-1(p<0.05). Real-time PCR revealed significant increases of the gonadal transcripts of er (50 μg·L-1), vtg (10, 50 μg·L-1), and ar (all concentrations) in the females (p<0.05), but decreases of those of ar (10 μg·L-1), dmrt1 (all concentrations) and er (all concentrations) in the males (p<0.05). Above all, short term exposure to vinclozolin at environmentally relevant concentrations could cause adverse effects on the gonad of rare minnow. The results also indicated differences in the sensitivity and responsive mechanism upon vinclozolin exposure, which should be considered in further studies on other endocrine disrupting chemicals.
vinclozolin; rare minnow; gonad; transcription
国家高技术研究发展计划“863计划”重大项目(2012AA06A302)
杨丽华(1984-),女,博士,研究方向为环境毒理学,E-mail: lhyang@ihb.ac.cn
*通讯作者(Corresponding author),E-mail: jmzha@rcees.ac.cn
10.7524/AJE.1673-5897.20130716001
杨丽华,查金苗,王子健. 乙烯菌核利对稀有鮈鲫性腺组织及相关基因转录水平的影响[J]. 生态毒理学报, 2014, 9(2): 245-252
Yang L H, Zha J M, Wang Z J. Vinclozolin affected the gonad of rare minnow at histopathological and transcriptional levels (Gobiocypris rarus) [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 245-252 (in Chinese)
2013-07-16录用日期2013-09-15
1673-5897(2014)2-245-08
X171.5
A
查金苗(1975—),男,博士,副研究员,主要研究兴趣包括水生模型生物体系的构建和发展、水环境生物毒性测试方法、环境内分泌干扰物的筛选技术研究、环境污染物对水生生物分子毒理机制和水生态系统完整性评估方法等,在国内外学术刊物上发表高水平论文50余篇,SCI论文30余篇。
