免疫毒性评价中不同淋巴细胞激活剂致大鼠外周全血产生细胞因子作用的评价
2014-09-21艾文超李海山刘伟宋乃宁程艳崔媛李蕾谢文平陈会明
艾文超,李海山,刘伟,宋乃宁,程艳,崔媛,李蕾,谢文平,陈会明
中国检验检疫科学研究院 化学品安全研究所,北京 100123
免疫毒性评价中不同淋巴细胞激活剂致大鼠外周全血产生细胞因子作用的评价
艾文超,李海山,刘伟,宋乃宁,程艳,崔媛,李蕾,谢文平,陈会明*
中国检验检疫科学研究院 化学品安全研究所,北京 100123
淋巴细胞激活剂可有效活化免疫细胞,进而促进细胞因子的产生和分泌,但不同激活剂及激活方式的选择直接影响细胞因子产生的种类和水平。为评价不同激活剂促细胞因子产生的作用,筛选一种快速有效的激活方法用于细胞因子检测,本研究采用不同浓度佛波酯(PMA)/钙离子载体、植物血凝素(PHA)、刀豆蛋白A(Con A)、脂多糖(LPS)和美洲商陆素(PWM)体外激活大鼠外周全血0、2、4、6、8、10 h,对各样本中10种细胞因子(白细胞介素2(IL-2)、白细胞介素4(IL-4)、白细胞介素6(IL-6)、白细胞介素10(IL-10)、白细胞介素13(IL-13)、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、受激活调节正常T细胞表达和分泌因子(RANTES)和转化生长因子β(TGF-β))含量进行检测,并评价了环孢素A和硫唑嘌呤2种免疫抑制剂对激活剂诱导产生细胞因子的抑制作用。结果表明25 ng·mL-1PMA和1 μg·mL-1钙离子载体体外诱导6 h可以显著升高大鼠外周全血IL-2、IFN-γ、TNF-α、RANTES和TGF-β含量,是一种作用广泛的激活方法。其诱导产生细胞因子作用的变化可反映机体免疫系统和功能的损伤,可有效用于外源化学物免疫毒性评价。
淋巴细胞激活剂;细胞因子;外周全血;悬浮芯片系统;免疫毒性评价
细胞因子是一种小分子量的蛋白或多肽,主要由活化的淋巴细胞和单核细胞产生,在所有的免疫反应中起关键作用,其含量及活性的变化能够反映机体免疫系统和功能的损伤,已成为一种有效的体外免疫功能性试验方法[1-3]。
由于休眠状态的免疫细胞只生产少量的细胞因子来满足其基本生理需求,循环血中的细胞因子水平并不能反应免疫系统功能,且细胞因子低浓度水平下的微小变动也很难解释其生物学意义,有时甚至难以检测,所以在细胞因子检测时通常需要使用淋巴细胞激活剂对外周全血或淋巴细胞进行体外激活。常用的激活剂包括:植物凝集素(如植物血凝素(PHA)、刀豆蛋白A(Con A)、美洲商陆素(PWM)),脂多糖(LPS),佛波酯(PMA)/钙离子载体,结核菌素纯蛋白衍生物,T淋巴细胞亚群(CD3/CD28)抗体等[4]。然而,不同激活剂的选择可能诱导淋巴细胞产生不同种类的细胞因子,且激活剂浓度及激活时间对细胞因子产生水平也有影响。研究人员曾通过系统研究发现,PHA是诱导人外周全血产生多种细胞因子的最佳激活剂[5],但各激活剂的作用可能存在种属差异,对不同激活剂诱导啮齿类动物外周全血产生细胞因子作用的比较研究还没有文献报道,给非临床免疫毒性评价工作者在激活剂的选择上带来很大的困惑。
因此,本研究评价了不同种类及浓度的淋巴细胞激活剂作用不同时间后,对SD大鼠外周全血中释放细胞因子的影响,以及不同免疫抑制剂对淋巴细胞激活剂促细胞因子生成作用的影响。以期筛选一种快速有效的激活方法用于细胞因子检测,为其在非临床免疫毒性评价中的应用提供基础研究资料和科学依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:MCO-20AIC型二氧化碳培养箱(三洋公司),3-18k型冷冻离心机(SIGMA公司),Bio-Plex 200型悬浮芯片系统(伯乐公司),FACS Calibur流式细胞仪(BD公司)。
试剂:细胞因子检测multi-plex试剂盒购自Affymetrix公司。Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购自Calbiochem公司。植物凝集素(PHA),脂多糖(LPS),刀豆蛋白A(Con A),美洲商陆素(PWM),佛波酯(PMA)/钙离子载体均购自SIGMA公司。环孢素A(CsA)和硫唑嘌呤(AZP)均购自武汉远城科技发展有限公司,纯度分别为99.6%和98.5%。
1.2 实验材料
肝素钠抗凝外周全血采自正常健康或免疫抑制剂给药1周后的雌性SD大鼠。动物购自北京维通利华实验动物公司,合格证号SCXK-2012-0001,体重240~260 g,自由摄食饮水。
1.3 外周全血体外刺激
200 μL未稀释肝素钠抗凝全血加入试管中,在37 ℃,体积分数为5% CO2条件下,与不同浓度和类别的淋巴细胞激活剂共同培养0、2、4、6、8、10 h后,离心收集上清液,-80 ℃冻存备用。
1.4 细胞因子测定方法
使用Bio-Plex 200悬浮芯片系统同时检测10种细胞因子,包括白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白细胞介素-13(IL-13)、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、受激活调节正常T细胞表达和分泌因子(RANTES)和转化生长因子β(TGF-β)。该方法基本原理为蛋白质夹心酶联免疫方法,使用不同荧光微球进行细胞因子的筛选和定量,细胞因子检测范围可至1~32 000 pg·mL-1,具有通量高,灵敏度高的特点。
1.5 数据处理
试验结果通过SPSS 10.0软件进行单因素方差分析。最小显著性差法(LSD),Dunnett和Games-Howell检验用于比较组间差异。
2 结果(Results)
2.1 淋巴细胞激活剂诱导细胞因子产生的时间-反应和剂量-反应关系
为评价各激活剂在不同浓度和激活时间下的作用,检测了5种激活剂(PHA、LPS、Con A、PWM、PMA/钙离子载体)在3种浓度(PMA终浓度为1、5、25 ng·mL-1;钙离子载体1 μg·mL-1;其他均为1、5、10 μg·mL-1)下,对SD大鼠外周全血刺激0、2、4、6、8、10 h后,诱导多种细胞因子产生的作用(图1),发现25 ng·mL-1的PMA和1 μg·mL-1的钙离子载体联用6 h后即可显著激活大鼠外周全血产生多种细胞因子,包括IL-2、IFN-γ、TNF-α、TGF-β和RANTES,8 h后可检测到IL-4、IL-6增多,但作用不明显。其他激活剂虽然也能呈剂量和时间依赖性地促进某些细胞因子的释放,但所激活产生的细胞因子种类较少(值得注意的是LPS能够对TNF-α产生非常强烈的促分泌作用)。因此在本研究中,笔者认为PMA/钙离子载体是最有效的激活剂,并以25 ng·mL-1的PMA和1 μg·mL-1的钙离子载体的6 h刺激进行免疫抑制药物的评价实验。
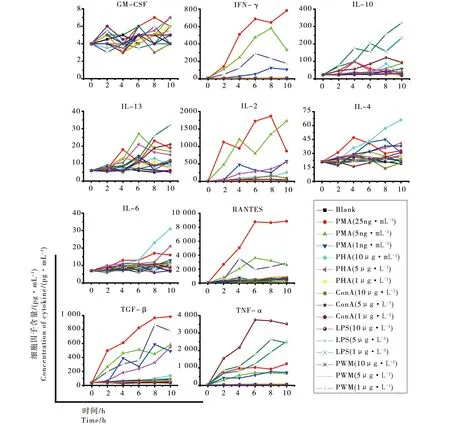
图1 淋巴细胞激活剂诱导大鼠外周全血产生细胞因子注:PMA、PHA、Con A、LPS和PWM分别为:佛波酯、植物血凝素、刀豆蛋白A、脂多糖和美洲商陆素。 PMA/钙离子载体中,钙离子载体浓度为1 μg·mL-1。Fig. 1 Rat blood immune cells showed altered cytokine production in response to different lymphocyte stimulantsNote: PMA, PHA, Con A, LPS and PWM are phorbol-12-myristate-13-acetate, phytohaemagglutinin, concanavalin A, lipopolysaccharide and pokeweed-mitogen. The concentration of ionomycin is 1 μg·mL-1 in PMA/Ionomycin.
在评估外源化学物免疫毒性之前,有必要对指定激活剂量和刺激时间下细胞存活率进行检测。如果免疫细胞因为营养不足或红细胞破裂而死亡,将影响细胞因子产生,使对免疫抑制结果的判断不准确。为此,含有25 ng·mL-1的PMA和1 μg·mL-1的钙离子载体的正常健康大鼠全血在37 ℃,5% CO2条件下培养6 h后,用Ficoll-Hypaque密度梯度离心提取外周血单核细胞(PBMCs)。用Annexin-V/PI双染色,流式细胞术分析细胞存活率。结果显示,加PMA/钙离子载体和正常样本中双阴性细胞比例分别为84.68%和86.51%(数据未显示),表明在此培养状态下,全血中大多数细胞均处于存活状态。
2.2 免疫抑制剂对细胞因子产生的抑制作用
为了判断不同外源化学物是否能影响PMA和钙离子载体联用的促细胞因子生成作用,选择环孢素A(CsA)和硫唑嘌呤(AZP)2种临床常用的免疫抑制剂作为受试物,二者均具有抑制细胞因子产生作用,但作用机制不同。环孢素A会和胞质内的免疫亲和素(亲环素)结合,形成复合物,作用于钙调磷酸酶,使磷酸酶结合于免疫亲和素上,进而不能影响下游的转录因子(如NF-AT),最终阻止了多种细胞因子基因的转录。硫唑嘌呤则对细胞因子产生细胞具有直接毒性[6]。
由于体内给药比体外培养中加入受试药物更能够反映动物整体免疫功能受到的影响,所以试验选用3种浓度的受试物(环孢素A:1.25、5、20 mg·kg-1;硫唑嘌呤:1、5、25 mg·kg-1)对大鼠进行灌胃给药,高剂量均为动物的最大耐受剂量[7],另设溶媒(橄榄油)对照组,每组3只动物。连续给药7 d后,取肝素钠抗凝全血加25 ng·mL-1的PMA和1 μg·mL-1的钙离子载体培养6 h后,Muti-plex检测IFN-γ、IL-2、RANTES、TGF-β和TNF-α细胞因子含量。结果显示,2种免疫抑制剂对细胞因子的影响是与给药剂量相关的。但二者的抑制效果不同,环孢素A能够显著抑制淋巴细胞激活剂诱导的IL-2、RANTES、TGF-β、TNF-α和IFN-γ产生;而硫唑嘌呤则对促IFN-γ生成的抑制作用较弱(图2和图3)。
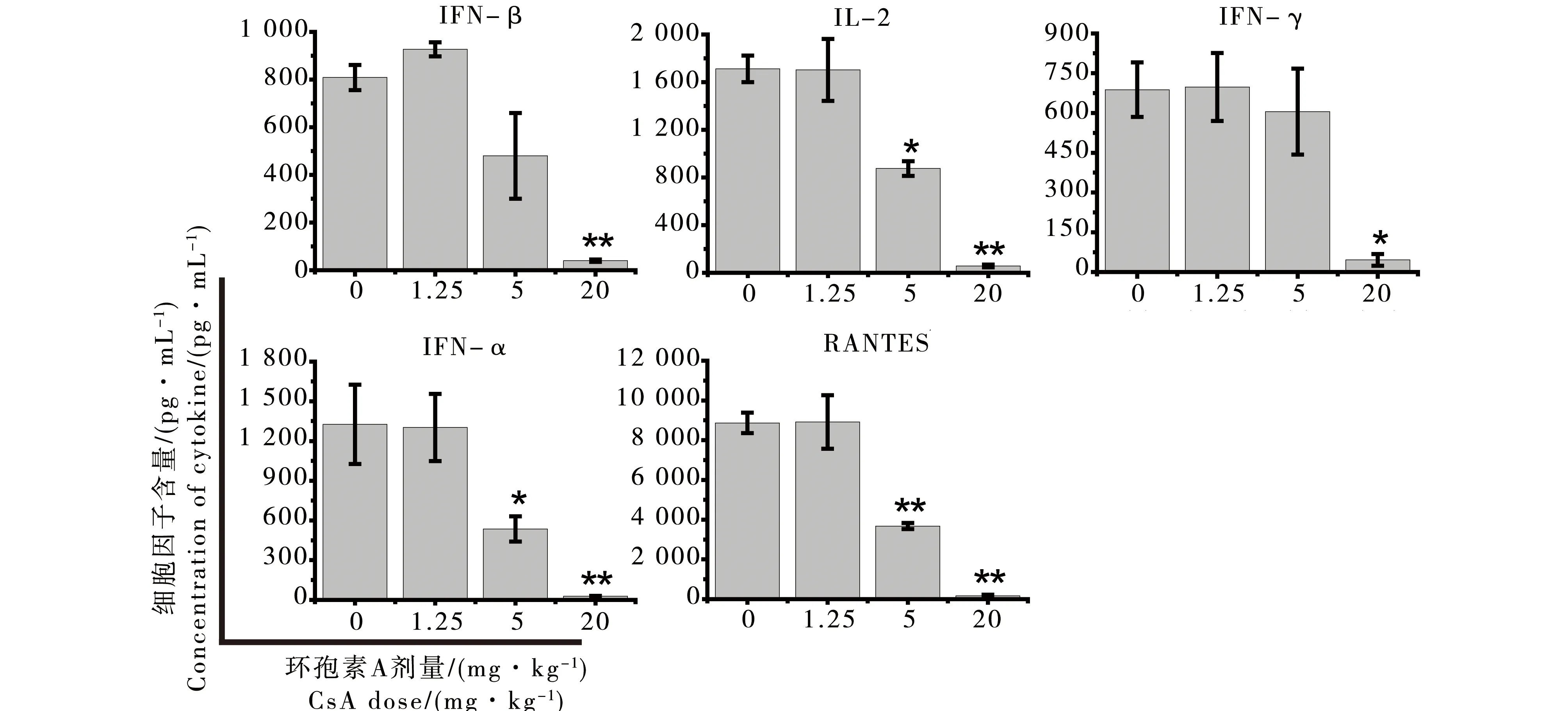
图2 环孢素A(CsA)对细胞因子产生的影响注:Mean±SD,n=3;*p<0.05,**p<0.01。Fig. 2 Cytokine secretion was inhibited by cyclosporine A (CsA) at different concentrationsNote: Mean±SD, n=3;*p< 0.05, **p<0.01.
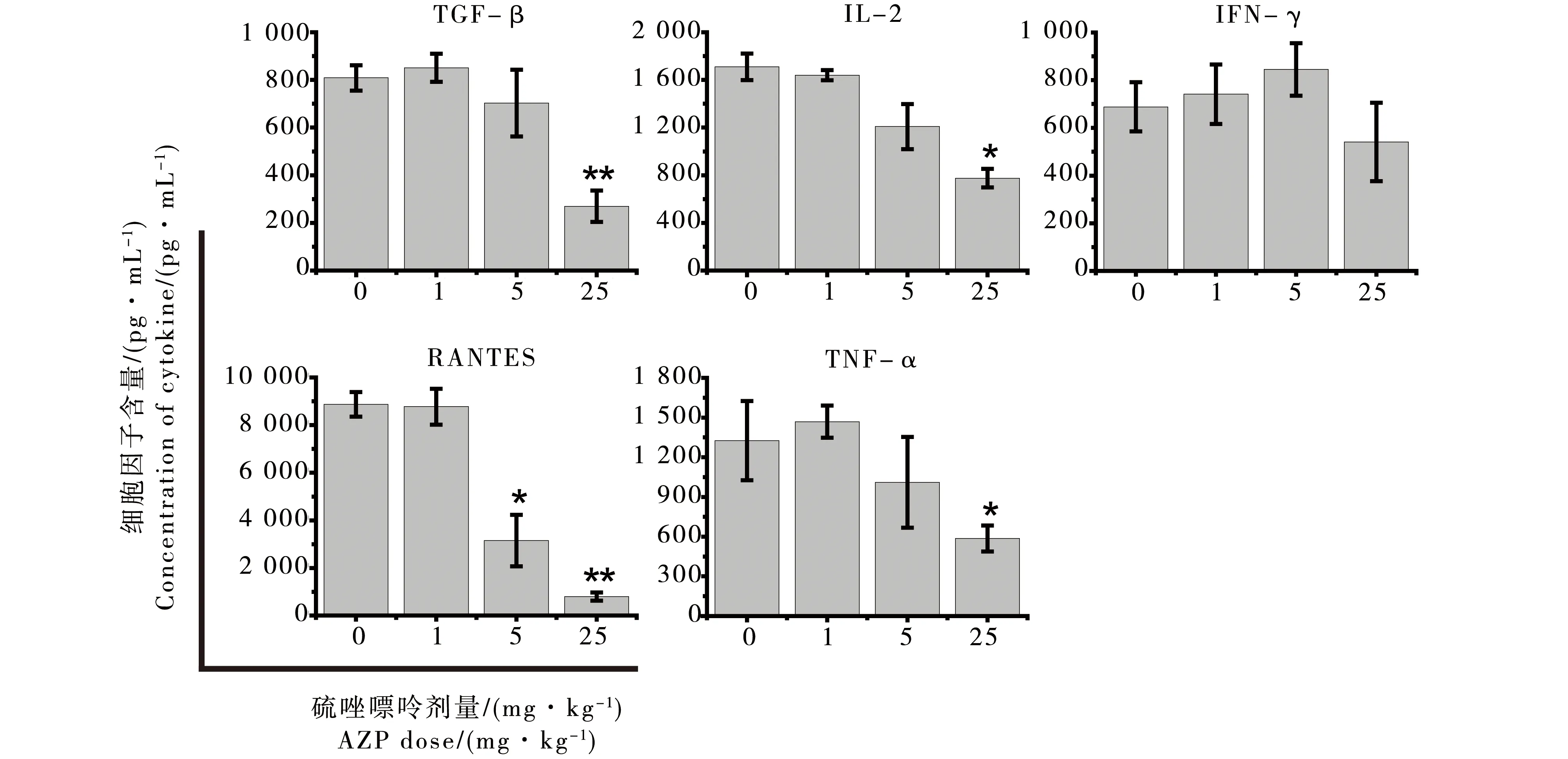
图3 硫唑嘌呤(AZP)对细胞因子产生的影响注:Mean±SD,n=3;*p<0.05,**p<0.01。Fig. 3 Cytokine secretion was inhibited by of azathioprine (AZP) at different concentrationsNote: Mean±SD, n=3;*p< 0.05, **p<0.01.
3 讨论(Discussion)
在体外刺激试验中,常用的检测样本为外周血单核细胞(PBMCs)或稀释全血,但分离和培养过程可能损失重要的免疫分子和受试物,破坏免疫细胞之间的分子网络[8-9]。因此,这些方法可能无法模拟体内免疫系统环境。笔者认为未稀释全血培养是研究体外活化细胞和产生细胞因子的最佳环境。但需要注意的是外周全血刺激的主要缺点在于细胞数量不确定,且不好控制,需要在今后的研究中对细胞数量进行标准化。
此外,免疫反应涉及多种细胞因子复杂的相互作用,而细胞因子种类繁多,在本研究中选择哪些“合适的”细胞因子进行检测呢?House[6]的研究表明,适用于免疫毒性研究的细胞因子分为以下几类:1) 前炎症细胞因子:IL-1、IL-6、TNF;2) TH1/TH2类细胞因子:IL-2、IL-4、IL-10、IFN-γ、TGF-β;3) IL-1受体拮抗剂(IL-1RA);4) 趋化因子:IL-8、MIP(巨噬细胞炎症蛋白)、RANTES;5) 促红细胞生成素:GM-CSF、IL-3;6) 干扰素:I型干扰素(IFN-α、IFN-β),II型干扰素(IFN-γ);7) 其他:IL-9、IL-13、IL-14、致癌蛋白M、白血病抑制因子、白细胞调节素。受现有大鼠细胞因子Multi-plex试剂盒检测种类限制,本研究在上述类别中选择了IL-2、IL-4、IL-6、IL-10、IL-13、IFN-γ、TNF-α、GM-CSF、RANTES和TGF-β共10种免疫相关的细胞因子进行检测。
在本研究中,尽管发现Con A、PHA、PWM和LPS也可在体外刺激产生不同细胞因子,但PMA/钙离子载体是最有效的激活剂。PMA/钙离子载体体外刺激大鼠外周全血6 h后,即可使IL-2、IFN-γ、TNF-α、TGF-β和RANTES显著增加,但对IL-4、IL-6、IL-10、IL-13和GM-CSF的影响较弱。这说明PMA/钙离子载体促细胞因子生成作用存在一定的选择性,许多临床试验也证实了这点。 Barten等[10]在健康人未稀释抗凝全血中加入25 ng·mL-1PMA和750 ng·mL-1钙离子霉素体进行体外培养,5 h后,IFN-γ、TNF-α、IL-2和IL-6显著增加,但IL-4和IL-10并未出现明显增多。 Keski-Nisula等[11]的研究中使用15 ng·mL-1PMA和1 μg·mL-1钙离子载体对培养液稀释的人外周全血体外刺激24 h(较长的体外刺激时间可能是因为样本处理过程中消除或稀释了一些与免疫细胞相关的活性成分),也发现除IL-4外,IFN-γ、IL-6和TNF-α的含量均显著增加。人CD4+T细胞经PMA/钙离子载体刺激后,也并未产生IL-10的高表达[12]。与PHA体外刺激人外周全血的研究结果不同[4],本研究并没有发现PHA对大鼠外周全血中IFN-γ、IL-10、IL-4、IL-6和TNF-α生成的显著促进作用,仅观察到其能够使IL-2、IL-13和RANTES含量增加,这表示激活剂的促细胞因子生成作用仍然表现出种属差异,当然也可能与试验条件的差异有关。在评价不同免疫抑制剂对PMA/钙离子载体促细胞因子生成作用的影响时,不同免疫抑制剂表现出不同的抑制作用。环孢素A抑制了大多数细胞因子的产生,而硫唑嘌呤对IFN-γ的抑制效果较弱。之前的研究也发现他克莫司、地塞米松和霉酚酸对激活全血体外细胞因子的释放具有截然不同的影响[5]。这说明,淋巴细胞激活剂促细胞因子产生水平的变化,可以反映出外源化学物对免疫系统和功能产生的不同作用,并能够对不同化学物的特性进行鉴定。
综上所述,笔者认为25 ng·mL-1PMA和1 μg·mL-1钙离子载体联用体外诱导6 h,可促进大鼠外周全血中产生多种细胞因子,具有简单、快速、灵敏和作用广泛等特点。其促细胞因子生成作用的变化能够反映机体免疫系统和功能的损伤,可有效用于外源化学物免疫毒性评价。
[1] Van der Meide P H, Schellekens H. Cytokines and the immune response [J]. Biotherapy, 1996, 8: 243-249
[2] Corsini E, Roggen E L. Immunotoxicology: Opportunities for non-animal test development [J]. Alternatives to Laboratory Animals, 2009, 37(4): 387-397
[3] Galbiati V, Mitjans M, Corsini E. Present and future of in vitro immunotoxicology in drug development [J]. Journal of Immunotoxicology, 2010, 7(4): 255-267
[4] Corsini E, House R V. Evaluating cytokines in immunotoxicity testing [J]. Methods in Molecular Biology, 2010, 598: 283-302
[5] Liu Z, Yuan X, Luo Y, et al. Evaluating the effects of immunosuppressants on human immunity using cytokines profiles of whole blood [J]. Cytokines, 2009, 45(2): 141-147
[6] House R V. Theory and practice of cytokines assessment in immunotoxicology [J]. Methods, 1999, 19(1): 17-27
[7] De Waal E J, Timmerman H H, Dortant P M, et al. Investigation of a screening battery for immunotoxicity of pharmaceuticals within a 28-day oral toxicity study using azathioprine and cyclosporin A as model compounds [J]. Regulatory Toxicology and Pharmacology, 1995, 21(3): 327-338
[8] Foster J R. The functions of cytokines and their uses in toxicology [J]. International Journal of Experimental Pathology, 2001, 82(3): 171-192
[9] Myrianthefs P, Karatzas S, Venetsanou K, et al. Seasonal variation in whole blood cytokines production after LPS stimulation in normal individuals [J]. Cytokines, 2003, 24(6): 286-292
[10] Barten M J, Rahmel A, Bocsi J, et al. Cytokines analysis to predict immunosuppression [J]. International Society for Analytical Cytology, 2006, 69(3): 155-157
[11] Keski-Nisula L, Roponen M, Hirvonen M R, et al. Stimulated cytokines production correlates in umbilical arterial and venous blood at delivery [J]. European Cytokine Network, 2004, 15(4): 347-352
[12] Olsen I, Sollid L M. Pitfalls in determining the cytokines profile of human T cells [J]. Journal of Immunological Methods, 2013, 390(1-2): 106-112
◆
EvaluationonCytokineProductioninRatPeripheralWholeBloodInducedbyDifferentLymphocyteStimulantsinImmunotoxicityBioassay
Ai Wenchao, Li Haishan, Liu Wei, Song Naining, Cheng Yan, Cui Yuan, Li Lei, Xie Wenping, Chen Huiming*
Institute of Chemicals Safety, Chinese Academy of Inspection and Quarantine (CAIQ), Beijing, 100123, China
10 May 2013accepted8 September 2013
Lymphocyte stimulants can effectively promote the production and release of several cytokines by activating the immune cells, but the types and levels of cytokines depend on the kinds of stimulants. To study the activation effects of different lymphocyte stimulants on cytokine production, the authors analyzed the production of interleukin-2 (IL-2), interleukin-4 (IL-4), interleukin-6 (IL-6), interleukin-10 (IL-10), interleukin-13 (IL-13), interferon-γ (IFN-γ), tumor necrosis factor α (TNF-α), granulocyte-macrophage colony-stimulating factor (GM-CSF), regulated upon activation normal T cell expressed and secreted factor (RANTES) and transforming growth factor β (TGF-β) in undiluted rat peripheral whole blood after in vitro culture (0, 2, 4, 6, 8, 10 h) with different concentrations of phorbol-12-myristate-13-acetate (PMA)/Ionomycin, phytohaemagglutinin (PHA), concanavalin A (Con A), lipopolysaccharide (LPS) and pokeweed-mitogen (PWM). Besides, the effects of immunosuppressants (cyclosporine A and azathioprine) on cytokines production induced by the above lymphocyte stimulants were also studied. The results showed that a rapid increase of cytokine (including IL-2, IFN-γ, TNF-α, RANTES and TGF-β) secretion within 6 h after stimulation with 25 ng·mL-1PMA and 1 μg·mL-1ionomycin. The inhibition of these cytokine profiles reflected the effects of xenobiotics on immune system. Therefore, simultaneous detection of cytokine profiles in undiluted whole blood stimulated with PMA/Ionomycin is a powerful tool for immunotoxicity assessment.
lymphocyte stimulant; cytokines; whole blood; suspension array system; immunotoxicity assessment
中国检验检疫科学研究院基本科研业务费专项资金(2012JK024)
艾文超(1985-),男,硕士,研究方向为毒理学,E-mail: aiwch@aqsiqch.ac.cn;
*通讯作者(Corresponding author),E-mail: chenhm@aqsiqch.ac.cn
10.7524/AJE.1673-5897.20130510001
艾文超,李海山,刘伟,等. 免疫毒性评价中不同淋巴细胞激活剂致大鼠外周全血产生细胞因子作用的评价[J]. 生态毒理学报, 2014, 9(2): 239-244
Ai W C, Li H S, Liu W, et al. Evaluation on cytokine production in rat peripheral whole blood by different lymphocyte stimulants in immunotoxicity bioassay [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 239-244 (in Chinese)
2013-05-10录用日期2013-09-08
1673-5897(2014)2-239-06
X171.5
A
陈会明(1969—),男,环境科学博士,研究员,主要从事化学品理化安全、毒性、生态安全测试技术和风险分析技术研究。
