基于斑马鱼和发光细菌评估制革废水毒性及其削减效率
2014-09-21陈文艳赵远郑国娟马勇雷春生蔡强
陈文艳,赵远,郑国娟,马勇,雷春生,蔡强,*
1. 常州大学环境与安全工程学院,常州 213164 2. 浙江清华长三角研究院,嘉兴 314006 3. 浙江省环境监测中心,杭州 310012
基于斑马鱼和发光细菌评估制革废水毒性及其削减效率
陈文艳1,2,赵远1,郑国娟2,马勇3,雷春生1,蔡强2,*
1. 常州大学环境与安全工程学院,常州 213164 2. 浙江清华长三角研究院,嘉兴 314006 3. 浙江省环境监测中心,杭州 310012
随着制革工业在我国的迅速发展,其导致的环境污染问题也逐渐受到人们的广泛关注。为评价制革废水的生物毒性以及处理工艺对毒性的削减效率,选择费氏弧菌、明亮发光杆菌、斑马鱼幼鱼及其胚胎作为受试生物,分析了制革废水的急性毒性和发育毒性,比较了不同受试生物对制革废水毒性的敏感性,并结合理化指标对废水的毒性削减进行了评估。结果表明:不同受试生物的敏感性大小为斑马鱼胚胎>明亮发光杆菌>斑马鱼幼鱼>费氏弧菌明亮发光杆菌>斑马鱼胚胎>斑马鱼幼鱼>费氏弧菌;发光菌及斑马鱼幼鱼急性毒性实验结果表明,制革废水经过整个工艺处理后,废水的急性毒性已降至检测线以下,即0 TUa;斑马鱼胚胎毒性实验结果表明,经过处理的制革废水仍存在急性毒性,基础毒性当量为0.5 TUa,同时还对胚胎的发育存在一定影响,对胚胎孵化及畸形的毒性当量分别为0.7 TUa和0.13 TUa。综上可知,处理后的制革废水对环境的影响已得到初步的有效控制,但仍需进一步处理以达到更大程度削减毒性的目的。
斑马鱼;发光菌;制革废水;毒性评价
自20世纪末开始,随着皮革工业由发达国家向发展中国家转移,由此造成的水环境污染问题也日益严重。据中国皮革协会报告,截至2007年底,中国皮革加工年产量为7.2亿m3,每年可向环境排放废水约1.5亿t[1],并且废水中成分复杂,含有大量的无机盐类、悬浮物、硫化物,铬及植物鞣剂等有毒有害物质[2]。虽然部分制革废水已经得到一定程度的净化处理,出水的理化指标也达到了《污水综合排放标准》(GB8978—1996)一级标准,但其仍然存在着毒性和生态风险。为了评估其毒性和环境风险,有研究者利用发光菌[3]、藻类[4]、大型蚤[3,5]以及Ames试验[3]分析制革废水的急性毒性、遗传毒性。
另一方面,以鱼类作为受试生物的毒性评估方法日益成熟,也逐渐在环境风险评估中得到应用。如肖雨堂等[6]以斑马鱼为受试生物对深度脱色处理后的印染废水进行了急性毒性研究。王子健等[7]利用日本青鳉评估印染废水的毒性效应。但采用生物毒性测试方法检测制革废水毒性的研究尚不多见,尤其是利用模式生物斑马鱼来评价制革废水毒性的研究尚无记载。而斑马鱼作为一种模式生物,其胚胎具有易观察、可在母体外生长等优点。
因此,本文拟采用斑马鱼幼鱼急性毒性及其胚胎发育毒性试验,以制革废水为研究对象,并结合发光菌(费氏弧菌及明亮发光杆菌)急性毒性、物理化学指标(化学需氧量COD、氨氮、重金属含量等)分析制革废水的生物毒性、主要的致毒物质以及评价不同工艺对废水毒性削减程度,旨在为进一步制定排放标准和最终达标排放提供依据。
1 材料与方法(Materials and methods)
1.1 主要仪器
Cary100紫外分光光度计(Agilent公司)、Glomax Multi微孔板型多功能检测仪(Promega公司)、TS100-F倒置显微镜(Nikon公司)、火焰原子吸收光谱仪(Agilent公司)。
1.2 试验材料
供试生物:费氏弧菌(NRRL B-11177,采用实验室制作的发光细菌冻干粉,初始发光强度高于200万光子数)、明亮发光杆菌(T3小种,采用实验室制作的发光细菌冻干粉,初始发光强度高于200万光子数)、斑马鱼(AB纯系,采用实验室长期稳定培养并达到性成熟的斑马鱼,水温为(28±0.5) ℃,光暗比为16 h∶8 h,且7 d内自然死亡率不超过5%)。
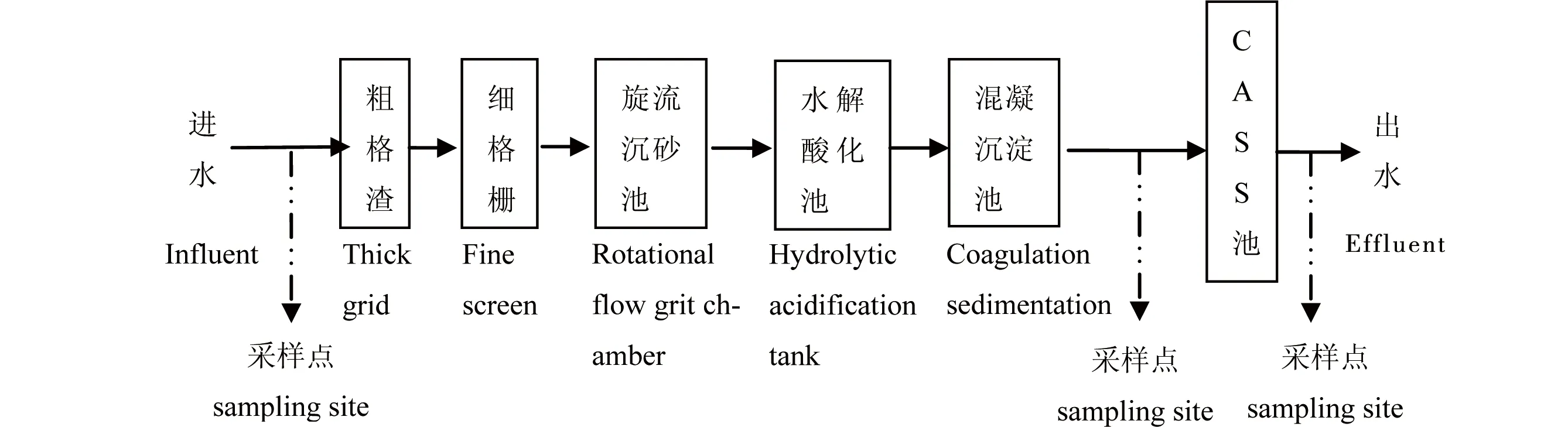
图1 制革废水处理工艺流程及采样点注:CASS工艺为周期循环活性污泥法。Fig. 1 Tannery wastewater treatment process and the sampling sitesNote: CASS is cyclic activated sludge system.
供试污水:污水来自桐乡市A制革污水处理厂的进水、混凝沉淀池出水以及CASS(周期循环活性污泥法)池出水(见图1)。水样采集后,测定水质常规指标(见表1和表2),并置于4 ℃冷库中冷藏。试验前取出,自然升温至24 ℃~26 ℃后使用。
试验用水:其中发光菌急性毒性试验中样品的稀释采用去离子水;斑马鱼毒性试验中样品稀释采用配制的标准稀释水(GB/T 13267—1991)[8]。
1.3 斑马鱼胚胎的获得
运用实验室长期稳定培养的性成熟斑马鱼,按照雌雄比1∶2的比例置于孵化盒中,并置于黑暗条件下。在形成受精卵后,防止成鱼掠食鱼卵,立即收集鱼卵,并用标准稀释水冲洗2~3次,取出残留物后,用显微镜挑出分裂正常的受精卵,用于斑马鱼胚胎发育毒性试验。另外,挑出分裂正常的受精卵,经过72 h孵化后形成幼鱼,显微镜下观察并挑出正常发育的幼鱼用于急性毒性试验。
1.4 发光菌急性毒性试验
按照5个稀释度(分别为6.25%、12.5%、25%、50%及100%)用去离子水稀释待测废水。将发光细菌冻干粉复苏后进行试验,选用96孔细胞培养板作为染毒载体,通过微孔板型多功能检测仪进行发光检测。向每孔中加入100 μL去离子水(作为空白对照)或受试废水,再加入同体积的菌液,反应15 min后进行测定,每个浓度进行3次平行试验。实验结果分别以废水相对发光度和15 min半数效应浓度(EC50)表示[9]。
1.5 斑马鱼幼鱼96 h急性毒性试验
按照5个稀释度,进水(分别为30%、35%、40%、45%及50%)、混凝沉淀池出水(分别为40%、55%、70%、85%及100%)及CASS池工艺出水(分别为6.25%、12.5%、25%、50%及100%),用标准稀释水稀释受试废水。将标准稀释液作为对照,每个浓度梯度设3个平行。实验用鱼为孵化后1 h的正常斑马鱼幼鱼。向每个培养皿中加入15 mL测试溶液和10条幼鱼。每24 h观察并记录死亡情况,及时清除死亡的幼鱼和代谢物。最终废水毒性以96 h死亡率和96 h半数致死浓度(LC50)来表示[10]。
1.6 斑马鱼胚胎毒性试验
按照5个稀释度(分别为30%、35%、40%、45%及50%)稀释制革废水,标准稀释水为对照组,每个浓度梯度设3个平行。并选用24孔细胞培养板进行试验,每个培养板的第一列4个孔加入1 mL标准稀释水作为空白对照,其余20个孔加入1 mL受试溶液,然后放入1枚正常发育的受精卵(1 hpf,受精后1 h),并置于(28±0.5) ℃的培养箱中。每24 h观察并记录胚胎的胚胎损伤、发育、死亡情况,并及时清除死亡的胚胎。到72 hpf时,记录孵化数,直到所有能孵出的胚胎全部孵出,观察并记录畸形率[11]。
1.7 毒性及其削减评价方法
制革废水对发光菌、斑马鱼幼鱼急性毒性及胚胎发育毒性的评价分别采用15 min-EC50、96 h-LC50及72 h-ELC50、72 h-HEC50和72 h-MEC50。在这里ELC50、HEC50和MEC50分别表示制革废水使斑马鱼胚胎死亡率、孵化率及畸形率都达到50%时所对应的浓度。毒性的削减根据毒性单位(TU, toxicity unit)计算得到,计算公式如下[7]:
若当受试生物暴露于体积百分比为100%的废水中时,所导致的剂量效应未达到50%,从而无法得到LC50(或EC50),TU可通过以下公式计算得到[7]:
TU=RE×100×0.02
RE是经受试废水染毒后,发光菌相对抑制发光强度及斑马鱼幼鱼和胚胎的死亡率(%)。
去除率可通过下列公式计算得到:

1.8 数据处理
LC50与EC50值采用Origin8.0进行计算处理。发光菌急性毒性试验结果采用平均值±标准差来表示,对发光菌、斑马鱼幼鱼、斑马鱼胚胎急性毒性及斑马鱼胚胎发育毒性试验的每个染毒组与对照组的显著性差异采用SPSS 16.0进行分析比较(p<0.05)。
2 结果(Results)
2.1 制革废水的理化指标
制革废水的理化参数测定结果可见表1和表2。由表1可以看出进水及混凝沉淀池出水,主要指标如COD及氨氮含量较高,而经过CASS工艺处理后,理化指标基本都达到了《污水综合排放标准》(GB 8978—1996)的排放要求,可直接排放,且可得到COD、氨氮及总磷的去除率分别为84.8%、92.0%和83.2%。从表2中,可以看出Cr、Zn和Cu含量较高,但经过CASS工艺处理后出水中重金属含量已经达到排放标准。

表1 制革废水进水及各工艺段出水的常规理化指标Table 1 Physiological parameters of tannery wastewater influent and effluents from different treatment units
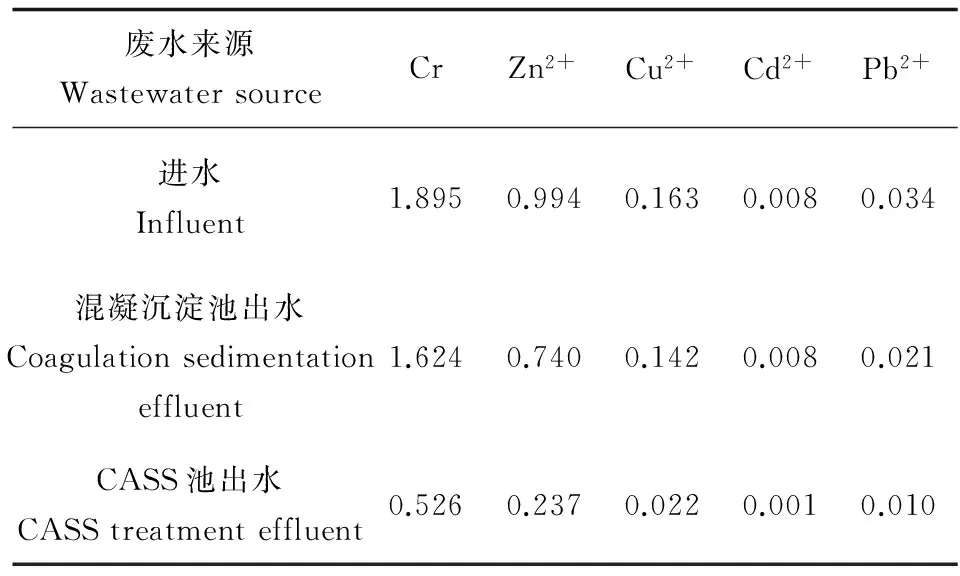
表2 制革废水进水及各工艺段出水的重金属含量Table 2 Concentrations of heavy metals in tannery wastewater influent and effluents from different treatment units (mg·L-1)
2.2 制革废水对发光菌的急性毒性
表3是制革废水的原水及经不同工艺段处理后的废水对2种发光菌的15 min-EC50及相对发光强度,表4是相应计算得到的毒性单位。由表3可以看出原水及混凝沉淀池出水对发光菌都有较高抑制作用,原水对费氏弧菌和明亮发光杆菌相对发光强度分别为45.4%和6.6%,同样混凝沉淀池出水对费氏弧菌和明亮发光杆菌的相对发光强度分别为59.7%和24.0%,说明混凝沉淀池出水之前的处理工艺削减了废水毒性,但仍然存在一定程度的毒性;而相反,CASS工艺出水对发光菌的发光具有促进作用,与理化特性相对照,其可能的原因是废水经CASS工艺处理后,大部分的有毒污染物得到了净化处理,而其出水中又含有易于发光菌发光的营养物质,如营养盐等,从而可促进发光菌发光;从发光菌15 min-EC50结果及毒性单位值(见表4)来看,明亮发光杆菌的敏感性要高于费氏弧菌,且经过混凝沉淀池出水之前的工艺处理后,毒性削减了70.2%。此外,经CASS工艺处理后,毒性已降至检测限以下,这表明经过整个工艺处理后,进水对2种发光菌的急性毒性被完全去除。
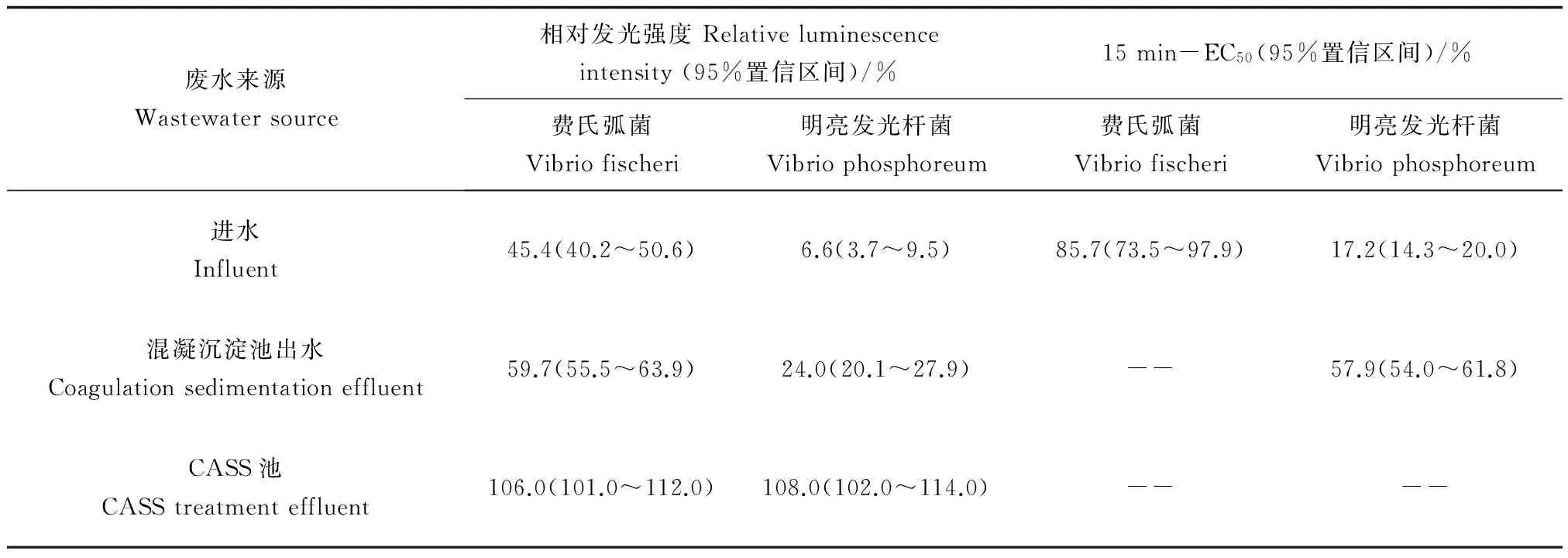
表3 制革废水进水及不同工艺段废水对发光菌的急性毒性效应Table 3 Acute toxic effect on luminescent bacteria exposed to tannery wastewater influent and effluents from different treatment units
2.3 制革废水对斑马鱼幼鱼急性毒性及胚胎发育毒性
2.3.1 制革废水对斑马鱼幼鱼急性毒性
受试废水对斑马鱼幼鱼的急性毒性结果见表5。可以看出,当刚孵化出的幼鱼暴露在进水、混凝沉淀池出水中96 h后,致死率均达到100%,且可通过计算得到相应的LC50,分别为43.3%及77.6%;而出水对斑马鱼幼鱼不存在急性毒性。通过斑马鱼幼鱼急性毒性试验,可得到混凝沉淀工艺前的毒性去除效率为44.2%,且经CASS工艺处理后,毒性已降至检测限以下,这表明经过物理、化学、生物等工艺处理后,进水对斑马鱼幼鱼的急性毒性被完全削减。而将幼鱼暴露在标准稀释水中96 h后,幼鱼死亡率为0%。

表4 制革废水进水及不同工艺段出水对发光菌的毒性当量Table 4 Toxicity unit of tannery wastewater influent and effluents from different treatment units in luminescent bacteria assay

表5 制革废水进水及不同工艺段出水对斑马鱼幼鱼的急性毒性Table 5 Acute toxic effect on zebrafish larvae exposed to tannery wastewater influent and effluents from different treatment units
2.3.2 制革废水对斑马鱼胚胎的发育毒性
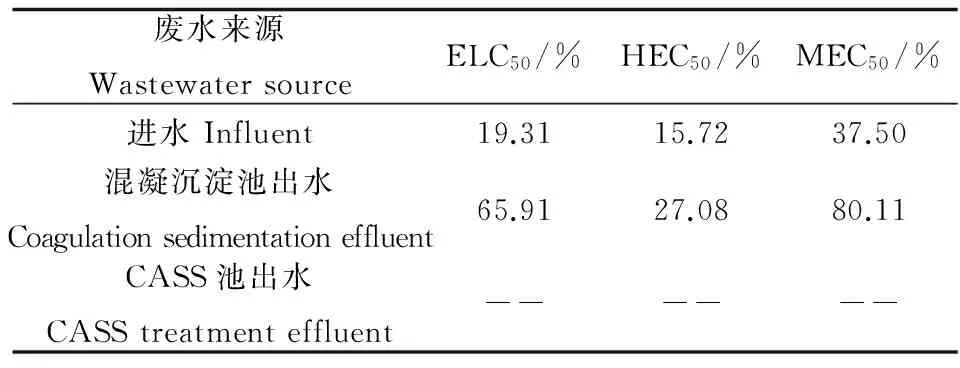
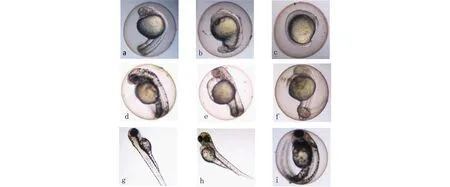
在各工艺段出水中的短期暴露对斑马鱼胚胎的发育、死亡率、孵化率及畸形率都产生了一定程度的影响(见表6和表7,图2和图3)。可以看出,进水及混凝沉淀池出水对胚胎致死率的LC50(ELC50)分别为19.31%和65.91%,而CASS工艺出水对胚胎的致死率低于50%,因此无法得到LC50无抑制作用;进水及混凝沉淀池出水对胚胎孵化率的EC50(HEC50)分别为15.72%和27.08%,CASS工艺出水对其同样无影响;进水及混凝沉淀池出水对胚胎畸形率的EC50(MEC50)分别为37.5%和80.11%,CASS工艺出水对胚胎的畸形率低于50%,因此无法计算EC50。此外,可以看出制革废水最终出水对斑马鱼胚胎仍存在一定的影响,对致死、孵化及致畸的毒性当量分别为0.5 TUa、0.7 TUa及0.13 TUa。通过以上结果,可发现对于进水及混凝沉淀池出水,HEC50 图2 制革废水进水及不同工艺段出水对 斑马鱼胚胎早期发育的影响Fig. 2 Effect on the early development of zebrafish embryo exposed to tannery wastewater influent and effluents from different treatment units 同时,还观察了经CASS工艺出水染毒后,斑马鱼胚胎的发育、孵化及畸形情况。主要包括24 h的20 s内主动活动、24 h尾部延展、24 h眼点发育、48 h心律不齐、48 h色素沉积、48 h心包水肿、72 h孵化率及72 h畸形率。而在这些毒性终点中比较敏感的主要是24 h尾部延展、48 h心包水肿、72 h孵化率及72 h畸形率(见图3)。 表6 制革废水进水及不同工艺段出水对斑马鱼胚胎急性毒性和发育毒性Table 6 Acute and developmental toxicity to zebrafish embryo exposed to tannery wastewater influent and effluents from different treatment units 注: ELC50、HEC50及MEC50分别表示斑马鱼胚胎暴露于废水中,达到50%死亡、孵化及畸形所对应的废水浓度。Note: ELC50, HEC50and MEC50respectively represent the concentration of wastewater for 50% of embryonic mortality, hatching and malformation. 表7 制革废水进水及不同工艺段出水对斑马鱼胚胎急性毒性和发育毒性的毒性当量Table 7 Toxicity unit of tannery wastewater influent and effluents from different treatment units in acute and developmental toxicity test with zebrafish embryos 图3 CASS工艺出水对斑马鱼胚胎早期发育的影响注:a,d,g分别为24 h、48 h和72 h正常发育的胚胎或孵化的幼鱼;b,染毒后24 h眼点未发育的胚胎;c,染毒后24 h尾巴未延展的胚胎; e,染毒后48 h心包水肿的胚胎;f,染毒后48 h尾巴弯曲的胚胎;h,染毒后72 h脊椎弯曲的胚胎;i,染毒后72 h未孵化的胚胎。Fig. 3 Effect on the early development of zebrafish embryo exposed to effluent after treatment by CASSNote: (a, d, g) 24,48,72 h-normal development; (b) 24 h-no development of the embryonic eyespot;(c) 24 h-no extension of the embryonic tail; (e) 48 h-pericardial edema; (f) 48 h-tail curving; (h)72h-malformed larvae treated with wastewater); (i) 72h-unhatched embryos 3.1 斑马鱼对制革废水的敏感性 本研究选择了斑马鱼幼鱼及其胚胎为受试生物,对制革废水的毒性进行了评价,并与发光菌测试结果进行比较,结果表明,斑马鱼胚胎具有较高的敏感性,敏感性从大到小分别为斑马鱼胚胎>明亮发光杆菌>斑马鱼幼鱼>费氏弧菌。可看出斑马鱼幼鱼对制革废水的敏感性要弱于胚胎,但这与原居林等[12]的研究结果正好相反。 有研究表明发光菌在pH为5.0~9.0时,其发光强度不受pH的影响,通过表1可看出待测废水的pH值在7.0左右,因此发光菌的发光强度几乎不受pH的影响[13]。此外,吴寅等[14]发现当pH为6.0~8.0时,斑马鱼胚胎的致死率及孵化率无显著变化。通过以上分析可推断待测废水的pH值对发光菌及斑马鱼的毒性几乎无影响。 Cabral等[15]和Lue-Kim[16]等研究发现,存在于废水中的金属会破坏细胞膜结构,使非极性有机物更容易穿过细胞膜从而造成毒性。除此之外,该制革废水氨氮含量比较低,而有研究表明,氨氮对幼鱼生长存在着抑制作用[17]。这表明当氨氮含量较低时,会削弱废水对幼鱼的毒性作用。本文的结果结合之前的研究可知,造成斑马鱼胚胎敏感性高于幼鱼的主要原因可能是本研究中采集的制革废水的电导率较高,且重金属Cr、Zn及Cu含量也比较高以及氨氮含量低所致。有研究表明当pH值为7.0时,Cu2+对斑马鱼胚胎的96 h-EC50为0.096 mg·L-1[14],而本研究待测废水的进水、混凝沉淀池出水及最终出水的重金属Cu含量分别为0.163、0.142及0.022 mg·L-1,所以推断Cu2+会对斑马鱼胚胎的发育、死亡及孵化产生较大的影响。 有研究表明,废水中的联苯胺类[18]、烷基酚类[19]和壬基酚[20]等有机污染物会对斑马鱼胚胎的早期阶段产生一定的毒害作用,因此推断可能制革废水中也含有一定量的这类有机污染物,这可能是造成对胚胎毒性高于幼鱼的原因之一,这个问题需要进一步的研究证实。 3.2 制革废水的毒性评价及削减评估 制革废水进水及不同工艺段出水除了对发光菌、斑马鱼幼鱼及胚胎产生急性毒性,还对斑马鱼胚胎的发育具有抑制作用,主要体现在对各发育阶段毒性终点的影响,如24 h尾巴未延展、48 h心包水肿、72 h脊椎弯曲等。Lin等[21]评价了西维因对斑马鱼胚胎早期发育的影响,观察到心包水肿的现象。同时,Zhang等[22]通过将斑马鱼胚胎暴露于巯基丙酸修饰的CdSe量子点溶液中,观察到染毒后24 h尾巴未延展及72 h脊椎弯曲等现象。目前尚未有机制能够解释胚胎产生畸形的原因,但Cheng等[23]提出假设,产生脊柱弯曲可能是由于肌球蛋白和肌节合成减少引起的,这个假设仍需要得到进一步的实验证实。 本研究还对制革废水处理工艺的毒性削减进行了评估。进水、混凝沉淀池出水、CASS工艺出水对斑马鱼胚胎致死率的毒性当量分别为5.18 TUa、1.52 TUa和0.5 TUa,通过此结果可得到污水处理工艺对毒性的总去除率为90.3%,其中从粗格柵到混凝沉淀工艺的去除率为70.7%,CASS工艺对毒性的去除率达到67.1%。由表1和表2可以看出,经过混凝沉淀池出水之前的工艺处理,COD、总磷及重金属并未得到去除,但由斑马鱼胚胎毒性试验来看,毒性得到了很大削减。这是因为水解酸化池将高毒性的大分子化合物转化成了低毒性的小分子化合物,而且混凝沉淀工艺也会使重金属进入污泥而被转移,从而大大降低了废水的毒性。而斑马鱼幼鱼96 h急性毒性试验,反映出CASS工艺对毒性的去除率达到了100%;通过发光菌急性毒性试验,可发现CASS工艺的毒性去除率也达到了100%,这说明经过CASS工艺处理后,废水中能对费氏弧菌及明亮发光杆菌的发光作用产生抑制效应的有毒物质都被去除。 因而,仅依靠单一生物毒性试验不能全面而准确地评价废水的毒性,而利用由处于不同营养级的生物组成的成组生物毒性试验可更直观地反映出废水的综合毒性[24]。本研究中制革废水的最终出水的常规理化指标均达到了《污水综合排放标准》(GB 8978—1996)的排放要求;且通过发光菌及斑马鱼幼鱼急性毒性试验也发现经过处理的制革废水毒性已降至检测限以下,即0 TUa。但斑马鱼胚胎发育毒性试验结果显示,经过处理的制革废水不仅存在急性毒性,基础毒性当量为0.5 TUa,同时还对胚胎的发育存在一定影响,对胚胎孵化及致畸的毒性当量分别为0.7 TUa和0.13 TUa。按照美国国家环境保护局(USEPA)标准,当急性毒性TUa <0.3时为安全浓度[25]。因而,制革废水综合毒性基本达到USEPA的排放标准,对环境的影响已得到初步有效控制,但仍需要进一步处理以达到更大程度削减毒性的目的。 综上所述,斑马鱼及其胚胎是较好的毒性评价的模式生物,可应用于制革废水的综合毒性评价及不同处理工艺段出水的毒性削减评估。基于毒性单位的评估技术,可为决策机构制定更完善的污染源控制策略,为污染源企业改进处理工艺提供可靠的数据支持,同时也为基于生物毒性的制革废水综合达标排放提供参考。 [1] 牛艳芳, 马兴元, 吕凌云, 等. 制革废水处理新技术存在的问题和解决方法[J]. 中国皮革, 2009, 11(38): 37-41 Niu Y F, Ma X Y, Lv L Y, et al. Problem and solution of new processes of tannery effluent [J]. China Leather, 2009, 11(38): 37-41(in Chinese) [2] 李晓星, 俞从正, 马兴元. 制革废水处理的研究进展[J]. 中国皮革, 2003, 32(19): 26-31 Li X X, Yu C Z, Ma X Y. Progress of study on treatment of effluent from tannery [J]. China Leather, 2003, 32(19): 26-31(in Chinese) [3] Tigini V, Giansanti P, Mangiavillano A, et al. Evaluation of toxicity, genotoxicity and environmental risk of simulated textile and tannery wastewaters with a battery of biotests [J]. Ecotoxicology and Environmental Safety, 2011, 74(4): 866-873 [4] Meric S, De Nicola E, Iaccarino M, et al. Toxicity of leather tanning wastewater effluents in sea urchin early development and in marine microalgae [J]. Chemosphere, 2005, 61(2): 208-217 [5] Oral R, Meric S, Nicola E D, et al. Multi-species toxicity evaluation of a chromium-based leather tannery wastewater [J]. Desalination, 2007, 211(1): 48-57 [6] 肖羽堂, 陈昌振. 印染废水深度脱色处理及其出水急性毒性研究[C]. 武汉, 中国水处理技术研讨会暨第31届年会, 2011 [7] 高磊, 李兆利, 陈辉辉, 等. 染织排水对日本青鳉幼鱼和胚胎的毒性效应[J]. 生态毒理学报, 2011, 6(3): 303-309 Gao L, Li Z L, Chen H H, et al. Toxicity of dye effluent on Japanese Medaka(Oryzias latipes) embryo and larva [J]. Asian Journal of Ecotoxicology, 2011, 6(3): 303-309(in Chinese) [8] 国家环境保护总局. GB/T 13267—1991 水质: 物质对淡水鱼(斑马鱼)急性毒性测定方法[S]. 北京: 中国标准出版社, 1991 [9] 刘保奇, 葛会林, 刘树深. 测定环境污染物对青海弧菌发光强度抑制的微板发光法研究[J]. 生态毒理学报, 2006, 1(2): 186-191 Liu B Q, Ge H L, Liu S S. Microplate luminometry for toxicity bioassay of environmental pollutant on a new type of fresh water luminescent bacterium(Vibrio-qinghaiensis sp.-Q67) [J]. Asian Journal of Ecotoxicology, 2006, 1(2): 186-191(in Chinese) [10] ISO. 1996. Water Quality-Determination of the Acute Lethal Toxicity of Substances to a Freshwater Fish [Brachydanio rerio Hamilton-Buchanan(Teleostei, Cyprini- dae)]-Part 1: Static Method. ISO7346-1. [S]. Geneva: ISO, 1996 [11] 孔志明, 杨柳燕, 尹大强, 等. 现代环境生物学实验技术与方法[M]. 北京: 中国环境科学出版社, 2005: 2-6 [12] 原居林, 顾志敏, 叶金云, 等. 纺织印染废水及其底泥对太湖花早期发育的毒性研究[J]. 环境科学学报, 2012, 32(3): 762-768 Yuan J L, Gu Z M, Ye J Y, et al. Toxicity of printing and dyeing wastewater and sediment on the early development stages of the Hemibarbus maculates in the Taihu Lake [J]. Acta Science Circumstantiae, 2012, 32(3): 762-768(in Chinese) [13] 于瑞莲, 胡恭任. 不同pH值下对发光菌的毒性及QSAR研究[J]. 环境科学与技术, 2005, 28(4): 20-22 [14] 吴寅, 吴永贵, 马岚, 等. 水体酸化条件下Cu(II)对斑马鱼胚胎的毒性效应[J]. 生态毒理学报, 2013, 8(3): 389-394. Wu Y, Wu Y G, Ma L, et al. Toxic effect of Cu(II) on zebrafish embryos under water acidification condition [J]. Asian Journal of Ecotoxicology, 2013, 8(3): 389-394 (in Chinese) [15] Cabral J. P. S. Cupric ions induce both an efflux of potassium and low molecular mass metabolites in Pseudomonas syringae [J]. FEMS Microbiology Letters, 1990, 72(1-2): 109-112 [16] Lue-Kim H, Wozniak P C, Fletcher R A. Cadmium toxicity on synchronous populations of Chlorella ellipsoidae [J]. Canadian Journal of Botany, 1980, 58(16): 1780-1788 [17] Sun H J, Yang W, Chen Y, et al. Effect of purified microcystin on oxidative stress of silver carp Hypophthalmichthys molitrix larvae under different ammonia concentrations [J]. Biochemical Systematics and Ecology, 2011, 39(4-6): 536-543 [18] 刘红玲, 于红霞, 姜威, 等. 联苯胺类化合物对斑马鱼胚胎发育毒性的初步研究[J]. 生态毒理学报, 2007, 2(1): 94-99 Liu H L, Yu H X, Jiang W, et al. Preliminary study on zebrafish embryo-toxicity of benzidine congeners [J]. Asian Journal of Ecotoxicology, 2007, 2(1): 94-99(in Chinese) [19] 刘红玲, 周宇, 许妍, 等. 氯代酚和烷基酚类化合物对斑马鱼胚胎发育影响的研究[J]. 安全与环境学报, 2004, 4(4): 3-6 Liu H L, Zhou Y, Xu Y, et al. Investigation of toxicity effect for chlorophenols and alkyl phenols on zebrafish embryos [J]. Journal of Safety Environment, 2004, 4(4): 3-6(in Chinese) [20] 刘晓丽, 汪奇, 贾林芝, 等. 壬基酚对斑马鱼精巢组织及性激素合成酶基因表达的影响[J]. 环境科学学报, 2011, 31(11): 2523-2529 Liu X L, Wang Q, Jia L Z, et al. Alterations in testicular histology and the mRNA of enzymes responsible for sex steroid synthesis in the zebrafish Danio rerio exposed to nonyphenol [J]. Acta Science Circumstantiae, 2011, 31(11): 2523-2529(in Chinese) [21] Lin C C, Hui M N Y, Cheng S H. Toxicity and cardiac effects of carbaryl in early developing zebrafish(Danio rerio) embryos [J]. Toxicology and Applied Pharmacology, 2007, 222(2): 159-168 [22] Zhang W, Lin K F, Sun X, et al. Toxicological effect of MPA-CdSe QDs exposure on zebrafish embryo and larvae [J]. Chemosphere, 2012, 89(1): 52-59 [23] Cheng S H, Wai A W K, So C H, et al. Cellular and molecular basis of cadmium-induced deformities in zebrafish embryos [J]. Environmental Toxicology and Chemistry, 2000, 19(12): 3024-3031 [24] 邹叶娜, 蔡焕兴, 薛银刚, 等. 成组生物毒性测试法综合评价典型工业废水毒性[J]. 生态毒理学报, 2012, 7(4): 381-388 Zou Y N, Cai H X, Xue Y G, et al. Synthetic evaluation on toxicity of typical industrial effluents using a battery of bioassays [J]. Asian Journal of Ecotoxicology, 2012, 7(4): 381-388 (in Chinese) [25] 赵俊杰, 周斌, 沈新强. 造纸废水排放对海洋生态环境和渔业资源的影[J]. 水道港口, 2012, 33(2): 168-172 Zhao J J, Zhou B, Shen X Q. Influence of paper mill effluent on oceanic ecological environment and fishery resources [J]. Journal of Waterway and Harbor, 2012, 33(2): 168-172 (in Chinese) ◆ EvaluationofTanneryWastewaterToxicityandItsReductionBasedonZebrafishandLuminescentBacteria Chen Wenyan1,2, Zhao Yuan1, Zheng Guojuan2, Ma Yong3, Lei Chunsheng1, Cai Qiang2,* 1.Environment & Safety Engineering Institute, Changzhou University, Changzhou 213164, China 2. Yangtze Delta Region Institute of Tsinghua University, Jiaxing 314006, China 3. Zhejiang Province Environmental Monitoring Center, Hangzhou 310012, China 20 November 2013accepted10 January 2014 The environmental problems caused by the rapid development of leather industry in China, are receiving more and more attention. In the present study, several organisms of Vibrio fischeri, Vibrio phosphoreum, zebrafish larvae and embryo were applied to evaluate the acute and developmental toxicity of tannery wastewater, the removal rate of toxicity by treatment process and the sensitivity of different organisms to the toxicity of tannery wastewater. The results showed that the sensitivities followed the sequence of zebrafish embryo> Vibrio phosphoreum >zebrafish larvae > Vibrio fischeri. The acute toxicity of tannery wastewater was completely removed after the treatment of whole process according to the acute toxicity test of luminescent bacteria and zebrafish larvae (0 TUa). However, the results from the toxicity study with zebrafish embryos showed that the final effluent of tannery wastewater after treatment still had acute toxicity (0.5 TUa) and developmental toxicity (0.7 TUa to hatching rate, 0.13 TUa to malformation rate). It is indicated that the toxicity of tannery wastewater was roughly removed by the present treatment process, but further treatment was still needed for complete toxicity reduction. zebrafish; luminescent bacteria; tannery wastewater; toxicity evaluation 国家科技支撑计划课题(2011BAF02B06);嘉兴市科技计划课题(2012AE1012);国家自然科学基金(51208068) 陈文艳(1989-),女,硕士,研究方向为生态毒理学,E-mail: chen13812823711@163.com; *通讯作者(Corresponding author),E-mail: Caiqfox@163.com 10.7524/AJE.1673-5897.20131120001 陈文艳,赵远,郑国娟,等. 基于斑马鱼和发光细菌评估制革废水毒性及其削减效率[J]. 生态毒理学报, 2014, 9(2): 358-366 Chen W Y, Zhao Y, Zheng G J, et al. Evaluation of tannery wastewater toxicity and reduction effect based on zebrafish and luminescent bacteria [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 358-366 (in Chinese) 2013-11-20录用日期2014-01-10 1673-5897(2014)2-358-09 X171.5 A 蔡强(1972—),男,环境科学与工程博士,研究员,主要研究方向现代环境监测技术,尤其侧重于基于生物化学原理的环境风险检测与分析。

3 讨论(Discussion)
