热带爪蟾(Xenopus tropicalis)胚胎在生态毒理学中的应用前景
2014-09-21施华宏朱静敏朱攀杨红伟吴粒铰
施华宏,朱静敏,朱攀,杨红伟,吴粒铰
1. 华东师范大学 河口海岸学国家重点实验室, 上海 200062 2. 华东师范大学 资源与环境科学学院环境科学系,上海 200062 3. 上海海洋大学 海洋科学学院,上海 201306
热带爪蟾(Xenopus tropicalis)胚胎在生态毒理学中的应用前景
施华宏1,*,朱静敏1,朱攀2,杨红伟3,吴粒铰1
1. 华东师范大学 河口海岸学国家重点实验室, 上海 200062 2. 华东师范大学 资源与环境科学学院环境科学系,上海 200062 3. 上海海洋大学 海洋科学学院,上海 201306
首先介绍了热带爪蟾(Xenopus tropicalis)作为新的模式动物的发展过程以及热带爪蟾基因组学方面的研究进展,概述了非洲爪蟾(X. laevis)胚胎在生态毒理学中的应用。在此基础上,详细讨论了热带爪蟾胚胎在污染物致毒效应和作用机理、毒理学理论和环境样品生态毒性检测等方面的应用现状和前景。最后,简要介绍了目前国内外有关热带爪蟾网站、书籍和养殖等方面的信息资源。
热带爪蟾;胚胎;模式动物;发育毒性
近年来,一种新的模式动物——热带爪蟾(Xenopus tropicalis)逐渐进入人们的视线。热带爪蟾与非洲爪蟾(X. laevis)是近缘种,非洲爪蟾由于具有饲养简单、生长周期短和产卵量大等特点一直被作为发育生物学、胚胎学和细胞生物学最重要的模式动物之一,这些领域很多重大的发现都是通过对非洲爪蟾的研究得出的[1]。毛炳宇[2]对爪蟾作为模式动物的发展过程进行了详细的介绍,并盛赞爪蟾是模式动物中的“青蛙王子”。2012年的“诺贝尔生理学或医学奖”得主约翰·格登的一个重要贡献就在于:将非洲爪蟾的小肠上皮细胞核注入去核的卵细胞,结果发现一部分卵依然可以发育成蝌蚪,而其中的一部分蝌蚪还可以继续发育成为成熟的爪蟾。由此可见非洲爪蟾作为模式动物的重要地位。
从20世纪80年代开始,爪蟾开始被应用于生态毒理学的研究,主要有以下3个方面:(1)运用爪蟾胚胎检测污染物的发育毒性,即爪蟾胚胎致畸实验(FETAX, the frog embryo teratogenesis assay-Xenopus)。这是爪蟾最早被运用于生态毒理学研究领域,后文将对此作详细介绍;(2)运用爪蟾研究污染物对动物的生殖毒性。如Hayes等[3]以爪蟾为实验模型研究了阿特拉津(atrazine)对两栖类动物生殖系统的影响,而科学界关于阿特拉津生殖毒性的争论使更多人认识了非洲爪蟾这一动物。(3)运用爪蟾蝌蚪筛选甲状腺激素干扰物,即两栖类变态实验(AMA, amphibian metamorphosis assay)。由于两栖类变态过程受甲状腺激素的直接调控,因此爪蟾可作为研究甲状腺激素干扰物对动物发育影响的理想模型[4]。经济合作与发展组织(Organization for Economic Co-operation and Development, OECD)经过多轮论证后于2008年发布了AMA的实验指南[5],从而确立了爪蟾作为模式动物在生态毒理学领域不可取代的作用和地位。
在上述的研究中,人们主要运用非洲爪蟾作为动物模型。Kloas和Lutz[6]综述了爪蟾在环境内分泌干扰物研究方面的应用;秦占芬等[7-9]发表了系列文章详细介绍了非洲爪蟾在生态毒理学(尤其是在甲状腺激素干扰物和生殖毒性研究)中的应用;胡晓燕等[10]专门介绍了非洲爪蟾在农药毒理学中的应用。而自2001年以来,热带爪蟾受到人们的特别关注。与非洲爪蟾相比,热带爪蟾作为实验动物模型更有优势,它不仅在发育生物学和医学等领域有取代非洲爪蟾的趋势,在生态毒理学研究中也显示出良好的应用前景[11-13]。然而,我国运用热带爪蟾来开展研究工作的人员还十分有限,因此有必要对这一新的模式动物进行介绍和推广。与非洲爪蟾一样,热带爪蟾可以较好地应用于甲状腺激素干扰物和生殖毒性的研究。同时,发育毒性是生态毒理学研究的重要方向之一,也是今后毒性检测中优先发展的方向。因此,本文将重点介绍热带爪蟾胚胎在生态毒理学中的应用。
1 新的模式动物——热带爪蟾
与非洲爪蟾相比,热带爪蟾具有个体更小、生长周期更短(3~6个月)、产卵量更大(2 000~3 000个)、基因组结构(2倍体)更简单和胚胎发育更快等优点。1990年,美国加州大学弗朗西斯科分校的科研人员引进了原产于科特迪瓦(Ivory Coast)和尼日利亚(Nigeria)的热带爪蟾,随即弗吉尼亚大学罗伯特的实验室又从加州大学引进了这2个品系,用于自然突变的基因筛选工作。随后,几组科学家举办了一些非正式的会议,如1992年底在美国举办了“第一届热带爪蟾国际会议”,参加此次会议的很多成员随后为热带爪蟾作为模式动物模型的发展做出了重要贡献。由于热带爪蟾比非洲爪蟾更适合于分子生物学操作,Amaya等[14]预测爪蟾将能较快地“跳入”未来的研究领域。1999年是爪蟾作为模式动物的一个大的转折点。这一年,美国国立健康研究院主办了关于“非哺乳动物模型”的会议,旨在对需要优先发展的动物模型进行评估。热带爪蟾也位列其中,随后,国立健康研究院在其基金申请指南中明确指出对以热带爪蟾为动物模型开展人类疾病研究的项目给予优先资助。
2001年,热带爪蟾又迎来了一个里程碑式的时刻:美国能源部联合基因组研究所(JGI)启动了热带爪蟾基因组计划。2010年,研究组公布了热带爪蟾基因组草图[15]。分析显示,热带爪蟾与人类基因组拥有相当多的共性。这表明,人们可以研发一种蛙类的模型来更好地阐释形形色色的人类疾病的分子机制[15]。随着热带爪蟾基因组计划的完成,多篇综述文章大胆地预测了其未来的应用前景。如Harland和Grainger[1]认为爪蟾作为模式动物将因为基因组方面的突破而完成一个“变态”过程。
2 非洲爪蟾胚胎在生态毒理学中的应用概况
Bantle等[16]于20世纪80年代早期就开始运用非洲爪蟾胚胎进行污染物的毒性检测,这一方法被简称为FETAX。1991年美国试验和材料协会(ASTM)将其标准化为一种可供选择的发育毒性筛选试验,用于检测污染物的发育毒性。具体操作为:将处于NF8-11阶段的非洲爪蟾胚胎暴露于受试液4 d,通过对胚胎死亡率、畸形率及生长抑制率等指标的检测来评价污染物的发育毒性[17]。比起用传统哺乳动物进行的发育毒性研究,FETAX更能节约动物数量、时间和资金,并有利于研究化学物质的转化、解毒和相关机制等。FETAX被应用于化学品、药物和环境样品发育毒性的检测(表1)[18-39]。
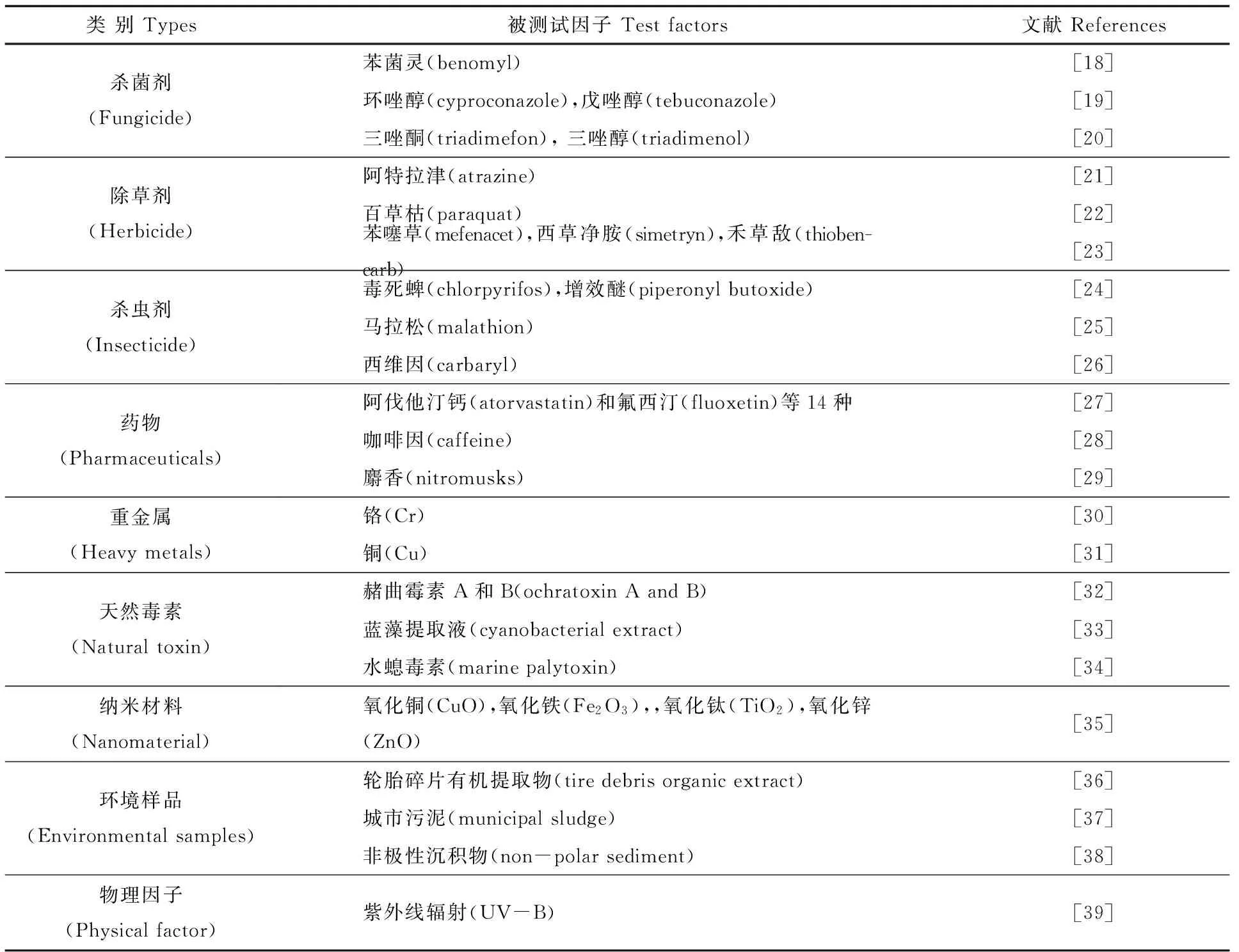
表1 运用爪蟾胚胎致畸实验进行发育毒性检测的研究Table 1 Studies of developmental toxicity with the frog embryo teratogenesis assay-Xenopus (FETAX)
随后,美国国家环保局(EPA)试图将FETAX发展为一种化学品发育毒性的风险评价方法,但对该方法的最终评估结果为:FETAX实验并不比现有的毒性测试方法具有更高的灵敏性[40]。这一评估使FETAX的应用处于一种较为尴尬的境地。一方面,FETAX在其后也被应用于发育毒性的研究之中(表1),并仍作为ASTM的标准方法;在最近出版的药物毒性评估和致畸性检测等方面的操作指南中,FETAX也仍被作为重点推荐的方法[41-42]。但另一方面,相对于近年来斑马鱼胚胎致畸实验受到的高度关注而言,爪蟾胚胎致畸实验的应用还十分有限。随着对体外毒理学测试方法的需求,欧盟加强了斑马鱼胚胎致畸实验的方法优化和推广,尤其是近几年应用斑马鱼胚胎致畸实验开展生态毒理学和药理学研究的实验性论文和综述明显增多[43-46]。
3 热带爪蟾胚胎在生态毒理学中的应用现状与前景
研究表明,热带爪蟾蝌蚪不仅可以和非洲爪蟾蝌蚪一样应用于甲状腺激素干扰物的筛选[47-48],而且由于热带爪蟾性成熟快使得在生殖毒性的研究中比非洲爪蟾更有优势[49-53]。在热带爪蟾作为模式生物的发展日益成熟和毒理学体外测试方法需求强烈的双重背景下,胚胎期的热带爪蟾能否在生态毒理学研究中发挥更重要的作用呢?下面将从4个方面详细介绍热带爪蟾胚胎在生态毒理学领域的应用。
3.1 在污染物发育毒性和环境内分泌干扰效应检测方面的应用
Fort等[54-55]的研究表明,与非洲爪蟾一样,热带爪蟾可以应用于胚胎致畸实验,而且比使用非洲爪蟾所需时间更短。爪蟾早期胚胎不仅具有清晰的外观形态特征,而且对一些污染物响应敏感,产生明显的畸形现象,这些畸形表型(phenotype)为污染物毒性效应的评估提供了十分有用的信息。在利用热带爪蟾胚胎研究污染物的发育毒性研究中,建立基于表型的毒性效应评估方法是一种值得尝试的新思路。Wheeler和Brändli[56]运用热带爪蟾胚胎的表型特征成功地进行了分子靶向药物的筛选。笔者运用热带爪蟾检测了多种污染物的发育毒性[57-60],其中畸形表型是主要的评价指标。由于甲状腺激素在爪蟾胚胎期也起着重要作用,研究表明一些污染物能通过影响胚胎的甲状腺激素信号而对胚胎的发育造成影响,Fini等[61]提出,可以利用转基因的非洲爪蟾胚胎来筛选甲状腺激素干扰物。目前,OECD正将这一提议作为有效的体外实验方法进行考虑[62],热带爪蟾由于基因组结构简单,更适合于运用在类似的实验计划之中。
3.2 在污染物致毒机理研究中的应用
热带爪蟾在基因组学方面的研究进展和技术资源为研究污染物的致毒机制提供了有力的支持[63-64]。作为发育生物学模式动物,人们不仅对爪蟾的发育过程进行了详细的研究,有着丰富的背景资料,而且在热带爪蟾胚胎基因组方面也取得了突破性进展,利用胚胎进行操作的分子生物学技术也日趋成熟并不断发展[65-68]。“他山之石,可以攻玉”,在生态毒理学研究中应考虑逐步引入一些成熟的技术方法。例如,筛选污染物对胚胎可能作用的靶基因,可以使用基因组学的方法;研究基因在胚胎上的空间分布,可以使用整体胚胎荧光原位杂交(FISH)的方法;确证某个靶基因的功能,可以采用反义吗啡啉技术(MO)进行基因敲除。这些技术在解析污染物发育毒性机理中将发挥重要作用,尤其是将研究基因的方法同致畸实验中的表型特征结合起来,如表型锚定(phenotype anchoring)的方法,这些研究思路将使爪蟾在生态毒理学中起着更重要的作用。笔者利用热带爪蟾研究了典型污染物三苯基锡和四溴双酚-A等的致畸特性[60,69]。结果表明,一些污染物能够引起爪蟾胚胎独特的畸形特征,如有机锡化合物在环境浓度能引起胚胎鳍的消失和泄殖腔的拉长等[59,69]。根据这些特殊表型,结合组织学和分子生物学的技术手段,将有效地揭示污染物的致畸机理[70]。
此外,两栖类在发育过程中有特殊的调控机制[71]。例如,两栖类的变态过程专门由甲状腺激素进行调控,而最近的研究表明,甲状腺激素在爪蟾胚胎的早期发育过程中也起着重要的作用[72-74]。如果能充分利用这些特殊的调控机制,不仅能增强热带爪蟾在生态毒理学中的应用能力,而且能为我们提供毒性测试或毒理学研究的新方法。
3.3 在毒理学理论研究方面的应用
在毒理学研究中,通常研究污染物的剂量-效应和时间-效应关系,而实际上,除了上述2种关系外,污染物在生物不同阶段进行暴露其毒性效应也具有较大差异,尤其是生物的早期发育阶段。我们暂称这种关系为“暴露窗-效应”关系。在剂量-效应和时间-效应关系中,人们已建立了丰富的毒理学理论。然而,人们对“暴露窗-效应”关系的研究极少。热带爪蟾不仅发育阶段明晰和早期发育过程背景资料丰富,而且一对热带爪蟾一次能产下2 000~3 000个胚胎甚至更多,胚胎特有的黑褐色和大小十分便于肉眼观察,加之胚胎发育快速。这些特点使人们在同期开展大批量、短周期实验成为可能,有利于多浓度、多时段和多配比等较为复杂实验设计方案的实施和完成。因此,热带爪蟾胚胎是研究“暴露窗-效应”关系的理想模型。笔者运用热带爪蟾研究了胚胎对三苯基锡响应的敏感阶段,结果发现热带爪蟾胚胎在NF40-41阶段对三苯基锡的响应最敏感[75],而斑马鱼对三苯基锡的暴露并不具有阶段敏感性[76]。目前,笔者正运用多种污染物对热带爪蟾胚胎进行分阶段暴露,试图揭示污染物的“暴露窗-效应”关系。
此外,热带爪蟾胚胎产量大也为污染物的复合致毒机制研究提供了理想模型。Herkovits和Helguero[77]用非洲爪蟾胚胎研究了多种重金属两两联合暴露的复合毒性,笔者运用热带爪蟾胚胎研究了三苯基锡与维甲酸X受体的联合毒性,并建立了基于表型特征的分级评价指标[78]。
3.4 在环境样品生态毒性检测中的应用
环境样品往往具有样品量大和保存困难等特点。爪蟾产卵量大和胚胎致畸实验周期短的优点使之在环境样品的生态毒性检测中具有较大优势。非洲爪蟾胚胎曾被用于多种不同类型环境样品的生态毒性检测,同样,热带爪蟾胚胎也可以用于检测环境样品的生态毒性。笔者运用热带爪蟾胚胎检测了典型黑臭河道和长江口底泥的生态毒性,结果表明,热带爪蟾胚胎可以有效地区分不同站点和不同季节底泥的生态毒性,而且爪蟾胚胎的畸形表型特征为污染源识别提供了帮助[79-80]。
4 热带爪蟾信息资源介绍
尽管热带爪蟾作为模式动物发展的历史不长,但目前热带爪蟾作为模式动物的体系已基本形成。从热带爪蟾的商品化供应到养殖方法的介绍,从基因组数据库到各项分子技术操作指南,各方面的信息资源都十分丰富,为我们运用热带爪蟾开展研究提供了有力的支撑。下面就从互联网资源、书籍和热带爪蟾养殖体系建设等方面介绍相关的信息资源。
4.1 互联网资源
近年来,热带爪蟾基因组方面的数据库在急剧增加,而互联网平台也在迅猛发展,先后有多篇文章介绍热带爪蟾数据库的更新进展和对未来的憧憬[81-82]。互联网络已成为热带爪蟾科研工作者不可或缺的信息资源。最主要的有如下几个网站:(1)爪蟾联盟数据库:http//:www.xenbase.org。这是目前爪蟾最全面的数据库,包括爪蟾的基因组、解剖学特征、分子操作技术和养殖等各方面的信息。该网站在爪蟾基因信息方面具有强大的在线查询功能,多篇文献对此进行了详细介绍[81-83]。(2)哈里兰德热带爪蟾网:http://tropicalis.berkeley.edu/home。美国加州大学伯克利分校哈里兰德实验室建立的热带爪蟾网站,主要包括热带爪蟾的养殖、各项染色技术和分子生物学操作指南。(3)热带爪蟾之家:http://faculty.virginia.edu/xtropicalis。弗吉尼亚大学罗伯特等建立的网站,主要包括热带爪蟾基因识别和分析、爪蟾的发育突变、染色体核型分析、转基因和爪蟾养殖等内容。(4)热带爪蟾基因突变项目网站:http://www.sanger.ac.uk/Projects/D_rerio/xmp。英国Wellcome Trust基因科学园建立的热带爪蟾突变项目网站,该项目旨在通过基因敲除的方法来获得人类疾病的研究模型,目前已包含202个基因突变的表型。
4.2 书 籍
到目前为止,关于爪蟾生物学背景、养殖技巧和实验方法等的专著已有多部,主要包括:(1)《Early Development of Xenopus laevis: A Laboratory Manual》(爪蟾早期发育实验指南):该书对非洲爪蟾和热带爪蟾都适用,介绍了爪蟾的结构特征、饲养方法和多种胚胎操作技术。该书是进行爪蟾胚胎操作的基本读本,我国在2007年发行了其影印本[84]。(2)《Normal Table of Xenopus laevis (Daudin)》(爪蟾发育阶段图表):这是介绍爪蟾发育阶段划分标准的经典书籍,也可以看作是一本工具书。该书将爪蟾的发育分为66个阶段,对每一个阶段的外部形态和内部结构变化都进行了详尽的介绍[85]。(3)《Atlas of Xenopus Development》(爪蟾早期发育阶段解剖和组织学图谱):该书通过光学、电镜和组织切片图像,详细介绍了爪蟾胚胎的主要器官及组织结构[86]。(4)《The Laboratory Xenopus sp.》(爪蟾养殖),这本书主要介绍了爪蟾的养殖,尤其是爪蟾的常见疾病及其预防方法[87]。(5)《Xenopus Protocols》(爪蟾实验指南):属于斯普林格分子生物学方法中的系列书之一,到目前为止已出版2本。其中,2012年出版的指南被誉为后基因时代的爪蟾实验方法,主要是如何运用热带爪蟾作为实验模型的操作技巧[88]。这本书是目前介绍热带爪蟾基因技术最新和最全面的书籍,在斯普林格数据库中有其电子版本下载。
4.3 热带爪蟾的养殖系统、成蛙和饲料等信息
热带爪蟾与斑马鱼等模式动物的养殖系统有诸多相似之处,国内外商业化的养殖系统也都是参照成熟的斑马鱼养殖系统来设计。而事实上,很多爪蟾使用者都是自己设计和组装养殖系统,这样既经济又实用。爪蟾养殖系统的制作并不困难,上述的网站和书籍上都有详细的介绍。目前成蛙可以通过商业途径获得,美国有多家公司销售热带爪蟾,我国的使用者主要通过国内公司(如上海茂生生物科技有限公司)从国外进口。相对于非洲爪蟾,我国热带爪蟾的使用还非常有限。笔者的实验室和浙江大学黄晓实验室于2007年同时引进了热带爪蟾,此外,南昌大学和南京大学模式动物中心也引进过热带爪蟾。国际上已开发了专门用于爪蟾养殖的饲料,而且在爪蟾的不同成长阶段,食物会有所区别,如在蝌蚪期主要喂喜力(Sera Micron)饲料,而幼蛙和成蛙则喂不同粒径的颗粒饲料。这些饲料相对而言价格较高,尤其是还没有形成成熟的供货渠道。国内使用者主要采用牛心和丰龄虾等饲料。笔者实验室在爪蟾蝌蚪阶段主要喂热带鱼饲料(磨成粉末),幼蛙主要喂国产牛蛙饲料(根据幼蛙年龄将饲料粉碎为不同粒径),成蛙则使用牛蛙饲料和丰龄虾混合喂食。
鉴于热带爪蟾作为模式动物的诸多优势,其在发育生物学、医药学、病理学和毒理学等领域将有广阔的应用前景[56,74,89]。今后,在运用热带爪蟾胚胎开展生态毒理学研究的过程中,我们不仅要充分利用热带爪蟾自身的优点,同时更要充分利用爪蟾胚胎分子操作技术的研究进展,将畸形表型与分子机制结合起来,并逐步将基于污染物作用模式的研究方法运用到真实环境样品的检测与分析之中。
[1] Harland R M, Grainger R M. Xenopus research: Metamorphosed by genetics and genomics [J]. Trends in Genetics, 2011, 27(12): 507-515
[2] 毛炳宇. 非洲爪蟾: 模式生物里的青蛙王子[J]. 生命世界, 2008(5): 60-63
[3] Hayes T B, Collins A, Lee M, et al. Hermaphroditic, demasculinized frogs after exposure to the herbicide atrazine at low ecologically relevant doses [J].Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(8): 5476-5480
[4] Tata J R. Amphibian metamorphosis as a model for the developmental actions of thyroid hormone [J]. Molecular and Cellular Endocrinology, 2006, 246(1): 10-20
[5] OECD. OECD Guideline for the Testing of Chemicals: The Amphibian Metamorphosis Assay [R]. (2008-03-01) [2014-03-12]. www.oecd.org/chemicalsafety/testing/41620749.pdf.
[6] Kloas W, Lutz I. Amphibians as model to study endocrine disrupters [J]. Journal of Chromatography A, 2006, 1130(1): 16-27
[7] 秦占芬, 徐晓白. 非洲爪蟾在生态毒理学研究中的应用: 概述和实验动物质量控制科学通报[J]. 科学通报, 2006, 51(8): 873-878
[8] 秦晓飞, 秦占芬, 徐晓白. 非洲爪蟾在生态毒理学研究中的应用(Ⅱ): 甲状腺干扰作用评价[J]. 环境科学学报, 2009, 29(8): 1589-1597
Qin X F, Qin Z F, Xu X B. Application of Xenopus laevis in ecotoxicology (Ⅱ)-Evaluating thyroid disruption [J]. Acta Scientiae Circumstantiae, 2009, 29(8): 1589-1597 (in Chinese)
[9] 秦占芬, 李岩, 秦晓飞, 等. 非洲爪蟾在生态毒理学研究中的应用(Ⅲ)-生殖内分泌干扰作用的评价[J]. 生态毒理学报, 2009, 4(3): 315-323
Qin Z F, Li Y, Qin X F, et al. Application of Xenopus laevis in ecotoxicology(Ⅲ)-Evaluating reproductive endocrine disruption [J]. Asian Journal of Ecotoxicology, 2009, 4(3): 315-323 (in Chinese)
[10] 胡晓燕, 林志芬, 孔德洋, 等. 非洲爪蟾在农药毒理学研究中的应用[J]. 环境科学与技术, 2010, 33(12): 381-386
Hu X Y, Lin Z F, Kong D Y, et al. Application of Xenopus Laevis in pesticide toxicology [J]. Environmental Science and Technology, 2010, 33(12): 381-386 (in Chinese)
[11] Berg C, Gyllenhammar I, Kvarnryd M. Xenopus tropicalis as a test system for developmental and reproductive toxicity[J]. Journal of Toxicology and Environmental Health, Part A: Current Issues, 2009, 72(3-4): 219-225
[12] Showell C, Conlon F L. The western clawed frog (Xenopus tropicalis): An emerging vertebrate model for developmental genetics and environmental toxicology [J]. Cold Spring Harbor Protocols, 2009, 2009(9): pdb.emo131.
[13] Takase M, Mitsui N, Oka T, et al. Development of biomarkers of endocrine disrupting activity in emerging amphibian model, Silurana (Xenopus) tropicalis [J]. Environmental Sciences, 2007, 14(6): 285-296
[14] Amaya E, Offield M F, Grainger R M. Frog genetics: Xenopus tropicalis jumps into the future [J]. Trends in Genetics, 1998, 14(7): 253-255
[15] Hellsten U, Harland R M, Gilchrist M J, et al. The genome of the Western clawed frog Xenopus tropicalis [J]. Science, 2010, 328(5978): 633-636
[16] Bantle J A, Fort D J, James B L. Identification of developmental toxicants using the Frog Embryo Teratogenesis Assay-Xenopus (FETAX) [J]. Hydrobiologia, 1989, 188-189: 577-585
[17] American Society for Testing and Materials. Annual Book of ASTM Standards: 1991 [M]. Philadelphia: American Society for Testing & Materials, 1999: 39-91
[18] Yoon C S, Jin J H, Park J H, et al. The fungicide benomyl inhibits differentiation of neural tissue in the Xenopus embryo and animal cap explants [J]. Environmental Toxicology, 2003, 18(5): 327-337
[19] Di Renzo F, Bacchetta R, Bizzo A, et al. Is the amphibian X. laevis WEC a good alternative method to rodent WEC teratogenicity assay? The example of the three triazole derivative fungicides triadimefon, tebuconazole, cyproconazole [J]. Reproductive Toxicology, 2011, 32(2): 220-226
[20] Groppelli S, Pennati R, De Bernardi F, et al. Teratogenic effects of two antifungal triazoles, triadimefon and triadimenol, on Xenopus laevis development: Craniofacial defects [J]. Aquatic Toxicology, 2005, 73(4): 370-381
[21] Carr J A, Gentles A, Smith E E, et al. Response of larval Xenopus laevis to atrazine: Assessment of growth, metamorphosis, and gonadal and laryngeal morphology [J]. Environmental Toxicology and Chemistry, 2009, 22(2): 396-405
[22] Vismara C, Battista V, Vailati G, et al. Paraquat induced embryotoxicity on Xenopus laevis development [J]. Aquatic Toxicology, 2000, 49(3): 171-179
[23] Saka M. Acute toxicity of rice paddy herbicides simetryn, mefenacet, and thiobencarb to Silurana tropicalis tadpoles [J]. Ecotoxicology and Environmental Safety, 2010, 73(6): 1165-1169
[24] El-Merhibi A, Kumar A, Smeaton T. Role of piperonyl butoxide in the toxicity of chlorpyrifos to Ceriodaphnia dubia and Xenopus laevis [J]. Ecotoxicology and Environmental Safety, 2004, 57(2): 202-212
[25] Bonfanti P, Colombo A, Orsi F, et al. Comparative teratogenicity of Chlorpyrifos and Malathion on Xenopus laevis development [J]. Aquatic Toxicology, 2004, 70(3): 189-200
[26] Bacchetta R, Mantecca P, Andrioletti M, et al. Axial skeletal defects caused by carbaryl in Xenopus laevis embryos [J]. Science of the Total Environment, 2008, 392(1): 110-118
[27] Richard S M, Cole S E. A toxicity and hazard assessment of fourteen pharmaceuticals to Xenopus laevis larvae [J]. Ecotoxicology, 2006, 15(8): 647-656
[28] Fort D J, Stover E L, Propst T L, et al. Evaluation of the developmental toxicity of caffeine and caffeine metabolites using the frog embryo teratogenesis assay-Xenopus (FETAX) [J]. Food and Chemical Toxicology, 1998, 36(7): 591-600
[29] Chou Y J, Dietrich D R. Toxicity of nitromusks in early lifestages of South African clawed frog (Xenopus laevis) and zebrafish (Danio rerio) [J]. Toxicology Letters, 1999, 111(1): 17-25
[30] Bosisio S, Fortaner S, Bellinetto S, et al. Developmental toxicity, uptake and distribution of sodium chromate assayed by frog embryo teratogenesis assay-Xenopus (FETAX) [J]. Science of the Total Environment, 2009, 407(18): 5039-5045
[31] Fort D J, Stover E L, Lee C M, et al. Adverse developmental and reproductive effects of copper deficiency in Xenopus laevis [J]. Biological Trace Element Research, 2000, 77(2): 159-172
[32] O'Brien E, Prietz A, Dietrich D R. Investigation of the teratogenic potential of ochratoxin A and B using the FETAX system [J]. Birth Defects Research Part B, 2005, 74(5): 417-423
[34] Franchini A, Casarini L, Ottaviani E. Toxicological effects of marine palytoxin evaluated by FETAX assay [J]. Chemosphere, 2008, 73(3): 267-271
[35] Nations S, Wages M, Ca as J E, et al. Acute effects of Fe2O3, TiO2, ZnO and CuO nanomaterials on Xenopus laevis [J]. Chemosphere, 2011, 83(8): 1053-1061
[36] Mantecca P, Gualtieri M, Andrioletti M, et al. Tire debris organic extract affects Xenopus development [J]. Environment International, 2007, 33(5): 642-648
[37] Chenon P, Gauthier L, Loubi res P, et al. Evaluation of the genotoxic and teratogenic potential of a municipal sludge and sludge-amended soil using the amphibian Xenopus laevis and the tobacco: Nicotiana tabacum L. var. xanthi Dulieu [J]. Science of The Total Environment, 2003, 301(1-3): 139-150
[38] Gutleb A C, Mossink L, Schriks M, et al. Delayed effects of environmentally relevant concentrations of 3,3′,4,4′-tetrachlorobiphenyl (PCB-77) and non-polar sediment extracts detected in the prolonged-FETAX [J]. Science of the Total Environment, 2007, 381(1-3): 307-315
[39] Bruggeman D J, Bantle J A, Goad C. Linking teratogenesis, growth, and DNA photodamage to artificial ultraviolet b radiation in Xenopus laevis larvae [J]. Environmental Toxicology and Chemistry, 1998, 17(10): 2114-2121
[40] Hoke R A, Ankley G T. Application of frog embryo teratogenesis assay-Xenopus to ecological risk assessment [J]. Environmental Toxicology and Chemistry, 2005, 24(10): 2677-2690
[41] Mouche I, Malesic L, Gillardeaux O. FETAX assay for evaluation of developmental toxicity [J]. Methods in Molcular Biology, 2011, 691: 257-269
[42] Leconte I, Mouche I. Frog embryo teratogenesis assay on Xenopus and predictivity compared with in vivo mammalian studies [J]. Methods in Molcular Biology, 2013, 947: 403-421
[43] Ali S, Van Mil H G J, Richardson M K. Large-scale assessment of the zebrafish embryo as a possible predictive model in toxicity testing [J]. PloS one, 2011, 6(6): e21076
[44] Brannen K C, Panzica-Kelly J M, Danberry T L, et al. Development of a zebrafish embryo teratogenicity assay and quantitative prediction model [J]. Birth Defects Research Part B, 2010, 89(1): 66-77
[45] McGrath P, Li C Q. Zebrafish: A predictive model for assessing drug-induced toxicity [J]. Drug Discovery Today, 2008, 13(9): 394-401
[46] Yang L, Ho N Y, Alshut R, et al. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals [J]. Reproductive Toxicology, 2009, 28(2): 245-253
[47] Carlsson G, Norrgren L. The impact of the goitrogen 6-propylthiouracil (PTU) on West-African clawed frog (Xenopus tropicalis) exposed during metamorphosis [J]. Aquatic Toxicology, 2007, 82(1): 55-62
[48] Saka M, Tada N, Kamata Y. Examination of an amphibian metamorphosis assay under an individual-separated exposure system using Silurana tropicalis tadpoles [J]. Ecotoxicology and Environmental Safety, 2012, 86: 86-92
[49] Schwendiman A L, Propper C R. A common environmental contaminant affects sexual behavior in the clawed frog, Xenopus tropicalis [J]. Physiology & Behaviour, 2012, 106(4): 520-526
[50] Porter K L, Olmstead A W, Kumsher D M, et al. Effects of 4-tert-octylphenol on Xenopus tropicalis in a long term exposure [J]. Aquatic Toxicology, 2011, 103(3-4): 159-169
[51] Kvarnryd M, Grabic R, Brandt I, et al. Early life progestin exposure causes arrested oocyte development, oviductal agenesis and sterility in adult Xenopus tropicalis frogs [J]. Aquatic Toxicology, 2011, 103(1): 18-24
[52] Knechtges P L, Sprando R L, Porter K L, et al. A novel amphibian tier 2 testing protocol: A 30-week exposure of Xenopus tropicalis to the antiandrogen flutamide[J]. Environmental Toxicology and Chemistry, 2007, 26(3): 555-564
[53] Olmstead A W, Kosian P A, Johnson R, et al. Trenbolone causes mortality and altered sexual differentiation in Xenopus tropicalis during larval development [J]. Environmental Toxicology and Chemistry, 2012, 31(10): 2391-2398
[54] Fort D J, Rogers R L, Thomas J H, et al. Comparative sensitivity of Xenopus tropicalis and Xenopus laevis as test species for the FETAX model [J]. Journal of Applied Toxicology, 2004, 24(6): 443-457
[55] Song M O, Fort D J, McLaughlin D L, et al. Evaluation of Xenopus tropicalis as an alternative test organism for frog embryo teratogenesis assay-Xenopus (FETAX)[J]. Drug and Chemical Toxicology, 2003, 26(3): 177-189
[56] Wheeler G N, Brändli A W. Simple vertebrate models for chemical genetics and drug discovery screens: Lessons from zebrafish and Xenopus [J]. Developmental Dynamics, 2009, 238(6): 1287-1308
[57] 钱丽娟, 刘青坡, 曹庆珍, 等. 爪蟾胚胎致畸实验(FETAX)在检测污染物发育毒性中的应用[J]. 安全与环境学报, 2009, 9(4): 24-28
Qian L J, Liu Q P, Cao Q Z, et al. Application of frog embryo teratogenesis assay-Xenopus in measuring the developmental toxicity of contaminants [J]. Journal of Safety and Environment, 2009, 9(4): 24-28 (in Chinese)
[58] 刘臻, 施华宏, 黄宏, 等. 3种抗生素对热带爪蟾胚胎发育的毒性影响[J]. 安全与环境学报, 2011, 11(5): 1-6
Liu Z, Shi H H, Huang H, et al. On the effects of chloramphenicol erythromycin and tetracycline on the growing Xenopus tropicalis embryos [J]. Journal of Safety and Environment, 2011, 11(5): 1-6 (in Chinese)
[59] Guo S Z, Qian L J, Shi H H, et al. Effects of tributyltin (TBT) on Xenopus tropicalis embryos at environmentally relevant concentrations [J]. Chemosphere, 2010, 79(5): 529-533
[60] Shi H H, Qian L J, Guo S Z, et al. Teratogenic effects of tetrabromobisphenol A on Xenopus tropicalis embryos [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2010, 152(1): 62-68
[61] Fini J B, Le M S, Palmier K, et al. Thyroid hormone signaling in the Xenopus laevis embryo is functional and susceptible to endocrine disruption [J]. Endocrinology, 2012, 153(10): 5068-5081
[62] OECD. OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters [R]. (2012-08) [2014-03-12].http://www.oecd.org/env/ehs/testing/OECD%20Conceptual%20Framework%20for%20Testing%20and%20Assessment%20of%20Endocrine%20Disrupters%20for%20the%20public%20website.pdf
[63] Langlois V S, Martyniuk C J, Genome wide analysis of Silurana (Xenopus) tropicalis development reveals dynamic expression using network enrichment analysis [J]. Mechanisms of Development, 2013, doi.org/10.1016/j.mod.2012.12.002
[64] Wells D E, Gutierrez L, Xu Z K, et al. A genetic map of Xenopus tropicalis [J]. Development Biology, 2011, 354(1): 1-8
[65] Lei Y, Guo X G, Liu Y, et al. Efficient targeted gene disruption in Xenopus embryos using engineered transcription activator-like effector nucleases (TALENs)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(43): 17484-17489
[66] Nakajima K, Nakajima T, Takase M, et al. Generation of albino Xenopus tropicalis using zinc-finger nucleases[J]. Development Growth and Differentiation, 2012, 54(9): 777-784
[67] Faunes F, Almonacid L I, Melo F, et al. Characterization of small RNAs in X. tropicalis gastrulae [J]. Genesis, 2012, 50(7): 572-583
[68] Young J J, Cherone J M, Doyon Y, et al. Efficient targeted gene disruption in the soma and germ line of the frog Xenopus tropicalis using engineered zinc-finger nucleases [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(17): 7052-7057
[69] Yu L, Zhang X L, Yuan J, et al. Teratogenic effects of triphenyltin on Xenopus tropicalis embryos: A phenotypic comparison with the retinoid X and retinoic acid receptor ligands [J]. Journal of Hazardous Materials, 2011, 192(3): 1860-1868
[70] Liu J Q, Cao Q Z, Yuan J, et al. Histological observation on unique phenotypes of malformation induced in Xenopus tropicalis larvae by tributyltin [J]. Journal of Environmental Sciences, 2012, 24(2): 195-202
[71] Kulkarni S S, Buchholz D R. Beyond synergy: Corticosterone and thyroid hormone have numerous interaction effects on gene regulation in Xenopus tropicalis tadpoles[J]. Endocrinology, 2012, 153(11): 5309-5324
[72] Morvan-Dubois G, Fini J B, Demeneix B A. Is thyroid hormone signaling relevant for vertebrate embryogenesis? [J]. Current Topics in Developmental Biology, 2013, 103: 365-396
[73] Havis E, Mevel S L, Morvan-Dubois G, et al. Unliganded thyroid hormone receptor is essential for Xenopus laevis eye development [J]. European Molecular Biology Organization, 2006, (25): 4943-4951
[74] Morvan-Dubois G, Demeneix B A, Sachs L M. Xenopus laevis as a model for studying thyroid hormone signaling: From development to metamorphosis [J]. Molecular and Cellular Endocrinology, 2008, 293(1-2): 71-79
[75] Yuan J, Zhang X L, Yu L, et al. Stage-specific malformations and phenotypic changes induced in embryos of amphibian (Xenopus tropicalis) by triphenyltin [J]. Ecotoxicology and Environmental Safety, 2011, 74(7): 1960-1966
[76] Shi H H, Zhu P, Sun Z, et al. Divergent teratogenicity of agonists of retinoid X receptors in embryos of zebrafish (Danio rerio) [J]. Ecotoxicology, 2012, 21(5): 1465-1475
[77] Herkovits J, Helguero L A. Copper toxicity and copper zinc interactions in amphibian embryos [J]. Science of the Total Environment, 1998, 221(1): 1-10
[78] Shi H H, Zhang X L, Yu L, et al. Interaction of triphenyltin and an agonist of retinoid X receptor (LGD1069) in embryos of Xenopus tropicalis [J]. Environmental Toxicology and Pharmacology, 2012, 34(3): 714-720
[79] Shi H H, Yang B, Huang M S, et al. The toxicity of sediments from the black-odors river of Wenzhou, China, to the embryos of Xenopus tropicalis [J]. Fresenius Environment Bulletin, 2012, 21(12B): 3952-3958
[80] Shi H H, Yuan J, Dai Z J, et al. The teratogenic effects of sediments from the Yangtze Estuary and adjacent bay, China, on frog embryos [J]. Environmental Earth Sciences, 2013, 68: 6385-6391
[81] James-Zorn C, Ponferrada V G, Jarabek C J, et al. Xenbase: Expansion and updates of the Xenopus model organism database[J]. Nucleic Acids Research, 2013, 41(D1): D865-D870
[82] Bowes J B, Snyder K A, James-Zorn C, et al. The Xenbase literature curation process [J]. Database: The Journal of Biological Databases and Curation, 2013, doi: 10.1093/database/bas046
[83] Segerdell E, Bowes J B, Pollet N, et al. An ontology for Xenopus anatomy and development [J]. BMC Developmental Biology, 2008, 8(1): 92-97
[84] Sive H L, Grainger R M, Harland R M. Early Development of Xenopus laevis: A Laboratory Manual [M]. New York: Cold Spring Harbor Laboratory Press, 2000
[85] Nieuwkoop P D, Faber J. Normal Table of Xenopus Laevis (Daudin): A Systematical and Chronological Survey of the Development from the Fertilized Egg till the End of Metamorphosis [M]. Amsterdam: North-Holland Pub. Co., 1994
[86] Bernardini G, Prati M, Bonetti E, et al. Atlas of Xenopus Development [M]. New York: Springer, 1999
[87] Green S L. The Laboratory Xenopus sp. [M]. [S.l.]: CRC Press, 2010
[88] Hoppler S, Vize P D. Xenopus Protocols, Second Edition [M].Methods in Molecular Biology Series. New York: Springer, 2012
[89] Kaltenbrun E, Tandon P, Amin N M, et al. Xenopus: An emerging model for studying congenital heart disease [J]. Birth Defects Research Part A, 2011, 91(6): 495-510
◆
ApplicationofXenopustropicalisEmbryosinEcotoxicology
Shi Huahong1,*, Zhu Jingmin1, Zhu Pan2, Yang Hongwei3, Wu Lijiao1
1. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China 2. Department of Environmental Science, College of Resources and Environmental Science, East China Normal University, Shanghai 200062, China 3. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China
28 March 2013accepted8 May 2013
The development of a new model animal, Xenopus tropicalis, and its genome were introduced. The application of X. laevis embryos in ecotoxicology was reviewed. Based on the introduction above, the present situation and future prospect of the application of X. tropicalis were discussed in details. These applications included the developmental toxicity test of contaminants, the research of toxicological mechanisms, the theatrical research of toxicology and the ecotoxicological test of environmental samples. Finally, information about internet, books and husbandry of X. tropicalis was introduced in brief.
Xenopus tropicalis; embryo; model animal; developmental toxicology
国家自然科学基金(21277049);江苏省自然科学基金(BK2012152)
施华宏(1970-),男,博士,研究员,研究方向为生态毒理学,E-mail: hhshi@des.ecnu.edu.cn
10.7524/AJE.1673-5897.20130328001
施华宏,朱静敏,朱攀,等. 热带爪蟾(Xenopus tropicalis)胚胎在生态毒理学中的应用前景[J]. 生态毒理学报, 2014, 9(2): 190-198
Shi H H, Zhu J M, Zhu P, et al. Application of Xenopus tropicalis embryos in ecotoxicology [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 190-198 (in Chinese)
2013-03-28录用日期2013-05-30
1673-5897(2014)2-190-09
X171.5
A
施华宏(1970—),男,水生生物学博士,研究员,主要研究方向为生态毒理学,发表学术论文70余篇。
