亚麻籽对肉羊体脂脂肪酸组成的影响
2014-09-20敖力格日玛侯先志闫素梅
双 金 黎 明 敖力格日玛 侯先志 闫素梅
(内蒙古农业大学动物科学学院,呼和浩特 010018)
多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)在食物中有着积极的生物学功能,体内许多代谢途径都要依靠n-6 PUFA和n-3 PUFA的平衡来实现。过去由于过分的强调了n-6 PUFA在这种平衡中的作用,又引发了新的不平衡,即营养学上所谓“西方病”[1]。美国卫生部(1994)建议,多食鱼肉制品特别是富含n-3 PUFA的鱼油可以改善必需脂肪酸(EFA)的平衡。在大部分的发展中国家家畜仍然是主要的脂肪酸来源,改善肉品的脂肪酸平衡对于人类的营养保健是非常重要的。亚麻籽(flaxseed)是一种富含α-亚麻酸(C18∶3n-3,ALA)的油料籽实。利用亚麻籽作为饲料原料生产富含n-3 PUFA的肉品已有很多研究者进行了尝试,但试验动物主要以鸡和牛为主,而且研究的重点多集中在亚麻籽的添加量与产品中富集ω-3 PUFA的效果上[2-12],尚未见探讨亚麻籽加工方式对肉羊体脂脂肪酸组成的影响方面的报道。虽然,由于瘤胃微生物对饲粮不饱和脂肪酸(USFA)的强大氢化作用,反刍动物不像单胃动物的体脂脂肪酸易受饲粮因素的影响,但是,也有研究证实,仍然可以通过改变饲粮脂肪酸组成来改变反刍动物体脂脂肪酸组成[13]。由于瘤胃微生物的生物氢化作用使得饲粮中USFA通过瘤胃的几率大大降低,而最终被小肠吸收进入血液的多为饱和脂肪酸(SFA);加之目前肉羊产业集约化育肥模式中的高精料饲粮条件,提高了肉羊肌间脂肪的含量,一方面导致肉羊自身健康隐患,如脂肪肝等,另一方面则降低了羊肉的食用价值[13-14]。为此,本试验以羯羊为试验动物,拟通过在饲粮中添加不同加工方式的亚麻籽来探讨其对肉羊体脂脂肪酸组成的影响,为采用调整饲粮n-6 PUFA/n-3 PUFA(n-6/n-3)的方法生产富含n-3 PUFA的羊肉提供理论依据。
1 材料与方法
1.1 试验设计
选取12只1岁蒙古羊羯羊,体重为30~35 kg,随机分成4组,每组3个重复,对照组采用基础饲粮(无亚麻籽),试验组饲喂的亚麻籽分别采用生粒(生粒组)、炒粒(130℃左右,用时20 min炒熟,炒粒组)、粉碎(用粉碎机粉碎不过筛,粉碎组)3种不同的加工方式。
试验包括3个连续的4×4拉丁方试验,各拉丁方试验中亚麻籽添加水平分别为75、150和225 g/d。试验期180 d,每个拉丁方试验60 d。采用同一批试验肉羊,依次进行。每个拉丁方试验分为4期,每期15 d,由5 d适应期、7 d预试期和3 d正试期组成。4×4拉丁方试验设计见表1。

表1 4×4拉丁方试验设计Table 1 The 4×4 Latin square experimental design
1.2 饲粮组成及营养水平
为了突出饲粮脂肪酸的营养差异,试验采用同一精粗比(20∶80)的饲粮,亚麻籽按添加水平等比例替换基础饲粮中的商品精料。并按NRC(1985)[15]要求把羊只饲粮干物质采食量(DMI)全程固定为体重的3.7% ~4.0%,本试验设定DMI为1.5 kg/d。饲粮组成及营养水平见表2。
1.3 饲养管理
试验肉羊采用单栏、定时、定量饲喂。其中,精料(包括商品精料和亚麻籽)饲喂1次(13:00);在预试期确定的粗料(羊草)的自由采食量,正试期内按其90%饲喂,每天3次(09:00、15:00和21:00)。自由饮水。
1.4 体脂脂肪样品采集
180 d的试验期结束后屠宰,分别从尾部、板油、网油和第6至第7胸椎上方皮下脂肪取脂肪样品,并于-25℃冰箱中保存。
1.5 脂肪酸含量测定
采用甲醇-氯仿浸提法抽提样品粗脂肪,用甘油三酯与0.4 mol/L氢氧化钾甲醇溶液,在70℃水浴进行甲酯化[16],各脂肪酸含量并采用气象色谱仪(Vrian 450GC)检测。色谱柱为SPTM-2560。程序升温,起始温度120℃。气化室温度260℃,分流条件1∶10。检测器为火焰离子检测器(FID),温度260 ℃,信噪比(S/N)为 1∶3,载气为氮气(N2),进气量为1 mL/min,自动分流进样,进样量 1 μL。
1.6 数据统计分析
分析亚麻籽加工方式对肉羊体脂脂肪酸组成的影响时,每只羊的所有组织(尾油、网油、板油和皮下脂肪)的数据平均值为1个样本数据,每组有3只羊(个重复),即3个样本数据,共4组,合计12个样本数据,气相色谱分析时,每个样品设3个重复,因此n=36。
分析肉羊不同部位体脂脂肪酸组成的差异时,每只羊某一部位的组织为1个样本数据,每组3个重复,共3组(不分析对照组数据),因此n=27。
数据用SAS 9.1.3中的单因子方差分析,平均值的多重比较采用Duncan氏法。
2 结果与分析
2.1 亚麻籽加工方式对肉羊体脂脂肪酸组成的影响
表3结果显示,肉羊体脂中含量最高的SFA为软脂酸(C16∶0),其次硬脂酸(C18∶0),其余含量均较低;含量最高的单不饱和脂肪酸(SUFA)为顺-9油酸(C18∶1 c9,也是所有脂肪酸中含量最高的),接下来是反-9油酸(C18∶1 t9),其余含量均较低;含量最高的PUFA为反-6亚油酸(C18∶2 t6),其次是顺 -6 亚油酸(C18∶2 c6),接着是C18∶3n-3,其余含量均较低。
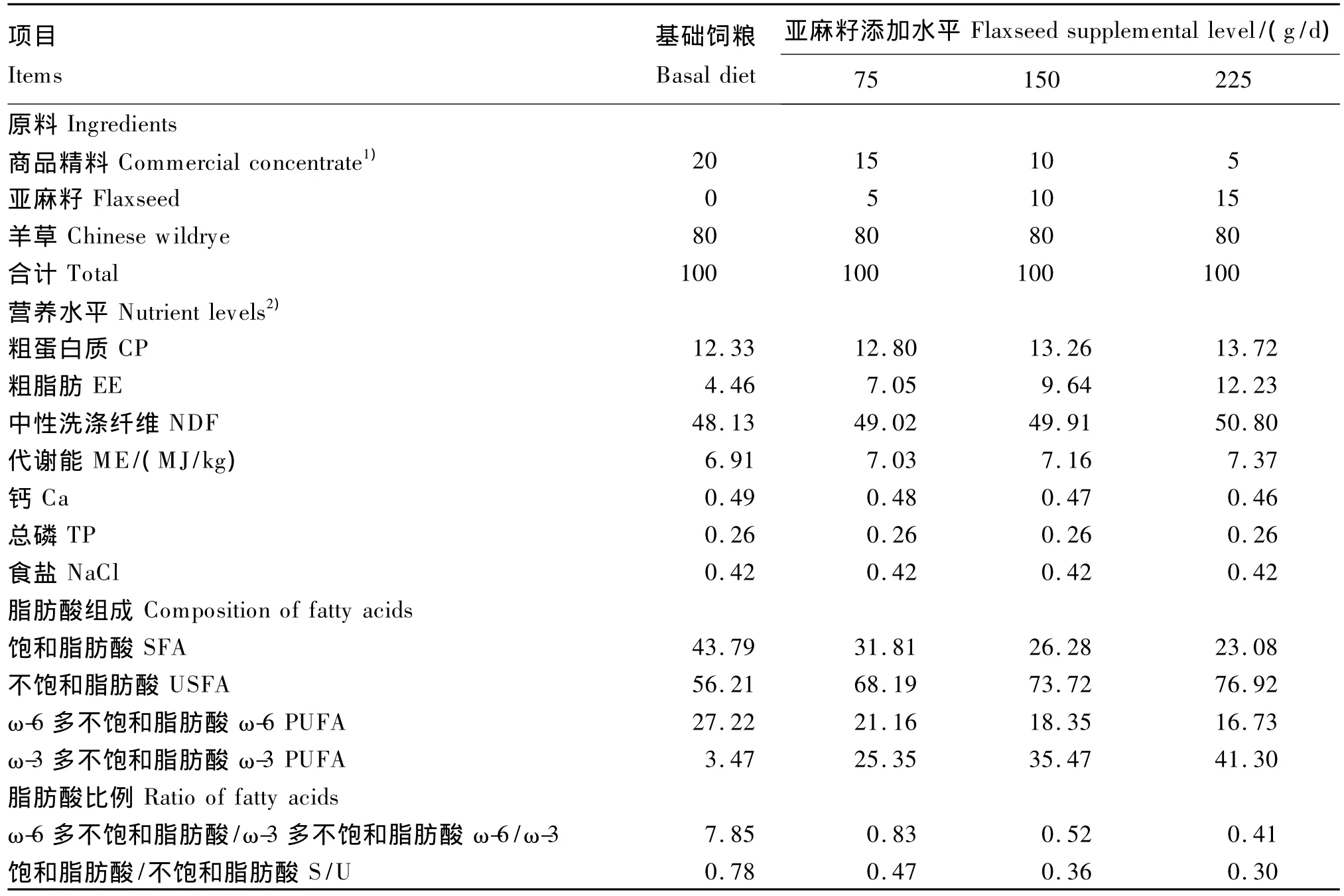
表2 饲粮组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of diets(DM basis) %
从对肉羊体脂SFA含量的影响来看,亚麻籽加工方式对短链饱和脂肪酸(SCFA)含量具有显著影响(P<0.05),对照组显著高于3个试验组(P<0.05),而3个试验组之间无显著差异(P>0.05);亚麻籽加工方式对中链饱和脂肪酸(MCFA)含量有极显著影响(P<0.01),对照组极显著高于3个试验组(P<0.01),生粒组和粉碎组又极显著高于炒粒组(P<0.01),而粉碎组与生粒组没有显著差异(P>0.05);亚麻籽加工方式对长链饱和脂肪酸(LCFA)含量有显著影响(P<0.05),粉碎组显著高于其他3组(P<0.05),而其他3组间其差异不显著(P>0.05)。相应地,对照组肉羊体脂SFA含量(SCFA、MCFA和LCFA含量之和)显著高于3个试验组(P<0.05),粉碎组显著高于炒粒组和生粒组(P<0.05),而炒粒组与生粒组之间没有显著差异(P>0.05)。
从对肉羊体脂USFA含量的影响来看,亚麻籽加工方式对SUFA含量有显著影响(P<0.05),炒粒组和生粒组显著高于粉碎组和对照组(P<0.05),而粉碎组又显著高于对照组(P<0.05),炒粒组与生粒组之间无显著差异(P>0.05);亚麻籽加工方式对n-6 PUFA含量有显著影响(P<0.05),对照组和粉碎组显著高于炒粒组(P<0.05),生粒组与其他各组均无显著差异(P>0.05);亚麻籽加工方式对n-3 PUFA含量有极显著影响(P<0.01),炒粒组>生粒组>粉碎组>对照组,组间差异极显著(P<0.01)。
亚麻籽加工方式对肉羊体脂中USFA和SFA含量的影响相反,USFA含量为炒粒组和生粒组显著高于对照组和粉碎组(P<0.05),粉碎组又显著高于对照组(P<0.05),炒粒组与生粒组则没显著差异(P>0.05);SFA含量变化趋势与之相反。
n-6/n-3为对照组(12.81)>粉碎组(4.72)>生粒组(3.21)>炒粒组(1.63),组间差异极显著(P<0.01),说明试验组肉羊体脂均具有高n-3 PUFA营养特性,其中炒粒组效果最佳;S/U为对照组(1.06)>粉碎组(0.92)>生粒组(0.83)>炒粒组(0.80),组间差异极显著(P<0.01),说明试验组肉羊体脂脂肪酸不饱和化程度均较高;奇数碳脂肪酸含量为对照组(7.71%)>炒粒组(6.86%)>生粒组(5.79%)>粉碎组(3.57%),组间差异显著(P<0.05);小于等于十六碳(≤C16)脂肪酸含量为对照组(31.36%)>粉碎组(28.67%)>生粒组(26.91%)>炒粒组(25.82%),组间差异极显著(P<0.01)。
经过计算可得出,试羊体脂脂肪酸组成与饲粮脂肪酸组成间的相似性系数为对照组(0.852 8)>炒粒组(0.648 6)>生粒组(0.627 0)>粉碎组(0.608 7),组间差异极显著(P<0.01)。
总之,亚麻籽可提高肉羊体脂n-3 PUFA含量,炒粒组效果最佳,其次为生粒组,粉碎组则效果略差。
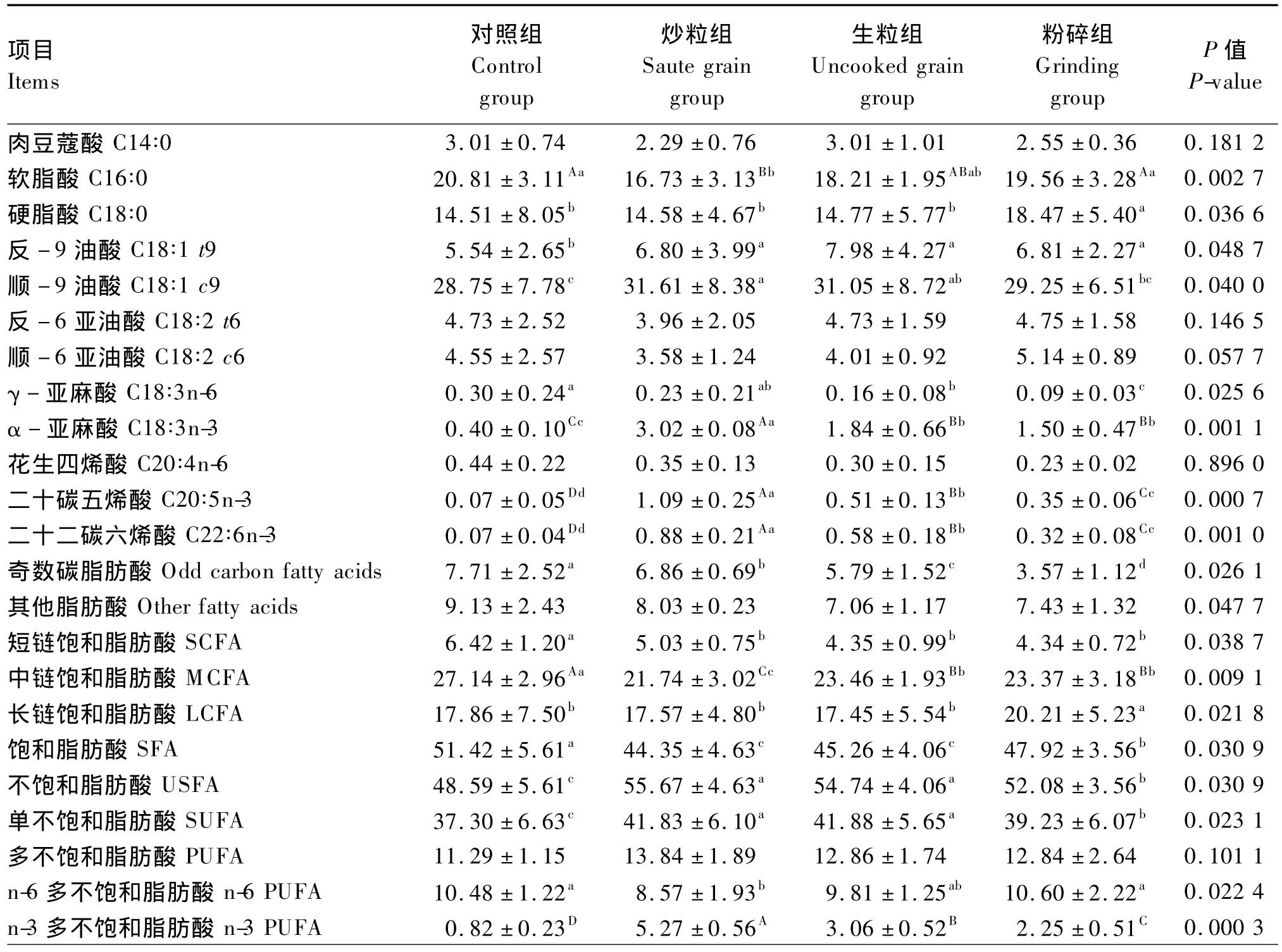
表3 亚麻籽加工方式对肉羊体脂脂肪酸组成的影响Table 3 Effects of flaxseed processing modes on fatty acid composition of body fat in meat sheep %
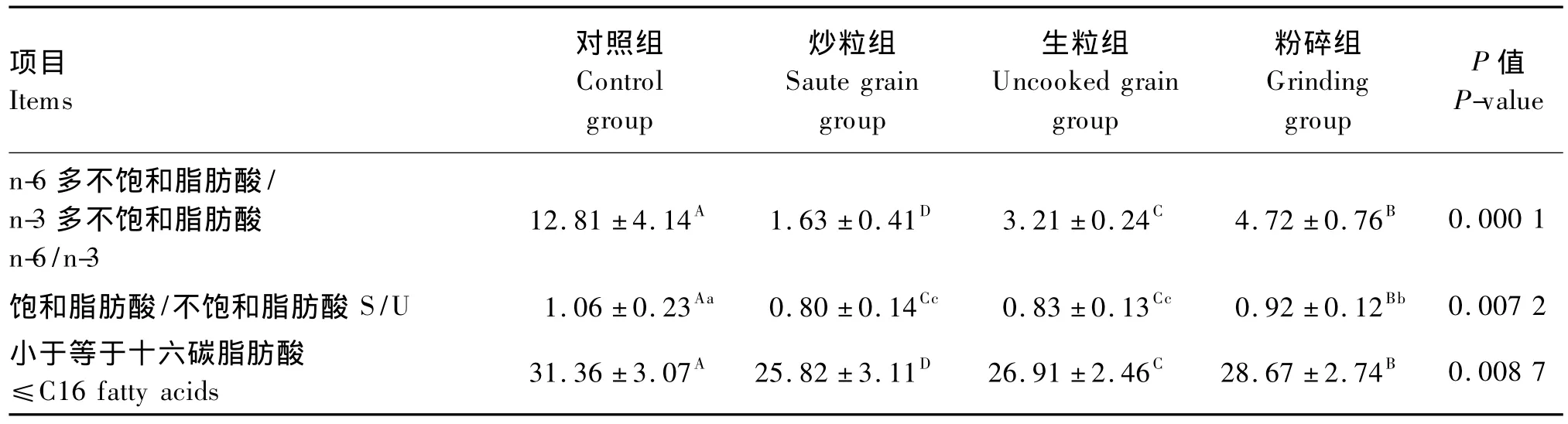
续表3
2.2 肉羊不同部位体脂脂肪酸组成的差异
表4结果显示,比较肉羊不同部位体脂SFA含量可见,SCFA含量在部位间存在显著差异(P<0.05),网油显著高于皮下脂肪和板油(P<0.05),与尾油无显著差异(P>0.05),但尾油又高于板油(P<0.05);MCFA含量在部位间存在极显著差异(P<0.01),皮下脂肪极显著高于其他3个部位(P<0.01),但其他3个部位之间无显著差异(P>0.05);LCFA含量在部位间存在极显著差异(P<0.01),网油和板油极显著高于皮下脂肪和尾油(P<0.01),而网油与板油、皮下脂肪与尾油间无显著差异(P>0.05)。
肉羊体脂SFA组成的主要特点为:网油和板油 C18∶0 含量高而 C16∶0 含量低;皮下脂肪C16∶0含量高而C18∶0含量低;而尾油上述2种脂肪酸含量均较低。
比较肉羊不同部位体脂USFA含量可见,SUFA含量在部位间存在显著差异(P<0.05),尾油极显著高于其他各部位(P<0.01),皮下脂肪极显著高于尾油和板油(P<0.01),而尾油与板油则无显著差异(P>0.05);n-6 PUFA含量在部位间存在显著差异(P<0.05),板油显著高于皮下脂肪和尾油(P<0.05),与网油间无显著差异(P>0.05),网油又显著高于尾油(P<0.05),与皮下脂肪无显著差异(P>0.05),皮下脂肪则显著高于尾油(P<0.05);n-3 PUFA含量在部位间无显著差异(P>0.05)。
肉羊体脂USFA组成的主要特点为:尾油C18∶1 c9 含量高,而 C18∶1 t9 和 C18∶2 t6 含量低;与此相反,网油和板油中 C18∶1 t9和 C18∶2 t6含量高,而C18∶1 c9含量低;皮下脂肪中上述3种脂肪酸含量均较低。
n-6/n-3为皮下脂肪(3.64)>板油(3.52)>网油(3.05)>尾油(2.69),其中皮下脂肪与网油和尾油差异显著(P<0.05),板油与尾油差异显著(P<0.05),说明饲喂亚麻籽的肉羊体脂均具有高n-3 PUFA营养特性,其中尾油则更加突出;S/U为板油(0.98)>网油(0.97)>皮下脂肪(0.83)>尾油(0.65),板油和网油与其他2个部位差异极显著(P<0.01),皮下脂肪与尾油差异极显著(P<0.01),说明尾油脂肪酸不饱和化程度很高;奇数碳脂肪酸含量在部位间存在显著差异(P<0.05),为尾油(7.11%)>皮下脂肪(5.55%)>网油(4.52%)>板油(4.45%),其中尾油与其他各部位差异显著(P<0.05);≤C16脂肪酸含量在部位间存在显著差异(P<0.05),为皮下脂肪(31.80%)>网油(26.03%)>板油(25.54%)>尾油(25.17%),其中皮下脂肪与其他各部位差异显著(P<0.05)。
经过计算可得出,4个部位的体脂脂肪酸组成与饲粮脂肪酸组成之间的相似性系数为板油(0.637 8)>网油(0.636 6)>皮下脂肪(0.635 7)>尾油(0.629 7),各部位间差异不显著(P>0.05)。
总之,尾油n-3 PUFA营养价值要显著高于网油和板油,最差的是皮下脂肪。
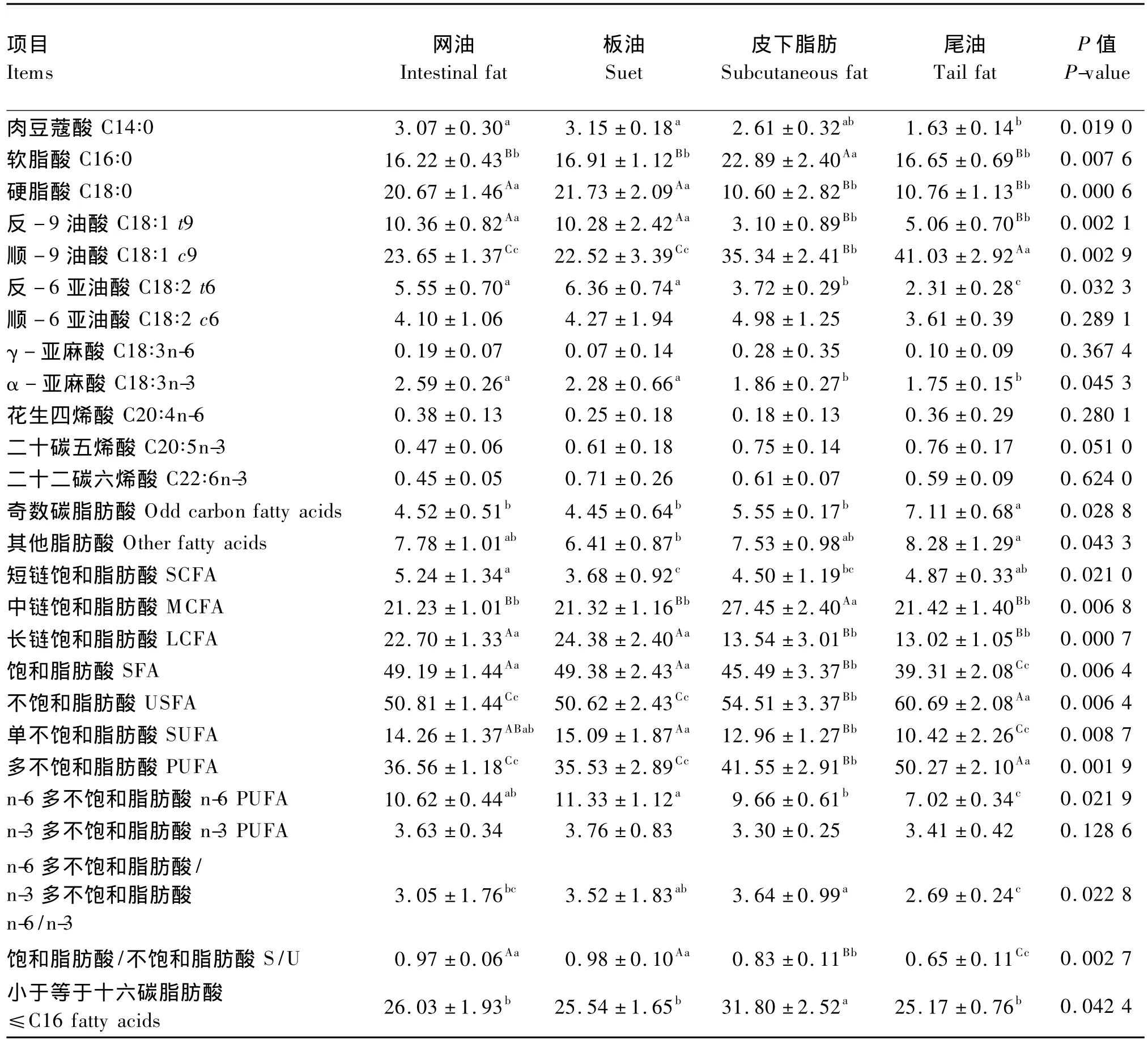
表4 肉羊不同部位体脂脂肪酸组成的差异Table 4 The differences in fat acid composition of different parts of body fat in meat sheep %
3 讨论
3.1 亚麻籽加工方式对肉羊体脂肪酸组成的影响
本试验结果表明,饲粮脂肪酸组成与体脂脂肪酸组成之间存在着很大差异,如试验组饲粮S/U和n-6/n-3分别为0.30和0.41,而体脂则分别提高到了0.80~0.92和1.63~4.72,这一结果可能是由瘤胃微生物脂肪代谢的独特性所造成的。瘤胃微生物可对饲粮脂肪进行水解,并摄入和氢化USFA以及利用挥发性脂肪酸(VFA)或者用易发酵的碳水化合物合成微生物脂肪酸[17]。因此,在其体脂中除了自身合成的脂肪酸外,还含有来自瘤胃微生物的十八碳(C18)USFA的异构体及奇数直链或支链脂肪酸,同时也含有来自于未被微生物脂解或氢化的饲粮部分脂肪酸。结果提示,肉羊体脂脂肪酸种类和组成以及饱和化程度与饲粮中差异很大。
试验组和对照组羊在同样的精粗比和饲养环境下,其体脂SFA和USFA含量显示出显著的差异,如试验组体脂中SFA含量比饲粮中提高了39.00% ~107.63%,然而,对照组体脂SFA含量(51.42%)比其饲粮SFA含量(43.79%)仅高出17.42%,说明试验组羊对饲粮SFA的摄入及其生物氢化率显著高于对照组。据报道,饲粮精粗比相同的情况下,瘤胃微生物对饲粮USFA的摄入及其生物氢化率随饲粮脂肪含量的上升而增多[17-19]。本试验中试验组饲粮粗脂肪含量(9.64%,3组平均值)明显高于对照组(4.46%),因此其结果与上述报道一致。
与上述同样道理,不同组在同样的饲粮组成和饲养环境下,其体脂USFA和SFA含量也显示出较大的差异,如炒粒组、生粒组和粉碎组体脂SFA含量比饲粮分别提高了92.16%、96.10%和107.63%,说明粉碎组饲粮USFA更容易被瘤胃微生物的摄入和氢化。这一点现象可从以下3点来解释:一是,从本文作者的另一项研究中亚麻籽粗脂肪瘤胃降解率(18 h)的测试结果看,粉碎组(28.09%)>炒粒组(7.93%)>生粒组(4.43%)[20],说明粉碎组饲粮脂肪酸更容易被瘤胃微生物利用,另外,炒粒组与生粒组粗脂肪瘤胃降解率相差3.50%,与其2组饲粮粗脂肪消耗率的相差12.38%[20]相比较,其差异相对很小,可以忽略不计。因此,炒粒组饲粮USFA比生粒组饲粮USFA更容易被吸收并参与体脂代谢。二是,从体脂奇数碳脂肪酸含量的差异来看,最低是粉碎组,为3.57%,显著低于其他2个试验组。据报道,瘤胃中总脂肪酸的消化系数为负数,表明瘤胃微生物能合成脂肪酸[21],而且微生物合成的脂肪酸多为奇数碳脂肪酸,特别是以十五碳(C15)和十七碳(C17)为中心的奇数碳脂肪酸为主[22]。据此可判定,因为粉碎组饲粮脂肪易被瘤胃微生物吸收并脂解和氢化,从而使微生物自身合成脂肪酸的反应被不同程度的抑制,而其他2个试验组肉羊的瘤胃微生物受此影响较小,所以其体脂奇数碳脂肪酸比粉碎组多。三是,从肉羊瘤胃液pH的测试结果看,粉碎组最高,炒粒组最低,说明粉碎组羊瘤胃微生物更能消耗瘤胃氢离子(H+),也就是说比其他2个试验组肉羊能更多地对饲粮USFA进行氢化[20]。
对试羊体脂脂肪酸组成进一步分析可发现,对照组羊体脂≤C16脂肪酸含量(31.36%)极显著高于试验组(25.82% ~28.67%)。众所周知,反刍动物体内小于等于十四碳(≤C14)脂肪酸和近1/2的十六碳(C16)脂肪酸是在机体组织中利用乙酸和β-羟丁酸从头合成[23],说明试验组肉羊脂肪酸合成强度显著低于对照组。因为,α-亚麻酸等n-3 PUFA可抑制机体脂肪酸合成的关键酶——乙酰辅酶 A羧化酶和脂肪酸合成酶活性[20],从而使体脂中≤C16脂肪酸含量降低。另外,由于还存在饲粮脂肪含量的差异,试验组肉羊流出瘤胃食糜中USFA含量和小肠对饲粮脂肪酸的吸收率相对要比对照组多,因此,体脂以乳糜微粒(CM)形式摄入的脂肪酸(外源)要比对照组多,这也将会抑制其体脂从头合成脂肪酸的反应强度。
另外,对照组肉羊体脂中n-3 PUFA含量达到0.82%,比普通舍饲肉羊稍高一些,说明前期处理对后期的体脂脂肪酸组成会造成一些影响。但从作者对血清生化指标进行拉丁方方差分析的结果可看出其误差项均不显著[20]。因此,作者认为本试验对脂肪酸组成的因素间互作可以忽略不计。
3.2 亚麻籽加工方式对肉羊体脂脂肪酸营养价值的影响
试验组体脂MCFA含量显著低于对照组。据研究,MCFA可显著提高血液中低密度脂蛋白胆固醇(LDL-c)含量,进而增加心血管疾病特别是冠状动脉硬化的潜在危险。而SCFA和LCFA却没有此类生理作用[24]。据此,认为试验组羊体脂SFA的营养价值明显要高于对照组。
据报道,体脂中肉豆蔻油酸(C14∶1)和棕榈油酸(C16∶1)以及 C18∶2 c6 等 n-6 PUFA 有提高载脂蛋白B(APO-B)和LDL-c含量的生理作用[23]。与此相反,C18∶1 c9 以及 C18∶3n-3、C20∶5n-3和C22∶6n-3等n-3 PUFA则有降低LDL-c含量的作用及提高对机体健康有利的载脂蛋白A(APO-A)和高密度脂蛋白胆固醇(HDL-c)的生理作用[25]。据此并结合体脂n-6 PUFA和n-3 PUFA含量的差异,可得出炒粒组羊体脂n-3 PUFA的营养价值要好于其他3组。同时,由于n-6 PUFA和n-3 PUFA在动物体内的代谢是用同一酶系上进行竞争[26],因此,评价机体代谢对必需脂肪酸的需要时,n-6/n-3比其各自的相对含量具有更重要的意义[26]。Marshall等[27]提出人类膳食中最理想的n-6/n-3应低于10。在本次试验中,n-6/n-3为对照组(12.81)>粉碎组(4.72)>生粒组(3.21)>炒粒组(1.63)。因此,认为炒粒组体脂USFA的营养价值要明显高于粉碎组和生粒组,最差的是对照组。另外,人类营养学认为,食品中花生四烯酸(C20∶4n-6)和二十碳五烯酸(C20∶5n-3)2 种 USFA的含量有时比n-6/n-3还要重要,血液中抗凝血因子的合成主要依靠促凝血的C20∶4n-6和抗凝血的C20∶5n-3之间的平衡来实现的[21]。由本试验结果看,富含α-亚麻酸油籽可明显提高肉羊体脂中抗凝血性脂肪酸水平,其中炒粒组尤为突出。食用这类肉羊体脂就意味着提高体内抗凝血性脂肪酸含量,而降低了凝血性脂肪酸含量。
3.3 肉羊不同部位体脂脂肪酸组成的差异
本试验中,肉羊网油和板油中SFA含量显著高于皮下脂肪,皮下脂肪又显著高于尾油,而网油与板油无显著差异。据报道,体脂SFA与USFA含量在身体不同解剖位置的脂肪中有所不同,山内清等[16]的研究发现,体温高的部位 SFA含量高,而体温低的部位USFA组成高。众所周知,网油和板油温度为最高,其次皮下脂肪,而尾油的则最低,其结果与上述报道完全一致。
皮下脂肪中≤C16脂肪酸含量显著高于其他部位的脂肪组织,说明皮下脂肪的脂肪酸合成强度要高于其他部位。这一结果完全符合肉羊各部位体脂沉积规律。一般情况下,皮下脂肪最早沉积,接着内脏贮脂、尾部脂肪,最后沉积于肌肉内。
尾油中奇数碳链脂肪酸含量显著高于其他部位的脂肪组织。由此可得出,尾脂肪组织相对比其他脂肪组织更能利用来自瘤胃微生物脂肪酸,并合成其脂肪。
网油和板油中C18∶1 t9和C18∶2 t6等来自于瘤胃微生物的C18 USFA的异构体[25]的含量显著高于皮下脂肪和尾油,其差异是由解剖部位所决定的[9]。与此相反,脂肪组织中 C18∶2 c6含量未显示部位差异。脂肪组织中C18∶2 c6含量具有明显的品种差异,比较稳定,不因脂肪组织部位而改变[16]。
3.4 肉羊不同部位体脂脂肪酸营养价值的差异
皮下脂肪中MCFA含量显著高于其他3个部位,而其他3个部位之间则无显著差异。MCFA可显著提高血液中LDL-c含量,而SCFA和LCFA却没有此类生理作用[24]。因此,皮下脂肪SFA的营养价值明显要低于其他3个部位。在本次试验中,体脂 n-6/n-3为皮下脂肪(3.64)>板油(3.52)>网油(3.05)>尾油(2.69),由此认为尾油n-3 PUFA的营养价值要高于网油和板油,最差的是皮下脂肪。
体脂风味与C18∶1 c9和亚麻酸的含量有着密切关系[28]。从脂肪酸对其风味的贡献看,尾油更优于其余3个部位,其中最差的是皮下脂肪。另外,C18∶0 以及丁酸(C4∶0)和己酸(C6∶0)等短链脂肪酸也是引起脂肪膻味的因素[29],而尾油上述几种脂肪酸均低于其他3个部位,即尾油膻味相对少于其他部位,其结果符合人们平时对肉羊体脂的实际评价情况。
4 结论
肉羊饲喂亚麻籽可显著强化体脂n-3 PUFA营养特性,其中炒粒的加工方式效果最佳;尾油n-3 PUFA营养价值和风味要显著高于网油和板油,最差的是皮下脂肪。
[1]WILLIAMS C M.Dietary fatty acids and human health[J].Annales de Zootechnie,2000,49(3):165-180.
[2]LANDBLOM D G,OLSON D K,WACHENHEIM C J.Effect of field pea and flaxseed inclusion in receiving calf diets and carryover effect on finishing performance,immune response,carcass quality,and economics[J].American Society of Animal Science,2007,58(2):56-58.
[3]MADDOCK T D,BAUER M L,KOCH K B,et al.The effect of processing flax in beef feedlot diets on performance,carcass characteristics,and trained sensory panel ratings[J].Journal of Animal Science,2006,84(6):1544-1551.
[4]DROUILLARD J S,SEYFERT M A,GOOD E J,et al.Flaxseed for finishing beef cattle:effects on animal performance,carcass quality and meat composition[C]//Proceedings of the 60th Flax Institute.Fargo:Flax Institute,2004:108-117.
[5]MADDOCK T D,BAUER M L,KOCH K,et al.The effect of processing flax in beef feedlot rations on performance,carcass characteristics and trained sensory panel ratings[C]//Proceedings of the 60th Flax Institute.Fargo:Flax Institute,2004:72-87.
[6]WAYLON A T,DURRA J D,JOHNSON B J,et al.Effect of flax supplementation and growth promoants on lipoprotein lipase and glycogenin messenger RNA concentrations in finishing cattle[J].Journal of Animal Science,2004,82:1868-1875.
[7]孙涛.日粮添加复合预混料及亚麻籽和大豆对奶牛产奶量和乳脂组成的影响[D].硕士学位论文.保定:河北农业大学,2005.
[8]许蕾蕾,李秋凤,李建国,等.亚麻籽对育肥期肉牛生长性能和血液指标的影响[J].中国牛业科学,2012,38(1):5-9.
[9]武雅楠,李建国.亚麻籽在反刍动物中的应用[J].中国饲料,2006(16):33-35.
[10]吴灵英.亚麻籽及其饼粕在鸡饲料中的应用[J].饲料工业,2002,22(3):32-34.
[11]亚麻子可用作畜禽和宠物饲料[J].邝贤斌,译.国外畜牧科技,1997,23(4):26-28.
[12]谢欣梅.亚麻籽在动物饲料中的应用潜力[J].内蒙古民族大学学报,2005,20(5):530-532.
[13]CRUICKSHANK E M.Studies in fat metabolism in the fowl.The composition of the egg fat and depot fat of the fowl as affected by the ingestion of large amounts of different fats[J].Biological Chemistry,1934,28(3):965-977.
[14]SANTOS-SILVA J,MENDES I A,PORTUGA L P,et al.Effect of particle size and soybean oil supplementation on growth performance.carcass and meat quality and fatty acid composition of intramuscular lipids of lambs[J].Livestock Production Science,2004,90(2/3):79-88.
[15]NRC.Nutrient requirements of sheep[S].6th ed.Washington,D.C.:National Academy of Sciences,1985:45-73.
[16]山内清.肉豚枝肉の蓄积脂肪组织と筋肉组织にぉける等脂肪酸组成の差异と相关[J].日畜会报,1987,8:771-775.
[17]JENKINS T C.Lipid metabolism in the rumen[J].Journal of Dairy Science,1993,76(12):3851-3863.
[18]GRUBB J A,DEHORITY B A.Effects of an abrupt change in ration from all roughage to high concentrate upon rumen microbial numbers in sheep[J].Applied Microbiology,1975,30:404-412.
[19]佐佐木,高橋敏能,萱场猛夫.ヒッジのル-メン内微生物および无细胞ル-メン液区分における长锁脂肪酸の量と组成に及ぼす浓厚饲料と粗饲料の给与割合の影响[J].日本畜产学报,2000,71(7):26-38.
[20]双金,黎明,敖力格日玛,等.亚麻籽对肉羊血清脂蛋白和脂肪代谢指标的影响[J].动物营养学报,2014,
[21]PALMQUIST D L,SCHANBACHER F L.Dietary fat composition influences fatty acid composition of milk fat globule membrane in lactating cows[J].Lipids,1991,26(9):718-722.
[22]O’KELLY J C,SPIERS W G.Influence of host diet on the concentrations of fatty acids in rumen bacteria from cattle[J].Australian Journal of Agricultural Research,1991,42(2):243-252.
[23]庞伟英,阎宏.反刍动物对纤维素的消化利用及调控[J].草食家畜,2007,1(3):46-47.
[24]双金,侯先志,敖力格日玛.研究富含α-亚麻酸的饲料添加剂对生长育肥猪脂肪代谢的影响[J].黑龙江畜牧兽医,2011(11):67-72.
[25]WONG S H,NESTEL P J,TRIMBLE R P,et al.The adoptive effects of dietary fish and safflower oil on lipid and lipoprotein metabolism in perfused rat liver[J].Biochimica et Biophysica Acta,1984,792(2):103-109.
[26]VOSS A,REINHART M,SANKARAPPA S,et al.The metabolism of 7,10,13,16,19-docosapentaenoic acid to 4,7,10,13,16,19-docosahexaenoic acid in rat liver is independent of a 4-desaturase[J].Journal of Biological Chemistry,1991,266(30):19995-20000.
[27]MARSHALL A,VAN ELSWYK M E.Dietary polyunsaturated fat.Is it beneficial?[J].Nutrition Today,1995,30:207-213.
[28]BENDALL J G,OLNEY S D.Hept-CIS-4-enal:analysis and flavour contribution to fresh milk[J].International Dairy Journal,2001,11(11/12):855-864.
[29]MOTTRAM D S,EDWARDS R A,HALLIDAY M J H.A comparison of the flavour volatiles from cooked beef and pork meat systems[J].Journal of the Science of Food and Agriculture,1982,33(9):934-944.
