亚麻籽对肉羊血清脂蛋白和脂肪代谢相关生化指标的影响
2014-09-20敖力格日玛侯先志闫素梅
双 金 黎 明 敖力格日玛 侯先志 闫素梅
(内蒙古农业大学动物科学学院,呼和浩特 010018)
多不饱和脂肪酸(polyunsaturated fatty acids,PUFA),特别是 ω-3 PUFA因其独特的生物学活性,已经进入生物制药、营养保健、化妆品和饲料等领域[1]。通过营养调控来提高动物源性食品中这些脂肪酸的含量对提高其产品附加值、丰富市场有重大意义。亚麻籽(flaxseed)又称胡麻籽,是一种富含α-亚麻酸(ALA)的油料籽实。长期以来,在饲料领域亚麻籽的开发利用主要集中在胡麻饼粕上。近年来,在国外开展了很多利用亚麻籽作为原料生产富含ω-3 PUFA饲料的研究,这些研究主要集中在鸡和牛上[2-6]。国内该领域的研究较少,而且已有的也是以鸡和奶牛为主[7-12]。上述研究的重点集中在亚麻籽的添加水平和动物产品中富集ω-3 PUFA的问题上[2-12],尚未见探讨不同加工方式的亚麻籽的添加水平对反刍动物血清脂蛋白和脂肪代谢相关生化指标影响的报道。为此,本试验以羯羊为试验对象,拟通过在饲粮中添加不同水平和加工方式的亚麻籽,以期了解其对肉羊血清脂蛋白和脂肪代谢相关生化指标的影响,为提高羊肉品质提供理论依据。
1 材料与方法
1.1 试验设计
选取12只1岁蒙古羊羯羊,体重为30~35 kg,随机分成4组,每组3个重复,对照组采用基础饲粮(无亚麻籽),试验组饲喂的亚麻籽分别采用生粒(生粒组)、炒粒(130℃左右,用时20 min炒熟,炒粒组)、粉碎(用粉碎机粉碎不过筛,粉碎组)3种不同的加工方式。
试验包括3个连续的4×4拉丁方试验,各拉丁方试验中亚麻籽添加水平分别为75、150和225 g/d。试验期180 d,每个拉丁方试验60 d。采用同一批试验肉羊,依次进行。每个拉丁方试验分为4期,每期15 d,由5 d适应期、7 d预试期和3 d正试期组成。4×4拉丁方试验设计见表1。
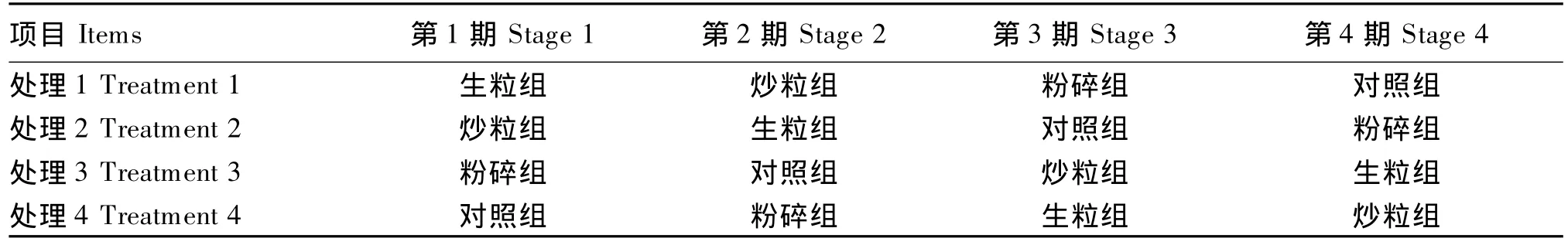
表1 4×4拉丁方试验设计Table 1 The 4×4 Latin square experimental design
1.2 饲粮组成及营养水平
为了突出饲粮脂肪酸的营养差异,试验采用同一精粗比(20∶80)的饲粮,亚麻籽按添加水平等比例替换基础饲粮中的商品精料。并按NRC(1985)[13]要求把羊只饲粮干物质采食量(DMI)全程固定为体重的3.7% ~4.0%,本试验设定DMI为1.5 kg/d。饲粮组成及营养水平见表2。
1.3 饲养管理
试验肉羊采用单栏、定时、定量饲喂。其中,精料(包括商品精料和亚麻籽)饲喂1次(13:00);在预试期确定的粗料(羊草)的自由采食量,正试期内按其90%饲喂,每天3次(09:00、15:00和21:00)。自由饮水。
1.4 血液样品的采集
在每个正试期第2天,饲喂亚麻籽后1.5、7.0、12.0和18.0 h从试验羊颈静脉采血,并分离血清,冷冻保存。
1.5 血清脂蛋白代谢相关生化指标的测定
血清中总胆固醇(total cholesterin,CHO)和甘油三酯(triglyceride,TG)浓度用酶法测定,高密度脂蛋白胆固醇(high density lipoprotein cholesterin,HDLc)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDLc)、载脂蛋白 A(APO-A)以及载脂蛋白B(APO-B)浓度用化学修饰法测定,极低密度脂蛋胆固醇(very low density lipoprotein cholesterin,VLDLc)浓度通过计算得出,同时计算HDLc、LDLc和VLDLc的相对含量(占CHO的百分比)。以上指标均采用日本 Olympus公司产AU600型全自动生化分析仪测定。
1.6 血清中脂肪代谢相关酶活性和激素浓度的测定
用酶联免疫分析(ELISA)法检测225 g/d亚麻籽拉丁方试验中血清脂肪酸合成酶(FAS)、乙酰辅酶 A羧化酶(ACCase)、激素敏感脂肪酶(HSL)、β-羟基β-甲基戊二酸单酰辅酶A还原酶(HMGR)活性和胰岛素(INS)浓度。
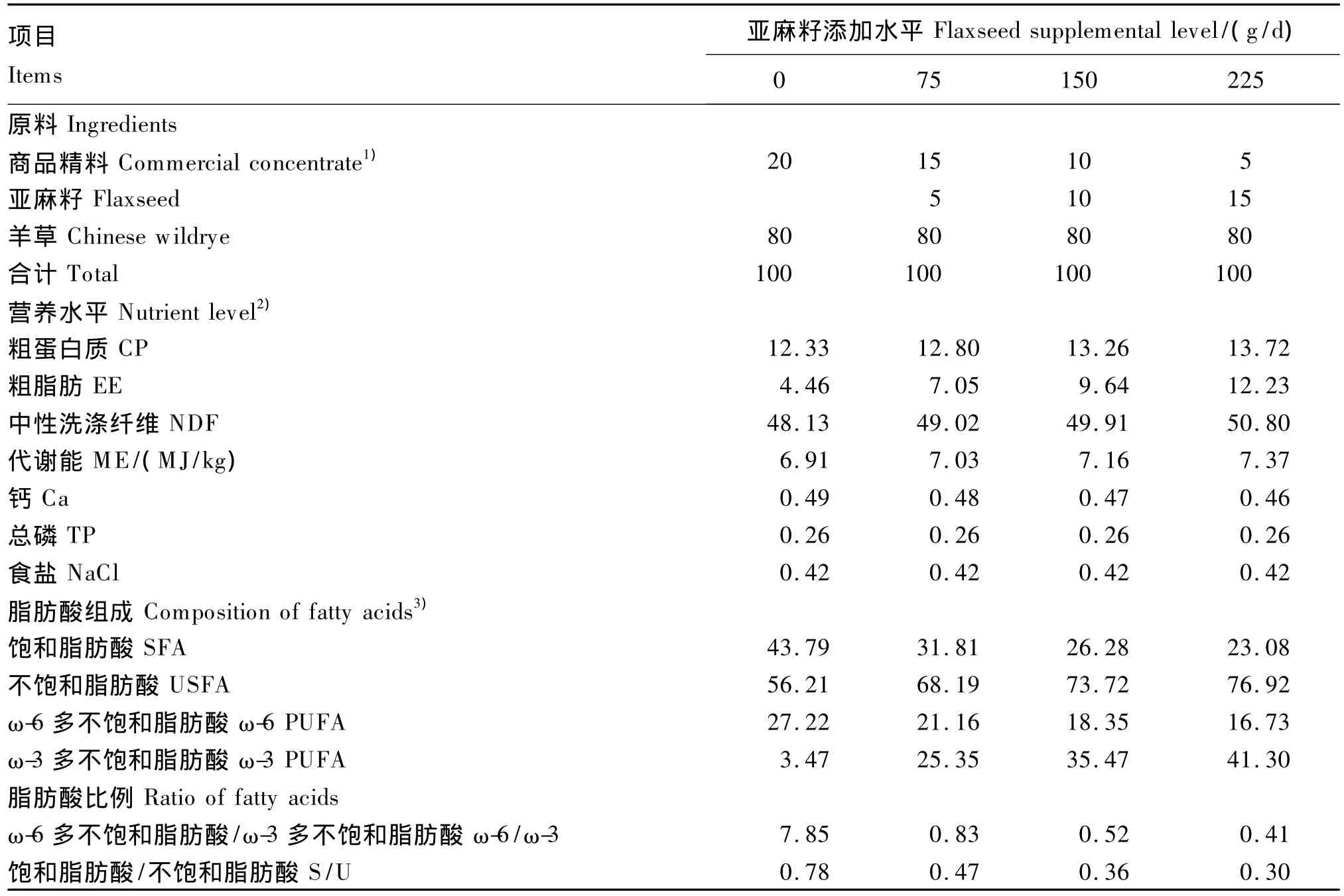
表2 饲粮组成及其营养水平(干物质基础)Table 2 Composition and nutrient levels of diets(DM basis) %
1.7 数据统计分析
数据用SAS 9.1.3中的拉丁方方差分析,平均值的多重比较采用Duncan氏法。
2 结果与分析
2.1 亚麻籽加工方式、添加水平、饲喂后时间对血清脂蛋白代谢相关生化指标的影响
对3个亚麻籽添加水平血清脂蛋白代谢相关生化指标分别进行拉丁方方差分析可发现,其误差项均不显著(P>0.05),说明各因素间不存在互作。
2.1.1 加工方式
由表3可知,在75 g/d亚麻籽的拉丁方试验中,饲喂亚麻籽除了对血清APO-A和APO-B浓度无显著影响(P>0.05)外,其余各指标均得到极显著提高(P<0.01),但其中,3个试验组间各指标差异均不显著(P>0.05)。在150 g/d亚麻籽的拉丁方试验中,饲喂亚麻籽对血清APO-A和APO-B浓度以及LDLc相对含量无显著影响(P>0.05);与对照组相比,炒粒组血清HDLc相对含量无显著变化(P>0.05),生粒组和粉碎组得到显著提高(P<0.05);与对照组相比,粉碎组血清VLDLc相对含量无显著变化(P>0.05),而生粒组和炒粒组得到显著提高(P<0.05);与对照组相比,试验组血清 HDLc、LDLc、VLDLc、CHO 浓度均得到极显著提高(P<0.01),并且,炒粒组血清HDLc浓度极显著高于其他2个试验组(P<0.01),其血清CHO浓度极显著高于粉碎组(P<0.01)。在225 g/d亚麻籽的拉丁方试验中,饲喂亚麻籽对各指标能够产生极显著的影响(P<0.01),并且其中,炒粒组血清 HDLc、CHO和APO-A浓度以及HDLc相对含量均极显著高于其他2个试验组(P<0.01),其血清TG浓度极显著高于生粒组(P<0.01)。
结果说明,在肉羊饲粮中添加亚麻籽可提高血清HDLc、CHO、TG和APO-A浓度,其中炒粒组的效果明显好于生粒组和粉碎组。
从3个拉丁方试验数据的平均值来看,炒粒组血清HDLc相对含量极显著高于其他各组(P<0.01),而生粒组和粉碎组又极显著高于对照组(P<0.01),生粒组与粉碎组之间不显著(P>0.05);与此相反,对照组血清VLDLc相对含量极显著高于3个试验组(P<0.01),而3个试验组间不显著(P>0.05);血清LDLc相对含量为对照组>粉碎组>生粒组>炒粒组,组间差异均极显著(P<0.01)。
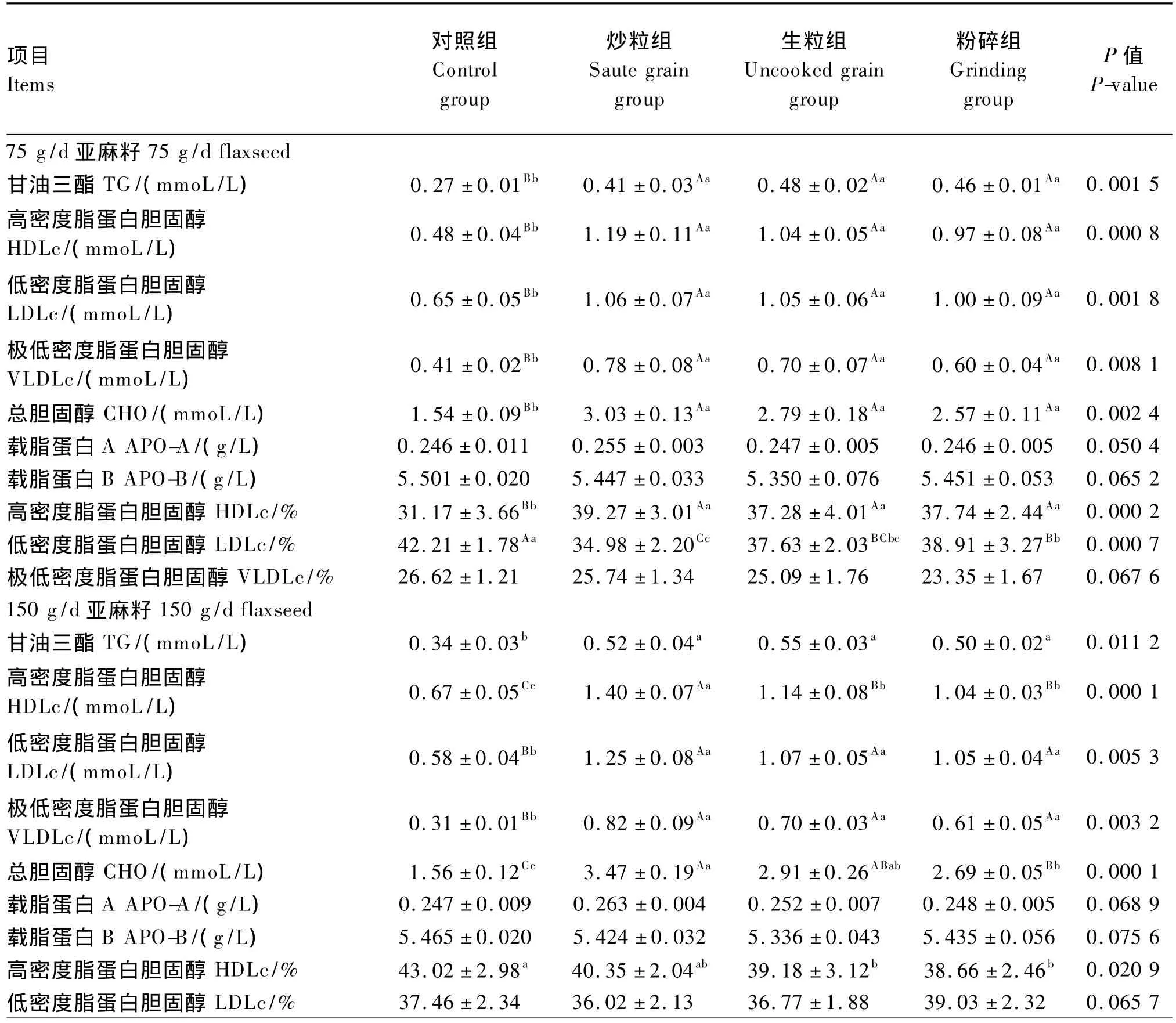
表3 亚麻籽加工方式对肉羊血清脂蛋白代谢相关生化指标的影响Table 3 Effects of flaxseed processing modes on serum biochemical indices related to lipoprotein metabolism of meat sheep
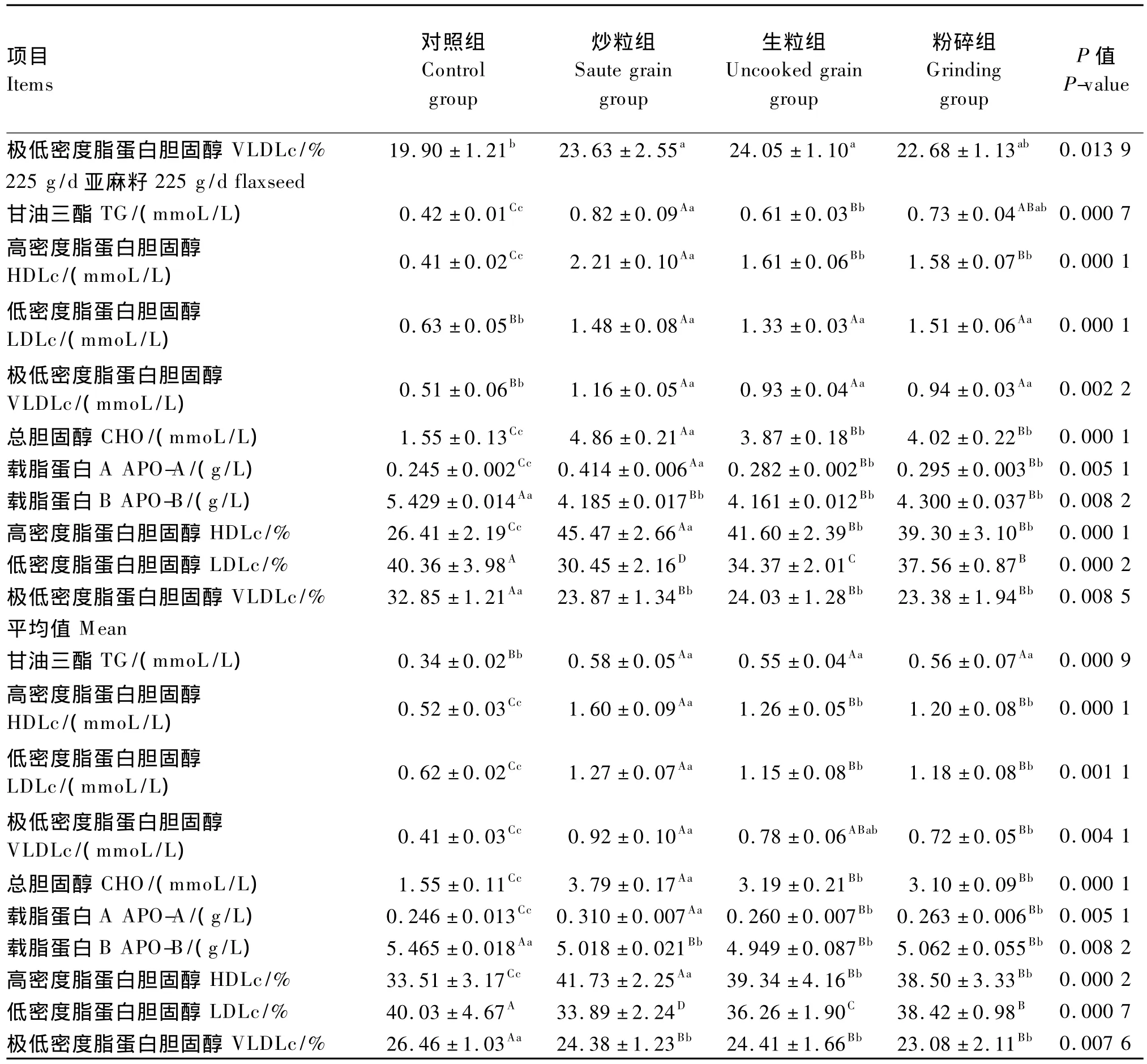
续表3
2.1.2 添加水平
由表4可知,随着亚麻籽添加水平的增加,除了血清APO-B浓度极显著降低(P<0.01)外,其他指标均极显著增加(P<0.01);血清HDLc相对含量为225 g/d组>150 g/d组>75 g/d组>0 g/d组,其中除了75 g/d组与150 g/d组差异不显著(P>0.05)外,其余各组间差异均极显著(P<0.01);与此正相反,血清LDLc和VLDLc相对含量为0 g/d组>75 g/d组>150 g/d组>225 g/d组,除了血清LDLc相对含量75 g/d组与150 g/d组差异不显著(P>0.05)外,其余各组差异均极显著(P<0.01);各亚麻籽添加组间血清VLDLc相对含量差异不显著(P>0.05),而与0 g/d差异极显著(P<0.01)。
2.1.3 饲喂后时间
由表5可知,各指标在饲喂后1.5~18.0 h都经历了先下降再上升而后再下降的波浪式变化过程。其中,血清VLDLc和APO-A浓度各时间点间差异极显著(P<0.01),血清 LDLc浓度和HDLc相对含量差异不显著(P>0.05),其余各指标随饲喂后时间延长出现显著变化(P<0.05)。
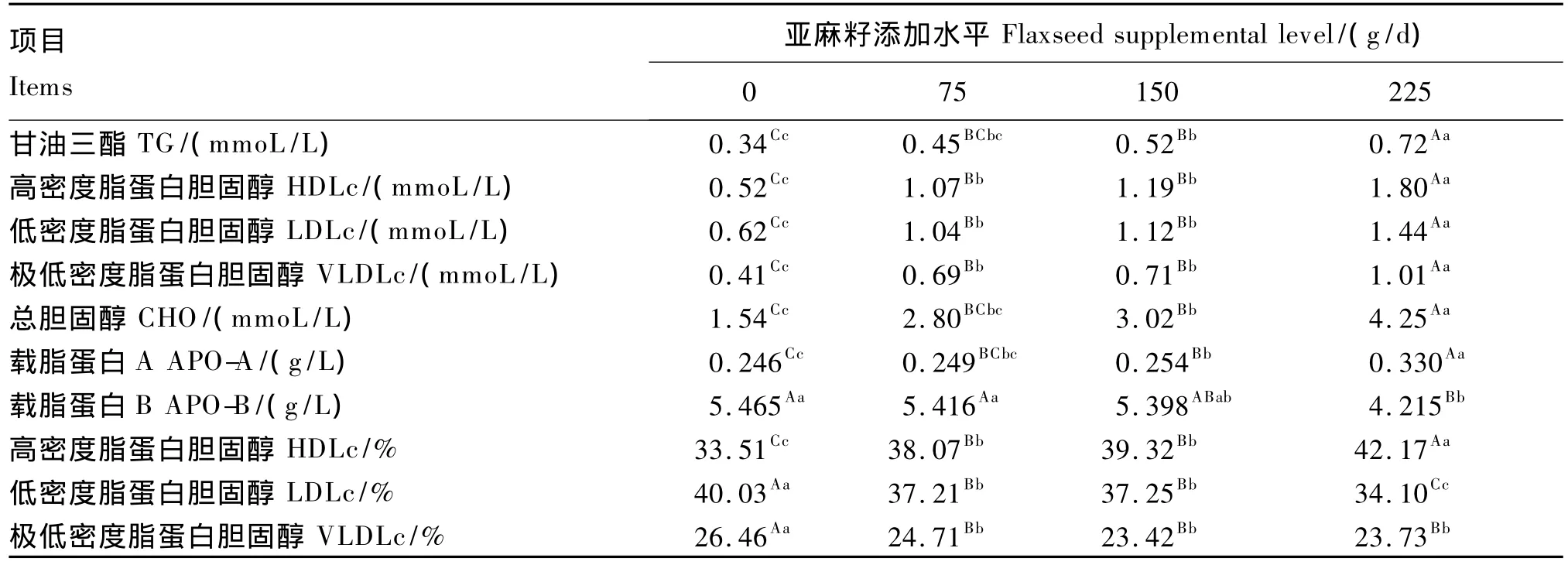
表4 亚麻籽添加水平对肉羊血清脂蛋白代谢相关生化指标的影响Table 4 Effects of flaxseed supplemental level on serum biochemical indices related to lipoprotein metabolism of meat sheep
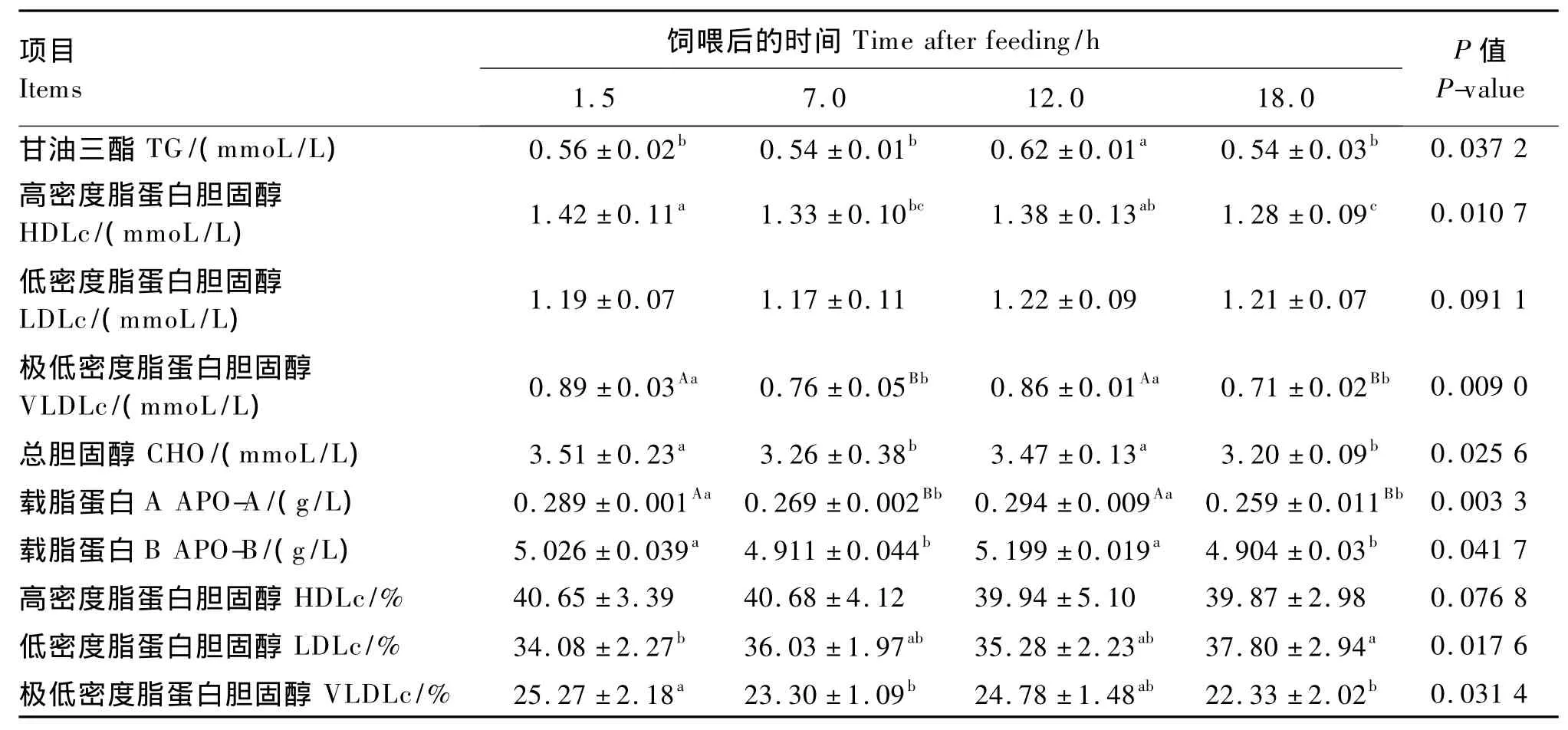
表5 亚麻籽饲喂后时间对肉羊血清脂蛋白代谢相关生化指标的影响Table 5 Effects of time after feeding of flaxseed on serum biochemical indices related to lipoprotein metabolism of meat sheep
2.2 亚麻籽加工方式和饲喂后时间对血清脂肪代谢相关酶活性和激素浓度的影响
对225 g/d亚麻籽的拉丁方试验数据进行拉丁方方差分析可发现,其误差项均不显著(P>0.05),说明因素间同样不存在互作。
2.2.1 加工方式
由表6可知,炒粒组血清INS浓度和HSL活性极显著高于生粒组和粉碎组(P<0.01),而生粒组和粉碎组又都极显著高于对照组(P<0.01),生粒组与粉碎组差异不显著(P>0.05);血清FAS和ACCase活性的变化则与之相反;对照组血清HMGR活性极显著高于炒粒组和粉碎组(P<0.01),而炒粒组和粉碎组又都极显著高于生粒组(P<0.01)。
结果表明,在肉羊饲粮中添加亚麻籽可提高肉羊血清脂解有关酶(HSL)活性和INS浓度,与此同时,可降低脂肪酸合成和肝脏胆固醇合成有关的酶(FAS、ACCase和 HMGR)活性,其中炒粒组效果较好。
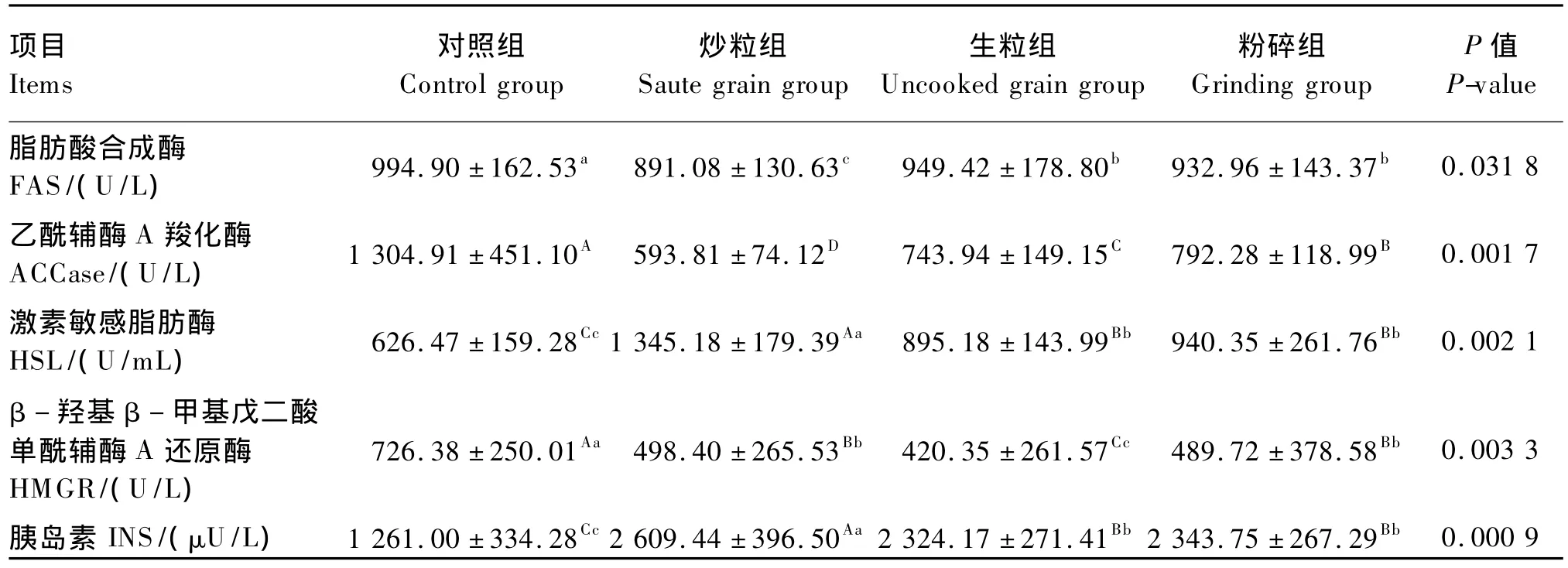
表6 亚麻籽加工方式对肉羊血清脂肪代谢相关酶活性和激素浓度的影响Table 6 Effects of flaxseed processing modes on serum enzyme activities and hormone concentration related to fat metabolism of meat sheep
2.2.2 饲喂后时间
由表7可知,饲喂后1.5~7.0 h,3个试验组血清FAS和ACCase活性显著或极显著下降(P<0.05或 P <0.01),7.0~18.0 h,显示逐渐上升的趋势,其中炒粒组和粉碎组的FAS活性极显著升高(P<0.01);与此相反,1.5~7.0 h,对照组血清FAS和 ACCase活性极显著升高(P<0.01),7.0~18.0 h,出现极显著的下降(P<0.01)。饲喂后1.5~7.0 h,3个试验组血清HSL活性和INS浓度显著或极显著上升(P<0.05或P<0.01),7.0~18.0 h,则呈显著或极显著下降趋势(P<0.05或 P <0.01);与此相反,1.5 ~7.0 h,对照组血清 HSL活性显著下降(P<0.05),7.0~18.0 h,先升高后降低,差异不显著(P>0.05)。饲喂后1.5~7.0 h,对照组血清INS浓度极显著升高(P<0.01),7.0~18.0 h,极显著降低(P<0.01)。饲喂后1.5~7.0 h,炒粒组和粉碎组血清HMGR活性极显著下降(P<0.01),7.0~18.0 h,炒粒组极显著升高(P<0.01),粉碎组略有上升(P>0.05)后极显著下降(P<0.01);1.5~18.0 h,对照组和生粒组血清HMGR活性显著或极显著升高(P<0.05或P<0.01)。
3 讨论
本试验用的材料是一种富含α-亚麻酸的油籽,即亚麻籽。对本次试验羊的肌肉和脂肪组织脂肪酸组成进行分析已发现,亚麻籽可显著降低其肌肉和脂肪组织ω-6多不饱和脂肪酸(PUFA)与ω-3 PUFA,这说明,试验组羊ω-3 PUFA的营养及其代谢特征显著优于对照组,其中炒粒组效果较好[15]。
3.1 亚麻籽对肉羊血清中脂蛋白代谢相关生化指标的影响
首先,从亚麻籽加工方式对血清脂蛋白的影响来看,炒粒组血清HDLc浓度及其相对含量显著高于其他各组,而血清VLDLc和LDLc相对含量则与此正相反。众所周知,LDLc的主要作用是由肝向肝外组织输送胆固醇[16],即 ω-3 PUFA可明显降低肝脏胆固醇的合成速度,符合ω-3 PUFA使肝脏胆固醇合成的关键酶(HMGR)浓度减少而降低肝脏胆固醇合成的结论[16]。本试验中,炒粒处理使血清HMGR浓度极显著减少(表6)。而HDLc由肝脏合成,并释入血液后,可与肝外组织释出的胆固醇及其酯结合,并运回肝脏处理[16]。因此本试验结果也说明,ω-3 PUFA可促使肝外组织胆固醇的合成,同时也增加其释入血液HDLc浓度和相对含量。综上所述,可以得出如下结论,亚麻籽可促进组织胆固醇的合成进程,而减少肝脏胆固醇的合成速度,同时加速肝脏对胆固醇的清除与转化速度。
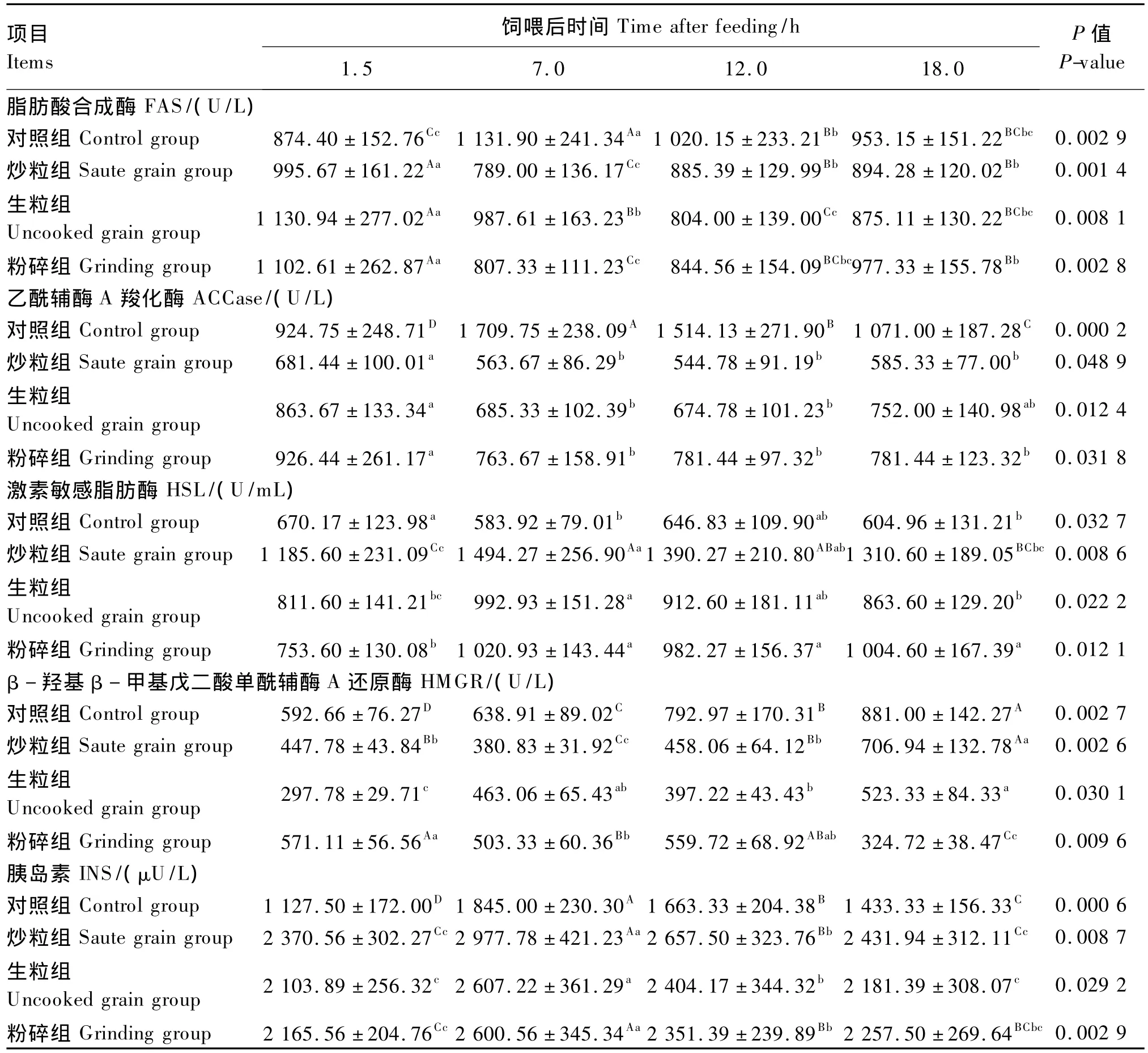
表7 亚麻籽饲喂后时间对肉羊血清脂肪代谢相关酶活性和激素浓度的影响Table 7 Effects of time after feeding of flaxseed on serum enzyme activities and hormone concentration related to fat metabolism of meat sheep
其次,从亚麻籽加工方式对血清载脂蛋白的影响来看,炒粒组血清APO-A浓度极显著高于其他各组;相反,血清APO-B浓度则较低。APO-A存在于高密度脂蛋白(HDL)表面,它能激活胆固醇代谢中的关键酶,并进一步清除组织中的胆固醇,把它运到肝脏去处理[17],即血清APO-A浓度与HDLc浓度之间存在着高度的相关性。结果说明,饲粮添加亚麻籽提高血清HDLc浓度的同时,也带起了APO-A浓度的提高。而APO-B存在于低密度脂蛋白(LDL)的表面,细胞识别和摄取LDL主要通过识别APO-B实现。所以,APO-B增多时,即使LDL浓度正常,也可使心脑血管病发病率增高[18]。另外,由于HDL可抑制 LDL与血管内皮细胞及平滑肌细胞受体的结合(竞争细胞表面脂蛋白受体),从而减少了LDL在细胞中的堆积,并进而减少血清APO-B浓度[18],所以对机体脂蛋白正常代谢来讲,血清HDLc与LDLc相对含量比其浓度显得更加重要。
第三,从亚麻籽加工方式对血清CHO和TG浓度的影响来看,亚麻籽可显著增加肉羊血清CHO和TG浓度,而且随添加水平的增加而出现上升趋势,其中,炒粒组较为明显。Gonthier等[19]的研究结果显示,肉牛饲粮中添加12.5%的亚麻籽增加了血清CHO和TG浓度 ,与本试验的结果一致。然而,孙涛[7]在奶牛饲粮中、许蕾蕾等[8]在肉牛饲粮中添加亚麻籽血清CHO和TG浓度减少。因此亚麻籽对于血液CHO和TG浓度的影响仍有待于研究。
第四,从亚麻籽添加水平对血清脂蛋白的影响来看,随着亚麻籽添加水平的增加,使肉羊ω-3 PUFA营养特性得到进一步强化[15],因而出现血清HDLc相对含量和APO-A浓度提高,而LDLc相对含量和APO-B浓度则减少的结果。
第五,从饲喂后时间对血清脂蛋白的影响来看,饲喂后1.5~18.0 h各指标都经历先下降后上升再下降的波浪式过程。即白天饲喂之后的血脂高于晚上,而后逐渐上升至夜间,接着又开始有所下降至早晨,其结果也许和瘤胃微生物脂肪酸代谢和机体脂肪代谢的昼夜节律有关,有待进一步研究。
总之,试验组血清HDLc浓度及相对含量均比对照组高,而血清LDLc浓度虽然也比对照组高一些,但它的相对含量却比对照组低很多。这说明,饲粮亚麻籽可强化机体HDLc营养的同时,也极大地消弱了LDLc对机体所带来的负面影响。其中,炒粒组效果较好。
3.2 亚麻籽对肉羊血清中脂肪代谢相关生化指标的影响
从亚麻籽加工方式的影响来看,本试验中,亚麻籽提高了血清INS浓度,另据报道,亚麻籽还可提高动物血清生长激素(GH)浓度[20]。众所周知,INS和GH均可提高肉羊肌肉组织蛋白质的合成速度[16]。但对脂肪组织来讲,INS可促进葡萄糖进入脂肪细胞,增强酯化的同时抑制其脂肪酸动员的功能。而GH可促进脂肪组织的脂解作用,从而使血清中非酯化脂肪酸(NEFA)和酮体浓度升高,并抑制脂肪组织对葡萄糖的利用,即GH在脂肪组织的代谢上具有“抗INS样”功能[16]。对此,Moustaid等[21]认为,GH 阻断 INS的信号影响FAS基因,阻止 FAS基因中与 INS应答元件(IRE)相互作用的反式作用因子的激活,从而调控INS对FAS基因转录的调节作用。Yin等[22]在3T3-F442A脂肪细胞中加10 ng/mL的INS培养48 h,INS使FAS mRNA的丰度增加了约7倍,但在其中同时加入10、100、1 000 ng/mL的牛 GH时,FAS mRNA的丰度分别降低了34%、65%和61%,这表明GH通过抑制INS对FAS基因转录起作用。从本次试验的结果看,试验组(尤其炒粒组)血清FAS和ACCase活性低于对照组,而血清HSL浓度则与此正相反,即试验组羊脂肪组织脂肪酸合成强度明显低于对照组,而同时其脂解强度则要明显高于对照组。这说明,试验组羊的GH“抗INS样”功能要明显强于对照组羊,其结果符合Yin等[22]的研究报道。所以,亚麻籽具有把营养物质从脂肪组织转向其他组织的功能,从而促进肉羊的生长速度,并改善其胴体品质[22]。
从饲喂后时间的影响来看,首先,饲喂后1.5~7.0 h,饲粮α-亚麻酸可被大量被吸收进入血液,从而对血清FAS、ACCase和HMGR活性形成抑制状态。但随后的小肠吸收量的减少,逐渐解除α-亚麻酸对FAS、ACCase和HMGR活性的抑制作用。其中,因炒粒组饲粮粗脂肪的消化吸收率高于其他2个试验组[15],这种变化更加明显。而对对照组来讲,饲粮α-亚麻酸含量很低,而亚油酸含量却很高,ω-6 PUFA与ω-3 PUFA比例高达7.85,因此由于亚油酸的竞争α-亚麻酸不至于对 FAS、ACCase和 HMGR活性形成抑制状态[23]。相反,由于饲喂后1.5~7.0 h合成脂肪酸和胆固醇底物(挥发性脂肪酸浓度)的增加,刺激FAS、ACCase和HMGR活性的提高,但随时间推移底物逐渐减少,其活性也随之下降。
其次,α-亚麻酸可促进脂肪组织脂解[24],HSL是脂肪分解的关键酶。由于饲喂后6.0~7.0 h是肉羊瘤胃活动和小肠吸收最活跃的时期[25],所以亚麻籽α-亚麻酸对HSL的刺激也是最强烈的时期,但随时间推移,对α-亚麻酸的吸收逐渐减少,其刺激强度也就逐渐降下来,而HSL活性也开始下降。相反,对对照组来讲,饲喂后1.5~7.0 h,由于养分吸收量的增加,葡萄糖和脂肪酸合成加速而促进酯化,与此同时降低HSL活性而抑制脂解。但随时间的推移血液葡萄糖浓度下降而酯化降低,解除对血清HSL活性的抑制,其活性逐渐得到恢复。
最后,α-亚麻酸有提高血清INS浓度的功能,但这一功能随α-亚麻酸吸收量的减少而逐渐被削弱使血清INS浓度下降,同时,也由于养分吸收量和合成代谢率的减少,使血清INS浓度也会下降。
总之,亚麻籽使肉羊血清脂肪代谢相关生化指标得到明显改善,而且此种效应随其添加水平的增加而得到进一步强化。其中同样也是炒粒组效果较好。
4 结论
亚麻籽可强化机体HDLc营养的同时,极大地消弱LDLc对机体所带来的负面影响。同时,使肉羊血清中脂肪代谢相关生化指标得到显著改善。本试验条件下,炒粒的加工方式效果较好。
[1]吴水清,姚汝华.多聚不饱和脂肪酸的生理功能研究进展[J].中国生化药物杂志,1997,18(3):127-130.
[2]LANDBLOM D G,OLSON D K,WACHENHEIM C J.Effect of field pea and flaxseed inclusion in receiving calf diets and carryover effect on finishing performance,immune response,carcass quality,and economics[J].American Society of Animal Science,2007,58(2):56-58.
[3]MADDOCK T D,BAUER M L,KOCH K B,et al.Effect of processing flax in beef feedlot diets on performance,carcass characteristics and trained sensory panel ratings[J].Animal Science,2006,84(6):1544-1551.
[4]DROUILLARD J S,SEYFERT M A,GOOD E J,et al.Flaxseed for finishing beef cattle:effects on animal performance,carcass quality and meat composition[C]//Proceedings of the 60th Flax Institute.Fargo:Flax Institute,2004:108-117.
[5]MADDOCK T D,BAUER M L,KOCH K,et al.The effect of processing flax in beef feedlot rations on performance,carcass characteristics and trained sensory panel ratings[C]//Proceedings of the 60th Flax Institute.Fargo:Flax Institute,2004:72-87.
[6]WAYLAN A T,DURRA J D,JOHNSON B J,et al.Effect of flax supplementation and growth promotants on lipoprotein lipase and glycogenin messenger RNA concentrations in finishing cattle[J].Journal of Animal Science,2004,82(6):1868-1875.
[7]孙涛.日粮添加复合预混料及亚麻籽和大豆对奶牛产奶量和乳脂组成的影响[D].硕士学位论文.保定:河北农业大学,2005.
[8]许蕾蕾,李秋凤,李建国,等.亚麻籽对育肥期肉牛生长性能和血液指标的影响[J].中国牛业科学,2012,38(1):5-9.
[9]武雅楠,李建国.亚麻籽在反刍动物中的应用[J].中国饲料,2006(16):18-20.
[10]吴灵英.亚麻籽及其饼粕在鸡饲料中的应用[J].饲料工业,2002,22(3):32-34.
[11]亚麻子可用作畜禽和宠物饲料[J].邝贤斌,译.国外畜牧科技,1997,23(4):26-28.
[12]谢欣梅.亚麻籽在动物饲料中的应用潜力[J].内蒙古民族大学学报,2005,20(5):530-532.
[13]NRC.Nutrient requirements of sheep[S].6th ed.Washington,D.C.:National Academy of Sciences,1985:45-73.
[14]山内清.肉豚枝肉の蓄积脂肪组织と筋肉组织にぉける等脂肪酸组成の差异と相关[J].日畜会报,1987,8:771-775.
[15]双金,黎明,敖力格日玛,等.亚麻籽对肉羊体脂脂肪酸组成的影响[J].动物营养学报,2014.doi:.
[16]齐顺章.动物生物化学[M].2版.北京:中国农业出版社,1996:141-305.
[17]WONG S H,NESTEL P J.The adoptive effects of dietary fish and safflower oil on lipid and lipoprotein metabolism in perfused rat liver[J].Biochimica et Biophysica Acta,1984,792(2):103-109.
[18]BROUGHTON K S,MORGAN L J.Frequency of(n-3)polyunsaturated fatty acid consumption induces alteration in tissue lipid composition and eicosanoid synthesis in CD-1 mice[J].The Journal of Nutrition,1994,124(7):1104-1111.
[19]GONTHIER C,MUSTAFA A F,OUELLET D R,et al.Feeding micronized and extruded flaxseed to dairy cows:effects on blood parameters and milk fatty acid composition[J].Journal of Dairy Science,2005,88(2):748-756.
[20]双金,侯先志,敖力格日玛,等.富含α-亚麻酸的饲料添加剂对生长育肥猪脂肪代谢的影响[J].黑龙江畜牧兽医,2011(11):67-70.
[21]MOUSTAID N,SAKAMOTO K,CLARKE S D,et al.Regulation of fatty acid synthase gene transcription[J].The Biochemical Journal,1993,292(2):396-402.
[22]YIN D,CLARKE S D,PETERS J L,et al.Somatotropin-dependent decrease in fatty acid synthase mRNA abundance in 3T3-F422A adipocytes is the result of a decrease in both gene transcription and mRNA stability[J].The Biochemical Journal,1998,331:815-820.
[23]VOSS A,REINHART M,SANKARAPPA S.The metabolism of 7,10,13,16,19-docosapentaenoic acid to 4,7,10,13,16,19-docosahexaenoic acid in rat liver is independent of a 4-desaturase[J].Journal of Biological Chemistry,1991,266(30):19995-20000.
[24]NETTLETON J A.Omega-3 fatty acids and health[M].[s.L.]:Springer,1995:64-76.
[25]佐佐木,高橋敏能,萱场猛夫.ヒッジのル-メン内微生物および无细胞ル-メン液区分における长锁脂肪酸の量と组成に及ぼす浓厚饲料と粗饲料の给与割合の影响[J].日本畜产学报,2000,71(7):26-38.
