金雀异黄素对多囊卵巢综合征大鼠卵巢组织中Bcl-2及Bax mRNA表达的影响
2014-12-20迟晓星张明玉郑丽娜张丽媛
迟晓星 张明玉 张 涛 郑丽娜 张丽媛
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.哈尔滨医科大学大庆校区,大庆 163319)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是女性最常见的内分泌紊乱疾病之一[1],影响了7%~10%的妇女。育龄期PCOS的临床或生化表现包括不规则的月经周期、多囊性卵巢和雄激素过多[2]。关于PCOS的病因、病理及治疗药物的作用途径尚不明确,在这方面的研究中卵巢细胞凋亡信号的表达是其中的研究热点之一。抗凋亡基因Bcl-2是许多生理或病理性细胞凋亡的关键性调节因素,它可以通过影响细胞内信息传导而影响凋亡,对多种因素引发的细胞凋亡有抑制或延缓作用[3]。Bax蛋白是与Bcl-2相关的同源性蛋白,可作为Bcl-2的拮抗剂。所以药物如果能够在正常限度内增强Bcl-2 mRNA的表达,抑制促凋亡基因Bax mRNA的表达,对延缓或减少细胞凋亡具有重要意义。
植物雌激素是已知的可影响多囊卵巢动物排卵的物质[4]。已有研究证明,膳食中植物雌激素可影响人类 PCOS[5],该综合征的特异性可通过PCOS动物模型反映出来。金雀异黄素(genistein,GEN)作为异黄酮类化合物属于植物雌激素,是大豆异黄酮的主要成分[6],存在于富含豆肽的多种天然植物中,其分子结构与人体自身雌激素相同。GEN进入人体后,可完全与雌激素受体结合,发挥雌激素的作用。对于不同组织,还可产生与雌激素相拮抗的作用,具有雌激素表达双向调节效应。GEN在预防乳腺癌、结肠癌和心血管疾病方面的研究报道较多,用于预防PCOS的报道较少。因此,本研究通过建立PCOS动物模型,以GEN为受试物,采用原位杂交方法检测大鼠卵巢组织中Bcl-2及Bax mRNA表达情况,从细胞凋亡角度探讨植物雌激素GEN对PCOS大鼠卵巢的影响及可能作用机制。
1 材料与方法
1.1 材料与设备
GEN:美国 Sigma公司,纯度 >99.9%;己烯雌酚:合肥久联制药有限公司,每片0.5 mg;人体绒毛膜促性腺激素:四环药业股份有限公司,每瓶5 000 IU;中效胰岛素诺和灵:诺和诺德(巴西)进口药品(H20091126);Bcl-2和Bax mRNA原位杂交检测试剂盒:武汉博士德生物工程有限公司;电热恒温培养箱DRP-9082型:上海森信实验仪器有限公司。
1.2 试验动物与分组
选择雌性 Wistar大鼠90只,3月龄,体重(160±20)g,由哈尔滨医科大学实验鼠类养殖中心提供(医动字第20-006号,清洁级)。采取随机分组方法分为6组,分别为对照组,模型组,GEN低、中、高剂量组及雌激素组,每组各15只。
1.3 PCOS试验动物模型的建立与试验设计
按照胰岛素联合人体绒毛膜促性腺激素造模法[7]建立PCOS试验动物模型。所有大鼠给予充足的食物和浓度为5%的葡萄糖饮水,每天给予14 h的周期性光照。试验的第1~10天给予模型组、剂量组和雌激素组大鼠逐渐增加剂量的中效胰岛素诺和灵,由开始的0.5 IU/d逐渐增加至6.0 IU/d,试验第 11~22天给予固定剂量6.0 IU/d,并加用人体绒毛膜促性腺激素6.0 IU/d,其中人体绒毛膜促性腺激素分2次注射,每次注射剂量为3.0 IU,对照组注射相同剂量的生理盐水。造模后,连续阴道上皮细胞涂片2个性周期(每个周期5 d),阴道角化细胞持续出现,提示造模成功。本试验造模成功率为83%,每组各选出10只大鼠继续后面的试验。剂量组分别给予 5、10、20 mg/kg GEN,雌激素组给予0.5 mg/kg己烯雌酚,受试物灌胃给予,持续15 d,观察动情周期10 d。
1.4 检测指标与方法
1.4.1 大鼠卵巢组织中Bcl-2和Bax mRNA的表达
大鼠喂养7周后,麻醉,腹主动脉取血,大鼠死后,剖取大鼠卵巢和子宫,立即用4%体积分数的多聚甲醛/0.1 mol/L磷酸盐缓冲液(pH 7.2~7.6)的固定液固定,制作大鼠卵巢和子宫组织石蜡切片,厚度4μm,用70%体积分数的乙醇加1‰体积分数的焦碳酸二乙酯(DEPC)处理后,再用多聚赖氨酸处理,60℃恒温箱烤片2 h。此后具体操作方法按Bcl-2和Bax mRNA原位杂交检测试剂盒说明书操作。
卵巢颗粒细胞Bcl-2和Bax mRNA阳性评定标准:根据卵巢和子宫组织切片中颗粒细胞免疫组织化学染色的深浅分4级,未被染色的为阴性表达,深棕色为弱阳性表达,棕黄色为中度阳性表达,棕褐色为强阳性表达。为了统计方便,予以半定量计分:1、2、3、4分别对应阴性表达、弱阳性表达、中度阳性表达、强阳性表达。每张切片至少观察5个视野。主要观察各组大鼠卵巢和子宫颗粒细胞Bcl-2和Bax mRNA阳性表达情况。
1.4.2 大鼠卵巢组织中抗氧化酶活性
测定试验前后各组大鼠卵巢组织中超氧化物歧化酶(SOD)(羟胺法)、过氧化氢酶(CAT)(可见分光光度法)、谷胱甘肽过氧化物酶(GSH-Px)(比色法)活性和丙二醛(MDA)含量[硫代巴比妥酸(TBA)法]。
1.5 统计分析
采用SPSS 13.0统计软件对结果进行t检验,P<0.05为差异显著。
2 结果与分析
2.1 大鼠卵巢组织中Bcl-2 mRNA的表达
Bcl-2 mRNA的阳性表达主要在大鼠卵巢组织的细胞胞浆中,由表1和图1可知,各组大鼠卵巢组织中Bcl-2 mRNA阳性表达率不同,其中雌激素组大鼠卵巢组织细胞呈强阳性表达,棕褐色颗粒最多最明显;高剂量组大鼠卵巢组织细胞棕黄色颗粒也比较明显,阳性表达强,模型组与之相比阳性细胞少,颜色浅,棕黄色颗粒较少。这说明GEN可上调Bcl-2 mRNA的表达量,与模型组相比,剂量在20 mg/kg的时候作用显著(P<0.05)。
2.2 大鼠卵巢组织中Bax mRNA的表达
Bax mRNA的阳性表达主要在大鼠卵巢组织的细胞胞浆中,呈棕黄色颗粒,由表2和图2可知,模型组大鼠卵巢组织中阳性颗粒表达强,棕褐色颗粒多;雌激素组和高剂量组大鼠卵巢组织中棕黄色颗粒明显减少,呈弱阳性表达,与模型组相比差异显著(P<0.05)。结果表明GEN可不同程度地下调大鼠卵巢组织中Bax mRNA的表达量。

表1 大鼠卵巢组织中Bcl-2 mRNA的表达Table 1 The expression of Bcl-2 mRNA in rat ovarian tissue
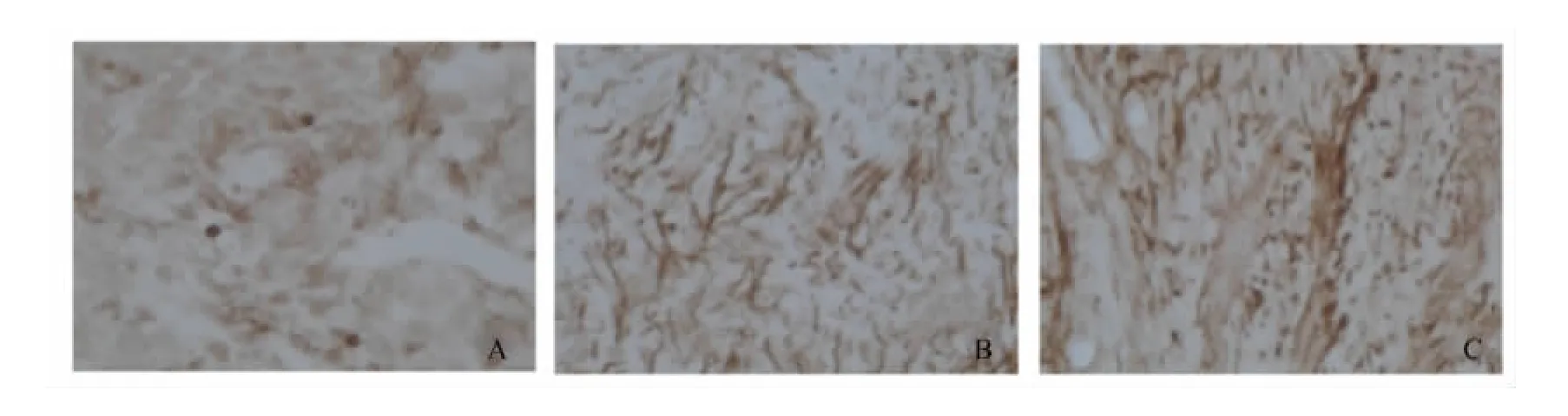
图1 大鼠卵巢组织中Bcl-2 mRNA的表达Fig.1 The expression of Bcl-2 mRNA in rat ovarian tissue

图2 大鼠卵巢组织中Bax mRNA的表达Fig.2 The expression of Bax mRNA in rat ovarian tissue
2.3 大鼠卵巢组织中抗氧化酶活性变化
由表3可知,与试验前相比,试验后大鼠卵巢组织中SOD和CAT活性均升高,其中中、高剂量组显著升高(P<0.05);GSH-Px活性中剂量组显著升高(P<0.05);对照组和低剂量组MDA含量显著升高(P<0.05),而中剂量组、高剂量组和雌激素组均显著下降(P<0.05)。
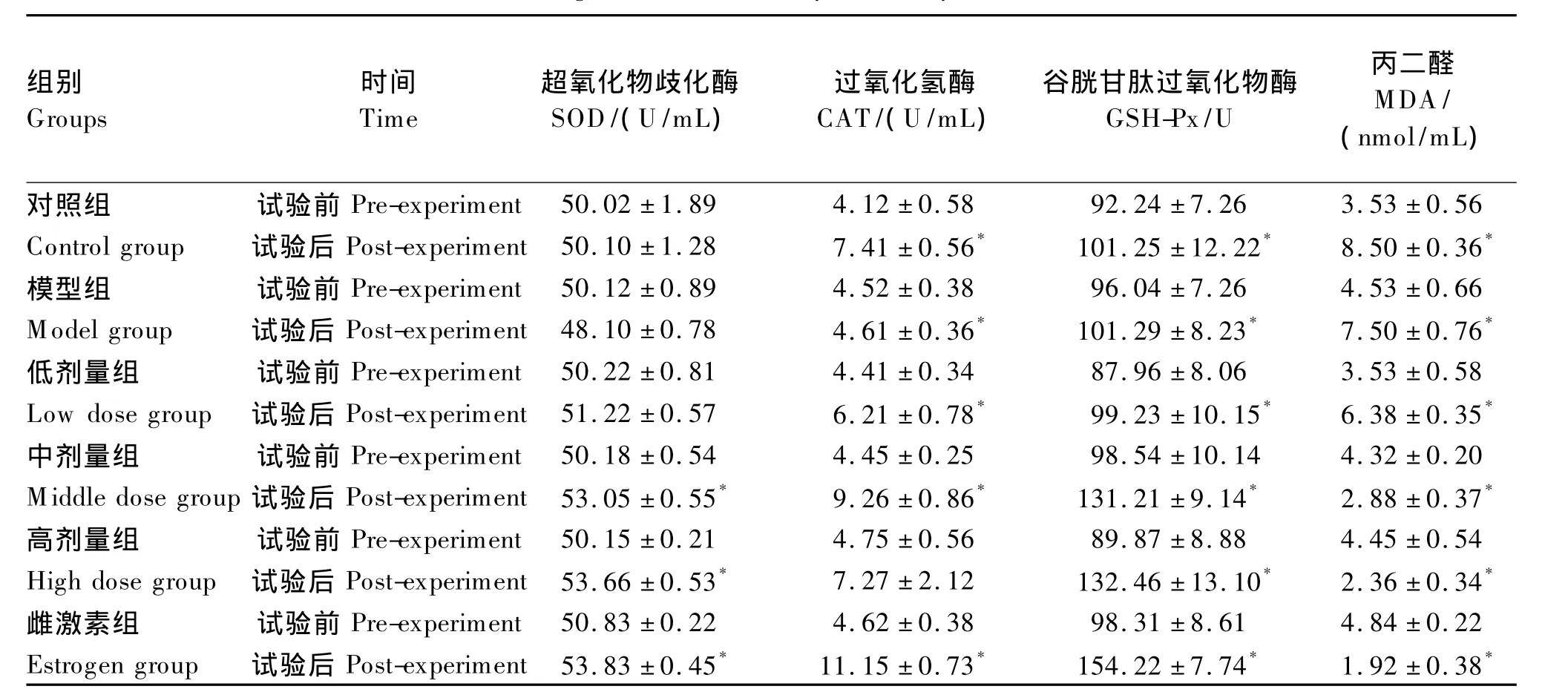
表3 大鼠卵巢组织中抗氧化酶活性变化Table 3 The change of antioxidant enzyme activity in rat ovarian tissue
3 讨论
GEN是大豆中异黄酮的主要成分,主要以游离型苷元和结合型糖苷形式存在。GEN为多酚类化合物,相对分子质量为270,其结构和相对分子质量与雌二醇类似,可介导弱的雌激素样作用。其雌激素活性仅为雌二醇的0.001% ~0.100%,又被称为植物雌激素。研究表明GEN具有抑制肿瘤、雌激素样作用、影响骨代谢和心血管系统及抗氧化等广泛药理活性。目前对于GEN的雌激素样作用的研究主要集中在乳腺癌、绝经期综合征的预防和治疗方面,而对PCOS的研究报道较少。
动物卵巢是许多化学物质作用的靶器官之一,卵巢细胞的结构和功能状态与雌性的性腺发育和生殖功能有着密切的联系。进一步的研究表明,凋亡细胞的形态学变化不仅涉及一系列复杂的级联酶的生化反应,也涉及到基因表达的差异及阳性和阴性信号转导系统。卵巢凋亡细胞的调节是通过 Fas系统和 Bcl-2家族实现的[8-10]。Bcl-2家族蛋白被认为是调节线粒体中蛋白质水平的主要物质,它们可分为2类,一类具有抗细胞凋亡作用,如 Bcl-2、Bcl-W、Bcl-xl等,另一类具有促进细胞凋亡作用,如 Bax、Bim、Bcl-xS、Bod等。Bcl-2存在于内质网膜与线粒体膜上,它可通过抑制细胞凋亡诱导因子的释放阻止细胞凋亡[11]。Hsu等[12]报道,当Bcl-2基因在转基因小鼠卵巢颗粒细胞的表达增加时,小鼠排卵率和产仔数显著高于正常小鼠。另有研究表明,鸡颗粒细胞转染外源性Bcl-2可以减少第2代颗粒细胞凋亡的比例,这表明 Bcl-2可以抑制鸡颗粒细胞凋亡[13]。Bcl-2基因在人类卵巢组织表达。在人类卵巢颗粒细胞的原代培养试验中,Bcl-2在抑制细胞凋亡中起着关键的作用。Bcl-2抑制细胞凋亡的机制尚不完全清楚。一些研究表明,Bcl-2蛋白和相关细胞器,特别是线粒体膜相关蛋白,可以通过干扰细胞内质网Ca2+释放或通过防止脂质过氧化和抑制自由基的产生而抑制细胞凋亡[14-16]。在本研究中,采用不同剂量的GEN作用于PCOS大鼠卵巢颗粒细胞,随着GEN剂量的增加,Bcl-2 mRNA表达增强,细胞凋亡明显减少。
研究表明,在小鼠体内的组织器官中,Bax比Bcl-2更广泛地存在于肺、胃、淋巴结、脾、骨髓和其他组织中[17]。促进细胞凋亡的Bax蛋白可能与抗细胞凋亡的Bcl-2和Bcl-xl蛋白形成异源二聚体,从而引起Bax失去其促凋亡作用。当体内有过多的Bax时会导致细胞凋亡。本研究结果表明,当给予不同剂量的GEN时,大鼠卵巢颗粒细胞中Bax mRNA表达随着GEN剂量的增加而减少,从而减少细胞凋亡。
GEN具有较强的抗氧化作用,能清除体内的活性氧自由基,保护人体内脂质、蛋白质、染色体免受活性氧的攻击,减少脂质过氧化物的产生。对大鼠卵巢组织中抗氧化酶活性测定的结果表明,GEN不同剂量组的SOD活性均呈上升趋势,高剂量组最为明显。GEN通过抗氧化剂的还原作用直接给出电子而清除自由基,从而可升高CAT活性。另外,从中剂量组开始MDA含量呈下降趋势,表明GEN可以通过雌激素样作用降低卵巢组织中MDA含量,诱导酶活性防御系统消除老化的相关代谢产物,保护机体和细胞免受自由基损伤,进而发挥其抗氧化作用。
为了阐明PCOS的发病机制仍然有许多工作要做。本研究结果证实,细胞增殖和细胞凋亡在大鼠卵泡囊性改变中占有重要地位,GEN的雌激素样作用能有效地调节PCOS大鼠卵巢组织中Bcl-2及Bax mRNA的表达量,关于其确切的作用通路还需要进一步的研究来确定。
4 结论
本研究结果表明,20 mg/kg GEN可以使抗凋亡基因Bcl-2 mRNA的表达量显著增高,抑制促凋亡基因Bax mRNA表达,并且可调节卵巢组织中抗氧化酶的活性,其作用效果与雌激素相似,提示GEN可通过影响卵巢组织中细胞凋亡因子的表达而改善PCOS卵巢功能。
[1] AZZIZ R,SANCHEZ L A,KNOCHENHAUER E S,et al.Androgen excess in women:experience with over 1 000 consecutive patients[J].Journal of Clinical Endocrinology and Metabolism,2004,89(2):453-462.
[2] AZZIZ R.Controversy in clinical endocrinology:diagnosis of polycystic ovarian syndrome:the Rotterdam criteria are premature[J].Journal of Clinical Endocrinology and Metablism,2006,91(3):781-785.
[3] YANG J,LIU X S,BHLLA K,et al.Prevention of apoptosis by Bcl-2 release of cytochrome c from mitochondria blocked[J].Science,1997,275(5303):1129-1132.
[4] JAHANFAR S,EDEN JA,WARREN P,et al.A twin study of polycystic ovary syndrome[J].Fertility and Sterility,1995,63:478-486.
[5] EDEN J A.The polycystic ovary syndrome:a review[J].Australian and New Zealand Journal of Obstetrics and Gynaecology,1989,29(4):403-415.
[6] KOGISO M,SAKAI I,MITSUYA K,et al.Genistein suppresses antigen-specific competition with 17 betaestradiol receptors for estrogen in ovalbumin-immunized BALB/c mice[J].Nutrition,2006,22(7/8):802-809.
[7] PORETSKY L,CLEMONS J,BOQOVICH K.Hyperinsulinemia and human chorionic gonadotropin synergistically promote the growth of ovarian follicular cysts in rats[J].Metabolism,1992,41(8):903-910.
[8] HSU S Y,HSUEH A J.Tissue-specific Bcl-2 protein partners in apoptosis:an ovarian paradigm[J].Physiological Reviews,2000,80(2):593-614.
[9] HUSSEIN M R.Apoptosis in the ovary:molecular mechanisms[J].Human Reproduction Update,2005,11(2):162-177.
[10] SLOT K A,VOORENDT M,DE BOER-BROUWER M,et al.Estrous cycle dependent changes in expression and distribution of Fas,Fas ligand,Bcl-2,Bax,and pro-and active caspase-3 in the rat ovary[J].Journal of Endocrinology,2006,188(2):179-192.
[11] JOHNSON A L,BRIDGHAM J T.Caspase-mediated apoptosis in the vertebrate ovary[J].Reproduction,2002,124(1):19-27.
[12] HSU S Y,LAI R J,FINEGOLD M,et al.Targeted overexpression of Bcl-2 in ovaries of transgenic mice leads to decreased follicle apoptosis,enhanced folliculogenesis,and increased germ cell tumorigenesis[J].Endocrinology,1996,137(11):4837-4843.
[13] 周东蕊,杨利国,姜勋平,等.外源bcl-2基因和脂质体对鸡卵泡颗粒细胞体外分裂和凋亡的影响.[J].南京农业大学学报,2001,24(2):75-78.
[14] MATHAI J P,GERMAIN M,SHORE G C.BH3only BIK regulates BAX,BAK-dependent release of Ca2+from endoplasmic reticulum stores and mitochondrial apoptosis during stress-induced cell death[J].Journal of Biological Chemistry,2005,280(25):23829-23836.
[15] RANJAN P,BOSSJM.C/EBPbeta regulates TNF induced MnSOD expression and protection against apoptosis[J].Apoptosis,2006,11(10):1837-1849.
[16] MÉTRAILLER-RUCHONNET I,PAGANO A,CARNESECCHI S,et al.Bcl-2 protects against hyperoxiainduced apoptosis through inhibition of the mitochondria-dependent pathway[J].Free Radical Biology and Medicine,2007,42(7):1062-1074.
[17] KRAJEWSKI S,KRAJEWSKA M,SHABAIK A,et al.Immunohistochemical determination of in vivo distribution of Bax,a dominant inhibitor of Bcl-2[J].A-merican Journal of Pathology,1994,145(6):1323-1336.
