R 122 L突变提高重组人阴离子型胰蛋白酶的稳定性的研究
2014-09-18马强吴倩李素霞
马强,吴倩,李素霞
(生物反应器工程国家重点实验室,华东理工大学,上海 200237)
R 122 L突变提高重组人阴离子型胰蛋白酶的稳定性的研究
马强,吴倩,李素霞Δ
(生物反应器工程国家重点实验室,华东理工大学,上海 200237)
目的研究自切位点突变R 122 L对重组人阴离子型胰蛋白酶稳定性的影响。方法在大肠杆菌中表达重组人阴离子型胰蛋白酶和R 122 L突变体,并进行纯化,对纯化后酶及其突变体的稳定性进行对比研究。结果mhT 2(R 122 L)发挥催化活力的最适pH为7~11;低温及酸性环境中稳定性较好,其活力在pH 7.6条件下同样能被典型的金属离子螯合剂(如EDTA)、还原剂(如β-ME)、变性剂、Fe3+及丝氨酸蛋白酶抑制剂所抑制,以N-苯甲酰-L-精氨酸(n-benzoyl-l-arginine ethyl ester,BAEE)作为底物时的米氏常数为0.010 mmol/L。结论相比于hT2野生型,R 122 L突变体蛋白最适pH范围增大,耐热性能也有所提高,与底物BAEE的亲和力增强,同时对于Fe3+、金属离子螯合剂、还原剂以及变性剂等的耐受力也有增强,稳定性大大提高。
重组人阴离子型胰蛋白酶;点突变;R 122 L;稳定性
胰蛋白酶(EC 3.4.21.4)是一种丝氨酸蛋白酶,由胰腺分泌的胰蛋白酶原激活产生,能专一性的水解精氨酸和赖氨酸羧基端的肽键,同时也能切割自身精氨酸或赖氨酸位点而导致自身降解(autolysis)[1]。目前,胰蛋白酶有2个已知的形式:β-trypsin(23463 Da)和 α-trypsin(23481 Da)。由于肽键发生水解,α-trypsin比β-trypsin多了18 Da[2]。在牛源胰蛋白酶中,β-trypsin可以在Arg 122-Val 123、Lys 148-Ser 149和Lys 162-Ala 163之间的肽键发生水解导致3种可能的α-trypsin亚型。人源胰蛋白酶和牛源胰蛋白酶具有很高的同源性,但在148位点人源胰蛋白酶为Ala,在162位点为Asp[3]。所以Arg 122是人胰蛋白酶-2最重要的自溶位点。已有报道,遗传性胰腺炎病人体内的胰蛋白酶原-1在Arg 122部位突变为His 122,能抵抗自身降解失活,因此导致胰腺组织的自身消化[4]。另有文献报道将鼠源胰蛋白酶该位点突变为Leu能显著提高胰酶的半衰期,并且维持较高的催化活性[5]。我们考虑在该位置引入突变R 122 L,封闭其自溶位点,减少自水解的发生,从而提高胰蛋白酶的稳定性。
1 材料与方法
1.1 菌株与表达质粒 E.coli BL 21(DE 3)、人源阴离子型胰蛋白酶突变体质粒[mhT 2(R 122 L)]质粒均由本实验室保存。
1.2 仪器和试剂 FE-20 pH计(梅特勒-托利多仪器公司);AB 104-N分析天平(梅特勒-托利多仪器公司);T6紫外分光光度计(北京普析通用仪器公司);JM-250型电泳仪(大连捷迈科建有限公司);VDS凝胶成像系统(上海复日科技公司);BAEE,(Sigma);重组人胰蛋白酶hT 2,购自上海雅心生物技术有限公司;其它试剂均为分析纯。
1.3 方法
1.3.1 mhT 2(R 122 L)突变体的制备[6]将mhT 2(R 122 L)质粒转化至E.coli BL 21(DE 3)中,涂板过夜后挑取单菌落于37℃,180 r/min在添加有50 μg/mL的卡那霉素的LB培养基中,培养至OD600=0.6时加入0.5 mmol/L的IPTG进行诱导。继续培养4 h后,取出一定量的菌液稀释至OD 600为1.0,吸取1 mL进行SDS-PAGE分析。3000 r/min,20 min离心收集其余菌体。
把收集到的菌体用50 mmol/L pH 8.0 Tris-HCl按1∶15(m/v)充分悬浮起来,超声破碎,然后12000 r/min离心10 min,弃去上清。沉淀包涵体第1次用0.5% Triton X-100溶液,50 mmol/L pH 8.0 Tris-HCl缓冲液充分洗涤,然后12000 r/min离心 10 min;第 2次用含有 2 mol/L Urea,50 mmol/L pH 8.0 Tris-HCl缓冲液充分洗涤,然后12000 r/min离心10 min;第3次用去离子水再洗1次,然后12000 r/min离心10 min;收集包涵体[7]。将初次纯化的包涵体进行常规复性[8-9]。采用CM-FF阳离子型交换柱对复性液进行纯化,准备好2 cm×15 cm层析柱,装入适量体积的CM阳离子交换树脂,用pH 5.0缓冲液平衡至基线,用含0~0.25 mol/L NaCl的缓冲液连续梯度式洗脱,并收集目的峰的流出液。
1.3.2 hT2与mhT 2(R 122 L)的最适pH及pH稳定性 最适pH:配制pH为3~12的底物BAEE,分别测定hT及mhT 2(R 122 L)纯酶液的活性,结果表示为测定值占最高酶活的百分比。缓冲液依次为NaAc-HAc(pH 3~6),Tris-HCl(pH 7~8),Gly-NaOH(pH 9~11),所有缓冲液均25℃配制。
pH稳定性:取hT2及mhT 2(R 122 L)纯酶液,分别在pH 3~pH 11缓冲液中稀释10倍,于25℃下温育2 h,取样按常规方法测定酶活,以水浴前酶液的初始活性作为100%,计算残余率。缓冲液依次为NaAc-HAc(pH 3~6),Tris-HCl(pH 7~8),Gly-NaOH(pH 9~11),所有缓冲液均25℃配制。
1.3.3 hT2与mhT 2(R 122 L)的最适温度及温度稳定性 最适温度:将底物 BAEE分别置于 4℃、15℃、20℃、25℃、30℃、40℃、50℃、60℃和70℃水浴中温育30min,加入hT2及mhT 2(R 122L)纯酶液测定活力,结果表示为OD253nm随时间的变化曲线。
温度稳定性:取hT2及mhT 2(R 122 L)纯酶液,分别置于 4℃、15℃、20℃、30℃、40℃、50℃、60℃水浴中温育 2 h,每隔10 min取样,按常规方法测定酶活性,以水浴前酶液的初始活性作为100%计算残余率。
1.3.4 金属离子及化学试剂对hT2与mhT 2(R 122 L)活性的影响 在pH 3和pH 7.6的条件下分别向hT2和mhT 2(R 122 L)纯酶液中分别加入1 mmol/L的不同金属离子(Zn2+、Mg2+、Ba2+、Mn2+、Ca2+、Fe2+、Cu2+)及 1%的 EDTA(乙二胺四乙酸),PMSF(苯甲基磺酰氟),DTT(二巯基苏糖醇),SDS(十二烷基硫酸钠),Triton X-100,4℃保温24 h后测活性。
1.3.5 Km值的测定 以BAEE为底物,测定mhT 2(R 122 L)和hT2的米氏常数Km。底物BAEE的浓度范围为0.005~0.25 mmol/L,用双倒数作图法,以底物浓度的倒数值为横坐标,反应速率即活性的倒数值为纵坐标做图,与X轴交点的负倒数即为Km。
2 结果
2.1 mhT 2(R 122 L)突变体的制备 经15%的SDS-PAGE分析表明,诱导后mhT 2(R 122 L)的位置在大于29 kDa处有明显的表达(见图1),破菌处理后,沉淀中可见大量表达,上清中基本没有目的条带。可见mhT 2(R 122 L)是以包涵体的形式表达。

图1 mhT 2(R 122 L)蛋白电泳表达图M. Marker;1. 诱导前;2. 诱导后;3. 超声破碎后上清;4. 超声破碎后沉淀Fig.1 Identification of recombinant mhT 2(R 122 L) based on the SDS-PAGE analysisM. Marker;1. contrast;2. induced;3. Supernatant after ultrasonication;4. Sediment after ultrasonication
重组mhT 2(R122 L)包涵体稀释复性后,酶原经激活得到活性 mhT 2(R122 L),用 20 mmol/L NaAc-HAc pH 5.0 透析,低温上柱,经过CM-FF离子交换层析纯化获得比活力为12000 U/mg的mhT 2(R122 L)纯酶液,洗脱曲线见图2。
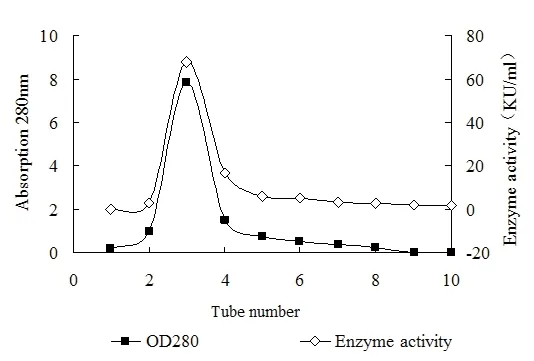
图2 CM-FF色谱纯化mhT 2(R 122 L)Fig.2 CM-FF chromatography of mhT 2(R 122 L)
2.2 hT2与mhT 2(R 122 L)的最适pH及pH稳定性 在pH 3~pH 12范围内分别测定hT2和mhT 2(R 122 L)的活性结果见图3,mhT 2(R 122 L)的最适pH范围增大,在pH 7~11之间酶的催化活力都很好,其中pH 10底物条件下测得的活性值最高,而pH≤5和pH≥12条件下,mhT 2(R 122 L)基本没有催化活性。而与hT2相比较,mhT 2(R 122 L)在pH 5和pH 6条件下催化活力都明显高于hT 2,说明该突变体对酸的耐受力要明显强于hT 2。

图3 hT2和mhT 2(R 122 L)的最适pH测定Fig.3 Measurement of optimal pH of recombinant hT 2 and mhT 2(R 122 L)
将酶液放置在25℃不同pH环境中温浴2 h后,检测其残余酶活,结果见图4。过酸或过碱都会造成蛋白的严重失活;在pH 3~6范围内,酶活残余率都保持在80%以上,而在pH7以上,随着pH的升高,酶活呈现下降趋势,更加说明mhT 2(R 122 L)对碱的耐受性不强。其中pH 5.0是mhT 2(R 122 L)相对最为稳定的pH条件。与hT2相对照,整体趋势没有太大变化,只是hT 2 pH越低越稳定,而mhT 2(R 122 L)在pH 3~5之间稳定性则相差不大。

图4 hT2和mhT 2(R 122 L)的pH稳定性Fig.4 Stability of recombinant hT 2 and mhT 2(R 122 L)in different pH buffer
2.3 hT 2与mhT 2(R 122L)的最适温度及温度稳定性 将底物分别置于 4℃、15℃、20℃、25℃、30℃、40℃、50℃、60℃、70℃和80℃水浴中,加入hT2和mhT 2(R 122 L)纯酶液测活,结果表示为OD 253 nm随时间的变化曲线。图5显示,温度越高,测得每分钟吸光度的变化值也就越高。mhT 2(R 122 L)在80℃时酶反应速率最快,并且在5 min内线性关系良好,相比之下,比野生型更为耐热。

图5 hT2和mhT 2(R 122 L)的最适温度测定Fig.5 Mensurement of optimal temperature of hT 2 and mhT 2(R 122 L)
如图6所示:4℃条件下胰蛋白酶相对最为稳定,2 h内酶活几乎不损失;25℃温育2h后尚能残余80.3%酶活;而与hT2相同的是,随温度的升高,胰蛋白酶分子的降解速率也随之加快,mhT 2(R 122 L)酶活残余率也逐渐降低;40℃条件下2h内酶活残余仅35.5%。与hT2相比,突变体mhT 2(R 122 L)在60℃温育20 min完全失活,其热稳定性略高于hT 2(10 min内即完全失活),耐热性能优于hT 2。

图6 hT2和mhT 2(R 122 L)的温度稳定性Fig.6 Stability of hT 2 and mhT 2(R 122 L) under different temperature
2.4 金属离子及化学试剂对hT2与mhT 2(R 122 L)活性的影响 如表1所示。其中pH 7.6条件下,添加Ba2+、Ca2+、Co2+有利于维持酶活的相对稳定,24 h后残余酶活达95%以上;但是加入重金属离子Fe3+,就会使酶迅速沉淀而逐渐丧失活性。加入SDS后hT2很快失活,而突变型hT 2(R 122 L)却在24 h后仍能残余50%左右的酶活;加入金属离子螯合剂(EDTA)和还原剂(β-ME)后酶蛋白在2 h后酶活维持在75%以上;加入0.1 mmol/L PMSF(丝氨酸蛋白酶抑制剂)24 h后酶活残余90%。
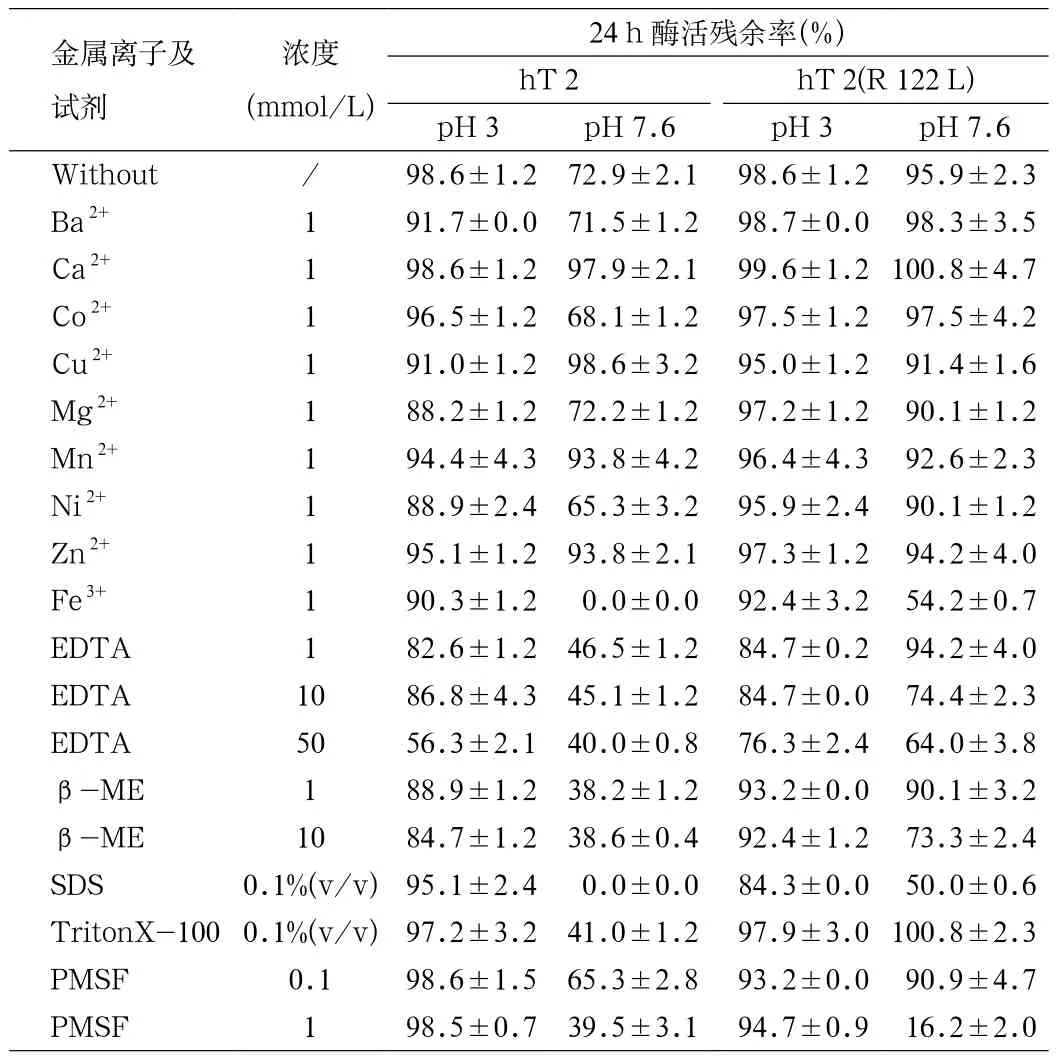
表1 金属离子及其他试剂对hT2及mhT 2(R 122 L)酶活的影响Tab.1 The in fl uence of metal ions and some reagents on enzyme activities of hT 2 and mhT 2(R 122 L)
pH3 条件下在酶液中加入 1 mmol/L Ba2+,Ca2+,Co2+,Cu2+,Mg2+,Mn2+,Ni2+,Zn2+,Fe3+等各种金属离子,孵育 24 h后酶活仅仅损失了不到10%。
2.5 Km值的测定 将米氏方程式等号两边取倒数,以1/v对1/[S]作图得一直线,其斜率是Km/V,在纵轴上的截距为1/V,横轴上的截距为-1/Km。依据图7求得hT2突变体R 122 L对底物BAEE的Km值为0.010 mmol/L,Vmax为 2500 μmol/min。hT2突变体 R 122 L与其 hT 2(Km 值为0.015 mmol/L)相比较,其Km值偏小,说明突变体与底物BAEE的结合率比hT2与底物BAEE的结合率强。

图7 hT2和mhT 2(R 122 L)的Km值测定v:反应速度;[S]:底物浓度;反应条件:25 mmol/L Tris-HCl缓冲液,pH 7.6,0.1 M NaCl,0.01 mol CaCl 2;温度,25℃Fig.7 Determination of Km of hT 2 and mhT 2(R 122 L)v:the reaction rate; [S]:the concentration of substrate; reaction conditions:25 mmol/L Tris-HCl buffer, pH 7.6, 0.1 M NaCl, 0.01 mol CaCl 2;temperature, 25℃
3 讨论
非还原凝胶电泳,也称为天然凝胶电泳。在凝胶中蛋白质的分离取决于它所带电荷及分子大小[7]。如图8所示:mhT 2(R 122 L)基本上只有一条主带,并且该条带迁移速率较快;而
hT2样品在此条带位置之上,还有一条迁移速率较慢的电泳条带,从条带亮度上看含量小于主带。hT2有α和β两种构型之分,hT2最主要的自消化位点Arg 122-Val 123,会自我识别并切割Arg羧基端的肽键而降解成两条肽段heavy chain(Val 123-Ser 247)和 light chain(Ile 24-Arg 122)[10]。如图 8所示:在hT2中,有部分蛋白发生了水解而形成了的α-胰蛋白酶,从电泳图上来看,α-胰蛋白酶迁移速率会比较慢,虽然具有与β-胰蛋白酶相似的活性,但是由于含有自溶位点,相比于β-胰蛋白酶更容易降解而失活[11]。突变体R 122 L将该位点的精氨酸突变为亮氨酸,使得该位点不再被胰蛋白酶识别和切割,遏制了β-胰蛋白酶转化成α-胰蛋白酶的过程,大大的减少了胰蛋白酶的自我消化和降解,提高了其稳定性,相应的蛋白结构和性质等也都有了一定的改变[12]。

图8 mhT 2(R 122 L)和hT2的非还原电泳图Fig.8 Identification of hT 2 and mhT 2(R 122 L) based on the native SDS-PAGE analysis
野生型的Arg 122位点是碱性氨基酸,氨基酸侧链较长,位于胰蛋白酶分子表面Autolysis loop(见图9a),并且该位点同时带有胰蛋白酶分子所能特异性识别并进行切割的Arg,从而易于发生水解而断裂。Arg 122位突变为Leu后(见图9b),由碱性氨基酸变成了非极性的脂肪族氨基酸,侧链相对较短,最重要的是不再是胰蛋白酶的自消化位点,稳定性自然增强[13]。
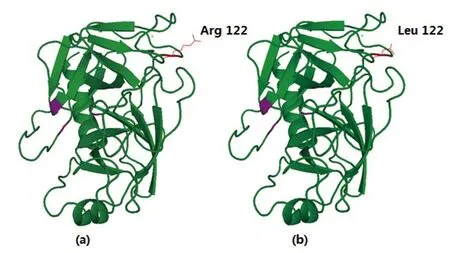
图9 hT2和mhT 2(R 122 L)三维结构Fig 9 Three-dimensional structure of hT 2 and mhT 2(R 122 L)
mhT 2(R 122 L)突变体蛋白相比于hT2野生型最适pH范围增大,能够耐受极酸环境,耐热性能也有所提高,与底物BAEE的亲和力增强,特别是加入重金属Fe3+,变性剂SDS,还原剂β-ME,抑制剂PMSF等试剂对胰蛋白酶的影响也都大幅减弱,稳定性大大提高。
人胰蛋白酶的突变对先天性胰腺炎及遗传性胰腺炎的影响重大[14]。近年来不断有新的报道指出胰蛋白酶的基因突变是导致胰腺炎及相关疾病的元凶[15]。针对于不同的突变体,我们可以从酶学性质上对其进行比较,从蛋白结构上对找到突变对于酶学性质改变的影响,这无论是对于治疗胰腺炎及相关疾病,还是对于重组胰蛋白酶进行定向改造都是有着很好的借鉴意义。本研究中,我们通过性质的比较阐明了R 122位点对于hT2稳定性的影响,从减少自降解的角度提高了hT2的稳定性。但对于R 122 L突变体在与其它蛋白酶相互作用及应用上的研究还需进一步深入。
[1] YamashinaI.The action of enterokinase on trypsinogen[J].Acta.Chem.Scand,1956,20(2):739-743.
[2] Walsh KA.Trypsinogens and trypsins of various species[J].Methods Enzymol,1970,19(1):41-63.
[3] Szabó A,Sahin-Tóth M.Determinants of chymotrypsin C cleavage specificity in the calcium-binding loop of human cationic trypsinogen[J].FEBS J,2012,279(23):4283-4292.
[4] James T,Ronald CR.Human TrypsinIsolation and Physical-ChemicalCharacterization[J].Biochemistry,1969,8(7):2884-2889.
[5] XinFL,Xin N,Jian GT.Anti-autolysis of Trypsin by Modification of Autolytic Site Arg 117[J].Biochemical and biophysical research communicatio ns,1998,250(2):235-239.
[6] 朱乃硕,涂艳,欧西军.重组人胰蛋白酶原2表达载体的构建、表达及其单克隆抗体的制备和应用[P].中国:CN200410099275.1,2004:12-29.
[7] 汪家政,范明.蛋白质技术手册[M].北京科学出版社,2002:42-47
[8] 王亚辉,爱洁,李素霞,等.包涵体蛋白质的品质[J].生命的化学,2009,4(29):609-612.
[9] 张晓彦,李素霞,顾俊杰,等.重组羧肽酶原B的体外变复性研究[J].分子科学学报,2005,4(10):124-129.
[10] Miklos ST,Miklos T.Gain-of-function mutation associated with hereditary pancreatitis enhance autoaction of human cationic Trypsingen[J].Biochem Biophys Res Commun,2000,278(2):286-289.
[11] Naohiko K,Hidetaro Y,Yoji N,et al.Identification of one- and two-chain forms of trypsinogen 1 produced by a human gastric adenocarcinoma cell line[J].Biochem,1994,303(1):187-190.
[12] Steven JP,Michael B,Michael NL.Comparison of Various Molecular Forms of Bovine Trypsin:Correlation of Infrared Spectra with X-ray Crystal Structures[J].Biochemistry,1991,30(1):133-143.
[13] Szabó A,Sahin-Tóth M.Increased activation of hereditary pancreatitisassociated human cationic trypsinogen mutants in presence of chymotrypsinC[J].J Biol Chem,2012,287(24):20701-20710.
[14] Schnúr A,Beer S,Witt H,et al.Functional effects of 13 rare PRSS 1 variants presumed to cause chronic pancreatitis[J].Gut,2014,63(2):337-343.
[15] Sultan M,Werlin S,Venkatasubramani N.Genetic prevalence and characteristics in children with recurrent pancreatitis[J].J Pediatr Gastroenterol Nutr,2012,54(5):645-650.
The research of site R 122 L mutate improve the stability of recombinant human anionic trypsin
MA Qiang,WU Qian,LI Su-xiaΔ
(State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China)
ObjectiveThe stability and other characteristics of the active recombinant human anionic trypsin(hT 2) with site-mutation R 122 L(mhT 2) were investigated.MethodsAn active human anionic trypsin and its R 122 L mutate were produced with E.coli BL 21(DE 3) and purified with ion-exchange chromatography. The properties of mutant were studied and compared with the wild type.ResultsThe optimal pH for mhT 2 was 7~11. mhT 2 was active over a broad temperature range (4℃~80℃) and owned a little better thermal stability than the wild type. The inhibition of typical metal chelating agent(EDTA), Fe3+, denaturant, reducer(β-ME) on activity of mhT 2 was the same as the wild type. Michaelis constant Km of mhT 2 was 0.010 mmol/L with BAEE as a substrate, a little lower than wild type.ConclusionCompared with the wild type, the R 122 L site mutate significantly enhanced tolerance to acidic pH、denaturants、reductions and autolysis.
recombinant human anionic trypsin; site-directed mutagenesis; R 122 L; stability
R 394.3
A
1005-1678(2014)02-0061-05
马强,男,硕士,研究方向:分子生物学,E-mail:maqiang 79 fox@163.com;李素霞,通信作者,女,博士,副教授,研究方向:分子生物学,E-mail:lisuxia@ecust.edu.cn。
