转铁蛋白与R8共修饰脂质体的制备及其肝癌靶向性研究
2014-09-18韩立杰刘伟杜娟魏冬冬
韩立杰,刘伟,杜娟,魏冬冬
(沧州市中心医院 放疗科,河北 沧州 061001)
转铁蛋白与R8共修饰脂质体的制备及其肝癌靶向性研究
韩立杰,刘伟Δ,杜娟,魏冬冬
(沧州市中心医院 放疗科,河北 沧州 061001)
目的制备转铁蛋白(transferrin,TF)和八聚精氨酸(R8)共修饰脂质体(TF/R8-LP),对其理化性质进行表征,研究脂质体对肿瘤细胞的靶向性。方法采用薄膜分散法制备TF/R8-LP,研究脂质体的粒径,电位和血清稳定性。细胞摄取实验研究肝癌HepG2细胞对TF/R8-LP的摄取效率。构建裸鼠肝癌异位瘤模型,研究脂质体的体内靶向性。结果TF/R8-LP的粒径在(108.5±12.6)nm,电位为(24.15±4.78)mV。TF/R8-LP在50%血清中具有良好的稳定性。细胞摄取实验结果显示:TF/R8-LP在4 h摄取效率是2 h的1.85倍,差异具有统计学意义(P<0.05);肝癌HepG2细胞在与脂质体共同孵育4 h后对TF/R8-LP的摄取效率分别是R8-LP、TF-LP和LP的2.4倍、2.8倍和3.9倍,差异均有统计学意义(P<0.01);近红外活体成像实验结果显示:TF/R8-LP组在肿瘤组织荧光明显强于其他组。结论转铁蛋白和八聚精氨酸共修饰脂质体具有良好的肝癌细胞亲和力,是一种潜在高效的肝癌靶向给药系统。
转铁蛋白;八聚精氨酸;肿瘤靶向
1 材料与方法
1.1 材料与仪器 人源HepG2肝癌细胞(购自ATCC)。SizerNano ZS90型激光粒度仪及ZETA电位分析仪(英国Malvern instruments Ltd)。大豆磷脂(SPC,上海太伟药业有限公司);胆固醇(Chol,成都科龙公司);DSPE-PEG3500(美国 Avanti polar lipids);FITC标记磷脂(美国sigma公司);DMEM高糖培养基和胎牛血清(美国GIBCO公司);其余试剂为分析纯。
1.2 方法
1.2.1 HepG2细胞的培养:将HepG2细胞置于含有10%胎牛血清的DMEM培养基中培养,培养条件为5%CO2,饱和湿度,温度为37℃。待细胞汇合度为0.8~0.9时,用0.25%胰酶消化传代,取对数生长期细胞进行实验。
1.2.2 RGD/R8-LP-PTX的制备及其表征:参照文献方法[11]合成DSPE-PEG2000-R8。使用薄膜分散法制备TF/R8-LP。将处方量的 SPC,Cho,DSPE-PEG2000-R8,DSPE-PEG-OMe[保证总磷脂∶胆固醇 =70∶30(molar ratio)],分别溶于氯仿,置50mL茄形瓶中旋转蒸发成膜后,再置真空干燥器中过夜。加入2.5mL PBS缓冲液(pH7.4),置空气浴摇床中,37℃,180 r/min,20min水化,水浴超声5 min脱膜,探头超声制备得到R8修饰脂质体。用后插入法[12]制备TF/R8-LP。首先将转铁蛋白巯基化,再与商品化的DSPE-PEG3500-MAL孵育得到转铁蛋白胶束,将胶束后插入已经制备的R8-LP得到TF/R8-LP。用FITC标记的磷脂取代适量的大豆磷脂,制备得到FITC标记的脂质体,取适量制备得到的脂质体样品,用激光粒度仪测定其粒径和电位。
取各组样品500μL,分别与等体积的磷酸盐缓冲液、含50%FBS的磷酸盐缓冲液混合,于37℃下分别孵育1、4、8、12、24 h,测定其在750 nm的透光率。以样品在磷酸盐缓冲液中的透光率值为空白,以样品在含有50%FBS的磷酸盐缓冲液中的透光率与其在磷酸盐缓冲液中的透光率的比值来评价脂质体在血清中的稳定性。
1.2.3 HepG2肝癌细胞对TF/R8-LP的摄取:将对数生长期的细胞以5×105个/孔的密度接种于6孔板中,37℃培养24 h后,每孔加入适量 FITC标记的 LP、R8-LP、TF-LP和 TF/R8-LP,使孔中FITC标记的磷脂浓度为0.35μg/mL,37℃分别孵育2 h和4 h后除去含脂质体培养基,冷PBS清洗3次,0.25%胰酶消化后离心,PBS清洗3次,流式细胞仪测定细胞荧光值。
1.2.4 转铁蛋白和R8共修饰脂质体的体内分布:HepG2肝癌细胞经胰酶消化,离心后将其悬浮于DMEM培养液中,计数调节浓度至5×107个/mL。取4只雄性裸鼠用0.4 g/kg水合氯醛麻醉,将准备好的HepG2肝癌细胞悬浊液皮下接种于裸鼠左右背部各一处,每个点接种0.1mL细胞悬浊液。接种后1~2周可见左右背部长出100~200 mm3肿瘤块,证明接种成功。取5只接种成功后的裸鼠随机分为5组,分别为生理盐水组、LP组、TF-LP组、R8-LP组和TF/R8-LP组。
照“1.2.2”项下方法制备载近红外荧光染料DIR的不同脂质体,荷瘤裸鼠尾静脉注射脂质体0.1mL,12 h后将小鼠用10%水合氯醛麻醉,于荧光活体成像系统下观察并拍照(Ex=630 nm,Em=700 nm)。
1.3 统计学方法 采用SPSS21.0统计软件进行数据分析,正态计量数据以“±s”表示,2组间比较用t检验,多组间比较用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 脂质体的表征 取制备得到的TF/R8-LP用马尔文激光粒度仪测定粒度和zeta电位,平行测定3次。结果显示TF/R8-LP的平均粒径为(108.5±12.6)nm,多分散性系数为0.14,Zeta电位为(24.15±4.78)mV(见表1)。
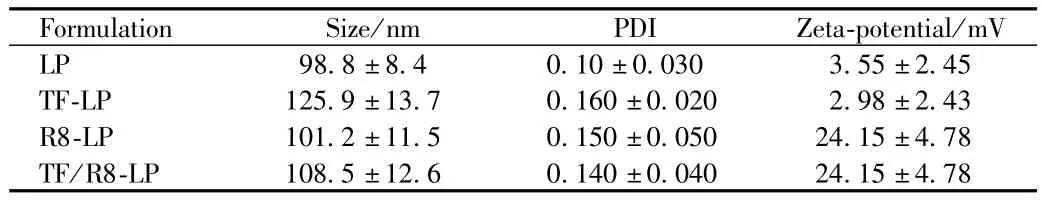
表1 不同脂质体的表征Tab.1 Characteristics of TF-LP,R8-LP and TF/R8-LP
2.2 脂质体的血清稳定性 血清稳定性结果显示:各组脂质体在50%的血清中的透光率与其在FBS中的透光率的比值均大于90%,表明4种脂质体24 h内在血清中均具有较好的稳定性(见图1a)。各组脂质体在50%血清中,粒径保持稳定(见图1b)。

图1 不同脂质体在50%FBS中的透光率变化(a)和粒径变化(b)Fig.1 Transmittance variation(a)and particle size(b)of different liposomes in 50%FBS
2.3 HepG2细胞对TF/R8-LP的摄取 细胞摄取实验结果表明:肿瘤细胞对脂质体的摄取随着时间的延长而增加,TF/R8-LP在4 h摄取效率是2 h的1.85倍,差异有统计学意义(P<0.05);肝癌HepG2细胞在与脂质体共同孵育4 h后对TF/R8-LP的摄取效率分别是R8-LP、TF-LP和LP的2.4倍、2.8倍和3.9倍,差异均有统计学意义(见图2,P<0.01)。

图2 不同脂质体与HepG2细胞共孵育2 h和4 h后的摄取效率**P<0.01,与2 h相比;ΔΔP<0.01,与 R8-LP和 TF-LP相比Fig.2 Efficiency of cellular uptake in vitro at2 h and 4 h incubation with different liposomes**P<0.01,compared with 2h;ΔΔP<0.01,compared with R8-LP and TF-LP
2.4 TF/R8-LP的体内分布 荷瘤裸鼠活体成像实验结果显示:转铁蛋白和R8共修饰脂质体组的荷瘤裸鼠肿瘤组织荧光最强,其次是转铁蛋白修饰脂质体和R8修饰脂质体(见图 3)。

图3 载DIR的不同类型脂质体在荷瘤裸鼠体内的分布Fig.3 EX vivo images of given various DIR loaded liposomes
3 讨论
理想的肿瘤靶向药物传递系统不仅需要在全身给药后将药物浓集在肿瘤组织,而且还需要将药物高效地传递到肿瘤细胞内,从而将治疗作用最大化并减少抗肿瘤药物的不良反应。肿瘤组织内部由于血管壁间隙较宽、结构完整性差、淋巴回流缺失,造成纳米颗粒在此具有选择性高通透性和滞留性,这种现象被称作肿瘤组织的高通透性和滞留效应(Enhanced permeability and retention effect),简称 EPR效应[13-14]。研究已经证实,转铁蛋白受体在多种肿瘤细胞表面都有大量的表达[15-16],肿瘤细胞表面大量表达的转铁蛋白受体成为了肿瘤靶向给药系统的重要靶点[17]。然而由于肿瘤细胞表面的转铁蛋白受体具有饱和效应,这也就限制了纳米给药系统进入肿瘤细胞的效率。本研究将转铁蛋白与细胞穿膜肽八聚精氨酸共同修饰到脂质体表面,研究共修饰脂质体的体外肿瘤细胞亲和力和体内靶向性。
研究结果显示,转铁蛋白与八聚精氨酸共修饰脂质体的粒径为110 nm左右。有研究显示:纳米载体的粒径范围在10~150 nm能够有效避开网状内皮系统的吞噬,通过EPR效应到达肿瘤组织[18]。本实验通过血清稳定性模拟脂质体在体内的稳定性,结果显示制备的脂质体在50%血清中具有很好的稳定性,因此可以推测共修饰脂质体在体内也会具有较好的稳定性。细胞摄取实验结果显示,经过转铁蛋白和R8共修饰后,肿瘤细胞对脂质体的摄取能力大大增强,显著强于转铁蛋白修饰脂质体和R8修饰脂质体(P<0.05)。在体内分布定性研究中,采用动物活体成像仪定性观察动物体内分布,是目前研究动物体内分布较为快速,准确,直观的新技术。近红外染料穿透力强,干扰小,灵敏度高,常被用于进行小动物的活体成像研究[19]。本章选用近红外染料DIR定性考察所构建的脂质体在小鼠体内的分布,结果显示,转铁蛋白和R8共修饰脂质体在肿瘤组织荧光最强,明显强于其他脂质体。
综上所述,本研究制备的转铁蛋白与R8共修饰脂质体是一种潜在、高效的肿瘤靶向给药系统。转铁蛋白和R8共修饰载脂质体的肿瘤治疗效果研究正在进行中。
[1] Guo J,Gao X,Su L,et al.Aptamer-functionalized PE GPLGA nanoparticles for enhanced anti-glioma drug delivery[J].Biomaterials,2011,32(31):8010-8120.
[2] Gao HL.A cascade targeting strategy for brain neuroglial cells employing nanoparticlesmodified with angiopep-2 peptide and EGFPEGF1 protein[J].Biomaterials,2011,32(33):8669-8675.
[3] Qin Y.Liposome formulated with TAT-modified cholesterol for enhancing the brain delivery[J].Int JPharm,2011,419(1-2):85-95.
[4] Kuai R.Targeted delivery of cargoes into a murine solid tumor by a cell-penetrating peptide and cleavable poly(ethylene glycol)comodified liposomal delivery system via systemic administration[J].Mol.Pharmaceutics,2011,8(6),2151-2161.
[5] Yao Q.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeuticefficacy on brain glioma in animals[J].International Journal of Pharmaceutics,2011,420(2):304-312.
[6] Chee WG.Transferrin-conjugated nanoparticles of Poly(lactide)-D-a-Tocopheryl polyethylene glycol succinate diblock copolymer for targeted drug delivery across the blood brain barrier[J].Biomaterials,2010,31(30):7748-7757.
[7] Ulbrich K,Hekmatara T,Herbert E,et al.Transferrin-and transferrin receptor-antibody-modified nanoparticles enable drug delivery across the blood-brain barrier(BBB)[J].Eur JPharm Biopharm,2009,71(2):251-256.
[8] Alessia C,Isabella O,Silvia D.Transferrin receptor 2 is frequently expressed in human cancer cell lines[J].Blood Cells,Molecules,and Diseases,2007,39(1):82-91.
[9] Shah N,Chaudhari K,Dantuluri P,et al.Paclitaxel-loaded PLGA nanparticles surfacemodified with transferrin and Pluronic P85,an in vitro cell line and in vivo biodistribution studies on rat model[J].J Drug Target,2009,17(7):533-542.
[10] Chang J,Jallouli Y,Kroubi M,et al.Characterization of endocytosis of transferrin-coated PLGA nanoparticles by the blood-brain barrier[J].Int JPharm 2009;379(2):285-292.
[11] Zhang QY.A pH-responsive a-helical cell penetrating peptidemediated liposomal delivery system[J].Biomaterials,2013,34(32):7980-7993.
[12] Ying X.Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J].Journal of Controlled Release,2010,141(2):183-192.
[13] Raymond M.Ligand-targeted liposomes directed against pathological vasculature[J].Journal of liposome research,2002,12(8):129-135.
[14] Xiong XB.Enhanced Intracellular Uptake of Sterically Stabilized Liposomal Doxorubicin[J].Pharmaceutical Research,2005,6(5):933-939.
[15] Li Z.Lipid-polymer hybrid nanoparticles:synthesis,characterization and applications[J].Nano LIFE,2010,1(1):163-173.
[16] Jiang X.Solid tumor penetration by integrin-mediated pegylatedoly(trimethylene-carbonate)nanoparticles loaded with paclitaxel[J].Biomaterials,2013,34(6):1739-1746.
[17] Ikramy A.Octaarginine-modified liposomes:Enhanced cellular uptake and controlled intracellular trafficking[J].International Journal of Pharmaceutics,2008,354(1-2):39-48.
[18] Oba M.Cyclic RGD peptide-conjugated polyplex micelles as atargetable gene delivery system directed to cells possessingαvβ3 and αvβ5 integrins[J].BioconjugChem,2007,18(5):1415-1423.
[19] Scott EN,Gescher AJ,Steward WP,et al.Development of dietary phytochemical chemopreventive agents:biomarkers and choice of dose for early clinical trials[J].Cancer Prev Res(Phila Pa),2009,2(6):525-530.
(编校:吴茜)
Preparation of transferrin and R8 co-modified liposome and study on its targeting to hepatoma
HAN Li-jie,LIUWeiΔ,DU Juan,WEIDong-dong
(Department of Radiotherapy,Cangzhou Central Hospital,Cangzhou 061001,China)
ObjectiveTo prepare transferring and R8 co-modified liposome(TF/R8-LP)for forhepatoma targeting.MethodsThe co-modified liposomewere prepared by film-ultrasonicmethod.The appearance,particle size,Zeta potentialwere evaluated.The cellular uptake by HepG2 cell in vitro was used to evaluate the targeting efficiency and in vivo imaging were used to evaluate the targeting efficiency.ResultsThe particle diameter of the co-modified liposome was(108.5±12.6)nm and the Zeta potentialwas(24.15±4.78)mV.The liposome kept stable in 50%FBS at 24 h.The result demonstrated that the co-modified liposome uptaken by HepG2 were 2.4,2.6 times higher than that of R8-LP and TF-LP,respectively(P<0.05).The evaluation of tumor spheroid penetration and in vivo imaging results showed the co-modified liposome had the strongest fluorescence intensity.ConclusionThe co-modified liposomemight serve as a promising hepatoma delivery system of antitumor drugs.
transferrin;R8;tumor targeting
R735.7
A
1005-1678(2014)04-0033-04
近年来,随着现代生物研究的发展,肿瘤疾病的治疗手段也日益丰富。其中肿瘤的靶向治疗成为了肿瘤研究和治疗的热点[1-2]。八聚精氨酸(R8)是由8个精氨酸组成的直链肽,能够穿过与之相接触的任何细胞的细胞膜[3],具有高效的穿膜作用,R8修饰的脂质体已广泛用于肿瘤靶向给药研究,然而其缺乏选择性限制了R8在全身系统给药中的应用[4-5]。转铁蛋白受体是一种在正常细胞和肿瘤细胞表面都普遍存在的受体,但在肿瘤细胞的表面其表达量是正常细胞的4~5倍[6-8]。转铁蛋白是一种小分子糖蛋白,它可以与转铁蛋白受体结合并在其介导下被细胞内吞入细胞内。将转铁蛋白连接在载药脂质体上从而使后者具有一定的肿瘤靶向性。利用该方法来治疗肿瘤疾病已经被广泛的研究并且取得了初步的成效,然而由于特异性受体的饱和效应,导致转铁蛋白修饰的纳米给药制剂的入胞能力受到一定的限制[9-10]。本研究旨在构建转铁蛋白与R8共修饰的脂质体,将转铁蛋白与肿瘤细胞的特异亲和力和R8的高效穿膜肽作用结合,实现高效的肿瘤靶向给药。
河北省卫生厅2012医学研究重点课题计划(20120118)
韩立杰,男,硕士,主治医师,研究方向:肿瘤的放化疗治疗,E-mail:hanlijie52@163.com;刘伟,通信作者,男,硕士,副主任医师,研究方向:肿瘤的放化疗治疗,E-mail:liuwei@126.com。
