奥沙普秦分散片有关物质方法的研究
2014-09-17刘德军
贺 玲,刘德军,冷 红
(1.辽宁富东制药有限公司,辽宁 本溪117004;2.辽宁中医药大学附属第三医院,辽宁 沈阳110031)
奥沙普秦分散片的化学成分为奥沙普秦,临床上适用于风湿性关节炎、类风湿性关节炎、骨关节炎、肩周炎、强直性脊椎炎、颈肩腕综合征、痛风及外伤和手术后消炎、镇痛。奥沙普秦分散片的药品标准中未收载有关物质检查方法[1],现参考《中国药典》2010年版二部奥沙普秦原料的有关物质检查方法(HPLC)进行测定,方法如下。
1 材料与方法
1.1 材料
仪器:高效液相色谱仪1260(安捷伦科技有限公司);紫外-可见分光光度计TU-1810(北京普析通用仪器有限责任公司)。试药:乙腈(色谱纯,美国JTBaker);娃哈哈纯化水。样品:奥沙普秦分散片(每片含奥沙普秦0.2g)批号为130901;130902;130903;奥沙普秦原料(符合《中国药典》2010年版二部奥沙普秦原料的有关物质测定)。
1.2 方法
1.2.1 有关物质方法的确定
参考《中国药典》2010年版二部奥沙普秦分散片药品标准项下的有关物质检查方法[2],采用HPLC法进行试验。选用乙腈作为溶剂使溶解。
1.2.2 色谱条件
仪器:高效液相色谱仪安捷伦1260;色谱柱:迪马C18(5μm,4.6mm×250mm);流动相:水(用磷酸调 p H 值为2.5):乙腈(50:50);检测波长:254nm;流速:1.0m L/min。
1.2.3 检测波长的选择[3]
称取奥沙普秦适量,加乙腈使溶解,制成每1mL中约含2mg的溶液,取该溶液适量至紫外-可见分光光度计在190~400nm范围扫描最大吸收峰。
1.2.4 色谱条件
以十八烷基硅烷键合硅胶为填充剂;以乙腈-水(用磷酸调p H值为2.5)(50:50)为流动相;检测波长为254nm。理论板数按奥沙普秦计算应不低于2000。
1.2.5 辅料干扰试验
取除去主药的空白辅料配成空白辅料加乙腈使溶解,滤过,取续滤液作为阴性对照溶液,取20μL,按色谱条件,作为阴性对照试验。
1.2.6 耐用性试验
1.2.6.1 色谱柱:分别选用迪马公司 C18(5μm,250mm×4.6mm)和江申C18(5μm,150mm×4.6mm)色谱柱,分别注入供试品溶液20μL。按色谱条件,作为色谱柱耐用性试验。
1.2.6.2 流动相:流动相中有机相的比例变更±5%,分别为水(用磷酸调p H 值为2.5):乙腈(52.5:47.5)和(47.5:52.5)分别注入供试品溶液20μL。按色谱条件,作为流动相耐用性试验。
1.2.6.3 柱温:调节柱温10~30℃,分别注入供试品溶液20μL。按色谱条件,作为柱温耐用性试验。
1.2.7 最低检测限
逐级稀释奥沙普秦对照品溶液,测定样品峰的峰高,同时测定相同条件下的色谱基线噪声,取基线噪声的3倍值作为最低检测限。计算最低检测限。
1.2.8 专属性[4]
1.2.8.1 酸降解试验:取本品1片研细至100m L容量瓶中加0.1mol/L的盐酸10mL室温放置24h后,加乙腈使溶解,照色谱条件测定。
1.2.8.2 碱降解试验:取本品1片研细至100m L容量瓶中加0.1mol/L的氢氧化钠溶液10m L室温放置24h后,加乙腈使溶解,照色谱条件测定。
1.2.8.3 光降解试验:取本品适量研细置日光下直接照射24h后,取约1片至100m L容量瓶中加乙腈使溶解,照色谱条件测定。
1.2.8.4 高温试验:取本品适量研细置130℃烘箱8h后,取约1片至100mL容量瓶中加乙腈使溶解,照色谱条件测定。
1.2.8.5 氧化降解试验:取本品1片研细至100m L容量瓶中分别加15%、30%的双氧水10m L室温放置后,加乙腈使溶解,照色谱条件测定。
1.2.9 有关物质测定
避光操作。取本品,加乙腈溶解并定量稀释制成每1m L中约含2mg的溶液,作为供试品溶液;精密量取供试品溶液适量,用乙腈定量稀释制成每1mL中约含20μg的溶液作为对照品溶液。照色谱条件进行试验。取对照溶液20μL,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的30%;再精密量取供试品溶液和对照品溶液各20μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的5倍。供试品溶液的色谱图中如有杂质峰,各杂质峰的面积和不得大于对照溶液的主峰面积(1.0%)。原料同法操作。记录色谱图,计算杂质含量。
2 结果
2.1 最大吸收
在190~400nm范围扫描结果表明本品在254nm处有最大吸收,因此选择254nm作为有关物质测定的检测波长。
2.2 阴性对照
空白辅料制成的阴性对照溶液色谱图无杂质峰,对测定结果无干扰。
2.3 耐用性试验
选用不同的色谱柱进行测定,供试品溶液色谱图的理论板数、分离度及出峰顺序基本一致,均满足系统适应性的要求。流动相、柱温变化,供试品溶液色谱图的理论板数、分离度及出峰顺序基本一致,杂质检出无明显变化。结果显示色谱柱、流动相、柱温对有关物质的检出无影响。
2.4 最低检测限
根据图谱求得奥沙普秦的最低检测限为1.25ng,实验中有关物质测定的奥沙普秦进样量为40μg,即样品中杂质含量大于0.003%可被检出。
2.5 专属性
2.5.1 酸降解试验:结果显示,杂质色谱峰无较大增加,该供试品对酸稳定。见图1。
2.5.2 碱降解试验:结果显示,杂质色谱峰无较大增加,该供试品对碱稳定。见图1。
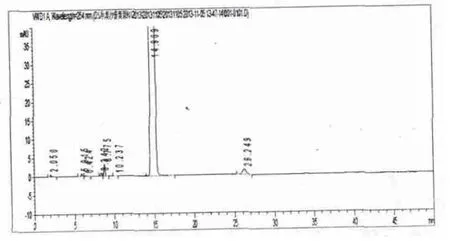
图1 酸降解、碱降解、高温、氧化图谱
2.5.3 光降解试验:结果显示,出现较多新杂质色谱峰(相对保留时间分别约为 0.25、0.34、0.38、0.41、0.70、0.80等),原有相对保留时间1.75倍杂质峰峰面积增大,故光照对供试品影响较大,应注意避光操作。见图2。
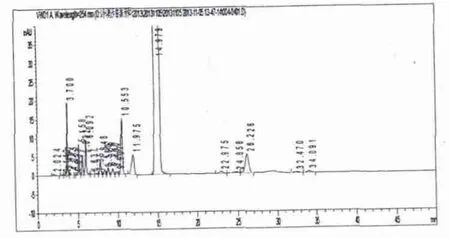
图2 光照试验图谱
2.5.4 高温试验:结果显示,杂质峰无较大增加,该供试品对高温稳定。见图1。
2.5.5 氧化降解试验:结果显示,杂质色谱峰无较大增加,该供试品对碱稳定。见图1。
2.6 有关物质的测定
结果显示,自制样品与原料药有关物质的种类基本一致。见表1。
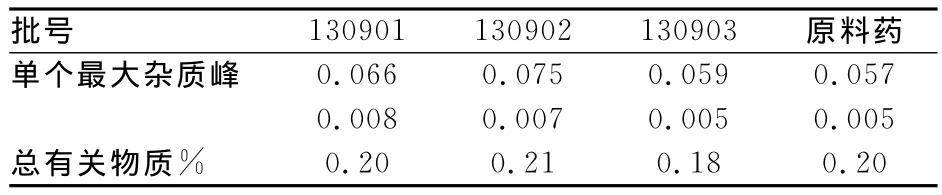
表1 有关物质测定结果
2.7 有关物质限度的确定
参考《中国药典》奥沙普秦标准项下的有关物质检查限度,并根据本品三批样品和原料药样品的实测结果,确定本品的有关物质的限度即供试品溶液的色谱图中主成分峰之后如显杂质峰,各杂质峰的面积和不得大于对照溶液的主峰面积(1.0%),三批样品有关物质均符合上述限度。
3 讨论
3.1 奥沙普秦分散片药品标准中未收载有关物质检查方法,现参考《中国药典》2010版二部奥沙普秦原料的有关物质检查方法(HPLC)进行测定[2],采用 HPLC法测定有关物质,操作简便、快速,测定结果准确可靠,从而能有效地控制该药的质量。
3.2 专属性试验表明:光照对奥沙普秦影响较大,光照使奥沙普秦有关物质降解,产生大量杂质,影响主药含量,影响药效。故检验过程应该避免光照,在遮光棕色瓶中试验。药品生产贮藏时也应注意避光。
[1]国家食品药品监督管理局标准(试行)WS-454(X-390)-2000.中华人民共和国国家药品监督管理局.2000年12月22日
[2]国家药典委员会.中华人民共和国药典2010年版(二部)[M].北京:中国中医药科技出版社,2010,1037
[3]郭宏,高金波,邱树勇.高效液相色谱法测定恶丙嗪片的含量[J].黑龙江医药科学,2001,24(2):16
[4]国家药典委员会.中华人民共和国药典2010年版(二部)[M].北京:中国中医药科技出版社,2010,附录194
